食积因素对FM1流感病毒感染小鼠免疫功能影响的实验研究
施金凤 于 河 王 上 谷晓红
(1河南省郑州市第二中医院,郑州,450002;2北京中医药大学,北京,100029;3湖北中医药大学,武汉,430061)
小儿脏腑娇嫩,形气未充,肺脾常不足,且寒暖不能自调,乳食不知自节易于形成食积,外易受六淫所侵而发病,临床多以呼吸系统为多[1]。加之小儿体属“纯阳”,呼吸道黏膜防御机制不够完善,故感邪易从热化而成急性外感热病。中医学认为积食积热可促进肺热证的发生、发展,如叶天士所言:“胃肠为市,故阳明为成温之薮也”。临床发现,食积小儿容易发生急性呼吸系统感染,而具体病理机制尚待进一步发掘探索。有研究发现流感病毒感染与机体免疫功能失调有密切关系[2],而细胞因子在感染性疾病的发生、发展中起着重要的作用。有学者认为T辅助淋巴细胞TH1/TH2的功能可以反应机体促炎和抗炎反应的失衡情况[3]。TH1细胞主要分泌干扰素γ,TH2细胞则主要分泌IL-4,本研究试图从TH1(IFN-γ)和TH2(IL-4)平衡的角度来探讨食积因素在病毒感染状态下细胞因子谱的改变,以明确其对机体免疫功能的影响。尝试揭示食积影响肺系热证的发展变化的作用机制,为临床肺胃同治提供依据,对于急性呼吸系统传染病的防治有一定指导意义。
1 材料与方法
1.1 动物分组 昆明小鼠,雄性,体重11~13 g,180只,清洁级,购于北京维通利华实验动物技术有限公司[SCXK(京)2006-0009]。购入后置免疫教研室动物房实验动物洁净柜饲养。将小鼠按体重随机分为3组:正常组、单纯感染组、食积感染组,每组60只。
1.2 模型制作 正常组:正常饲料,不限食水。从实验第1天起,予生理盐水按0.2 mL/10 g灌胃,2次/d,共灌胃4 d。于第5天乙醚麻醉后,给予生理盐水50 μL滴鼻。单纯感染组:正常饲料,不限食水。从实验第1天起,予生理盐水按0.2 mL/10 g灌胃,2次/d,共灌胃4 d。于第5天乙醚麻醉后,予FM1流感病毒50 μL滴鼻。食积感染组:自制高蛋白、高热量饲料(豆粉、面粉、牛奶粉、鱼肉松,四者按2∶1∶1∶1 比例配制),不限食水。从实验第1天起,予52%浓度的牛乳按0.2 mL/10 g灌胃,2次/d,共灌胃4 d。于第5天乙醚麻醉后,予流感病毒50 μL滴鼻。
1.3 主要试剂及药物 免疫球蛋白M酶联免疫试剂盒IgM(201103)ELISA;白介素4酶联免疫试剂盒IL-4(201102)ELISA、干扰素γ酶联免疫试剂盒IFN-γ(201102)ELISA IT:北京康源瑞得生物技术有限公司提供;病毒:流感病毒亚洲甲型鼠肺适应株(FM1)由北京中医药大学免疫学教研室提供,LD50为10-3.7,4LD50的流感病毒液为1∶150;乙醚、乙醇、生理盐水。
1.4 观察项目 1)小鼠体征;2)体重:从实验第1天开始,连续记录小鼠体重,至取材前;3)正常组与单纯感染组、单纯感染组分别在感染病毒后第1、3、5天,各组每次取20只小鼠,摘眼球取血,其中每组中的10只,静置后低温离心(1000 r/min),离心15 min,留取血清,将血清置于-80℃冰箱中备用,行酶联免疫分析法(ELISA)测各组小鼠血清IL-4、IFN-γ含量;每组中另外的10只,静置后低温离心(3000 r/min),离心10 min,留取血清,将血清置于-80℃冰箱中备用,行酶联免疫分析法(ELISA)测各组小鼠血清特异性抗体IgM含量。
1.5 统计学分析 采用SPSS13.0统计软件处理数据,各组数据均值以±s表示,进行单因素方差分析。
2 结果
2.1 小鼠体征 正常组小鼠粪便质粗,量多,未见明显异常。单纯感染组小鼠活动减少,扎堆,耸毛,毛无光泽,蜷缩,活动减少,粪便质粗,量多;食积感染组小鼠活动减少,扎堆,蜷缩,眼睛分泌物多,睁眼受限,毛色发黄结成束状,较脏,粪便呈黄棕色、质细,量较少,较硬。
2.2 血清IgM含量、IFN-γ、IL-4、TH1/TH2水平
2.2.1 小鼠血清IgM 结果显示,小鼠感染FM1病毒后第1、3天,单纯感染组较正常组小鼠血清IgM升高,有统计学意义(P<0.01);食积感染组较正常组IgM水平升高,但结果无统计学意义(P>0.05);食积感染组水平较单纯感染组降低,但结果无统计学意义(P>0.05)。小鼠感染FM1病毒后第5天,单纯感染组、食积感染组小鼠均较正常组小鼠血清IgM含量下降,且食积感染组结果差异有统计学意义(P<0.05),食积感染组较单纯感染组、正常组小鼠血清IgM含量明显降低,且结果有统计学意义(P<0.01)。见表1。
表1 小鼠血清IgM(μg/mL) (±s)
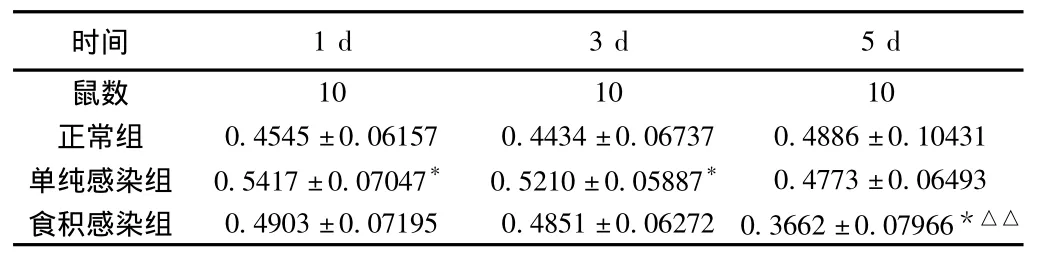
表1 小鼠血清IgM(μg/mL) (±s)
注:与同天正常组相比,*P<0.01;与同天单纯感染组相比,△△P<0.01。
?
2.2.2 细胞因子水平
2.2.2.1 小鼠血清IL-4变化 小鼠感染FM1病毒后第1、3、5天,单纯感染组、食积感染组小鼠血清IL-4水平均较正常组升高,且食积感染组结果有统计学意义(P<0.01),单纯感染组与正常组比较第3天结果差异显著(P>0.05),食积感染组小鼠较单纯感染组升高,且在第1、5天时结果有统计学意义(P<0.01),见表2。
表2 小鼠血清IL-4(pg/mL)(±s)
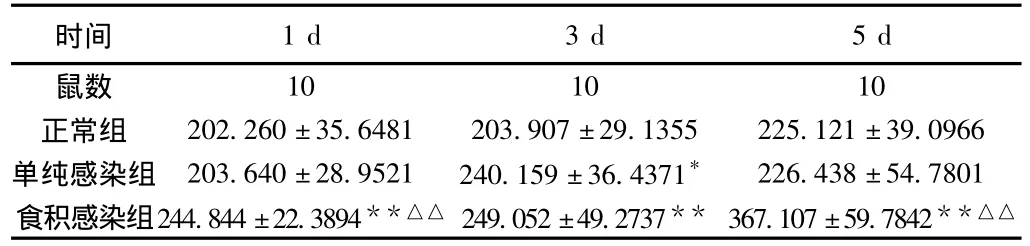
表2 小鼠血清IL-4(pg/mL)(±s)
注:与同天正常组相比,*P<0.05,**P<0.01;与同天单纯感染组相比,△△P <0.01。
10 10 10正常组 202.260±35.6481 203.907±29.1355 225.121±39.0966单纯感染组 203.640±28.9521 240.159±36.4371* 226.438±54.7801食积感染组244.844±22.3894**△△ 249.052±49.2737** 367.107±59.7842 1 d 3 d 5 d鼠数时间**△△
2.2.2.2 小鼠血清IFN-γ变化 小鼠感染FM1病毒后第1天,单纯感染组、食积感染组小鼠血清IFN-γ均较正常组升高,但差异无统计学意义(P>0.05);于感染后第3、5天,单纯感染组及食积感染组均较正常组下降,且在第5天下降明显差异有统计学意义(P<0.01),食积感染组较单纯感染组下降更为明显,但差异无统计学意义(P>0.05),见表3。
表3 小鼠血清IFN-γ(pg/mL)(±s)
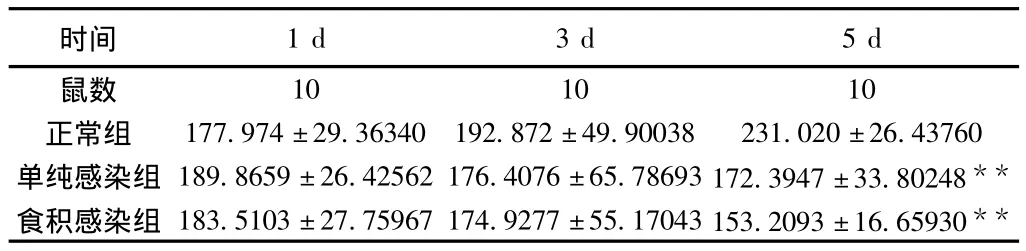
表3 小鼠血清IFN-γ(pg/mL)(±s)
注:与同天正常组相比,**P<0.01。
?
2.2.2.3 小鼠血清TH1/TH2变化 小鼠感染FM1病毒后第1、3、5天,单纯感染组、食积感染组均较正常组降低,且在第3天差异有统计学意义(P<0.05),而在第3、5天食积感染组较正常组降低更为明显,且差异有统计学意义(P<0.05);食积感染组在不同时相虽均较单纯感染组下降,但差异无统计学意义(P>0.05),见表4。
表4 小鼠血清TH1/TH2(±s)
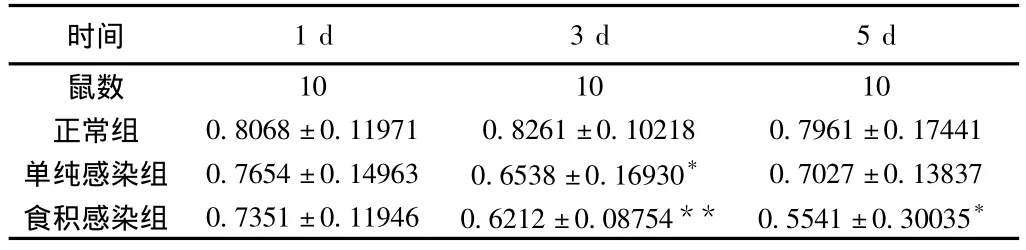
表4 小鼠血清TH1/TH2(±s)
注:与同天正常组相比,*P<0.05,**P <0.01。
?
3 讨论
基于小儿特殊的生理病理特点,使得小儿易发生食积,并表现出病理状态,从而引发各种相关疾病。已有研究证实,食积可导致肠源性内毒素血症及肺损伤等[4],随着食积实验研究不断深入,食积不仅对血生化、胃肠功能的改变产生了影响,而且对免疫功能也有作用。毕可恩等通过对食积状态下小鼠免疫功能的测定发现,非特异性免疫的巨噬细胞吞噬功能、细胞免疫的迟发性变态反应试验、体液免疫的血清溶血素测定等免疫指标,食积组明显低于正常组,推测免疫功能的改变可能是食积患儿易于反复感染外邪的内在病理基础[5]。流感病毒经由呼吸道侵入机体后不仅能在呼吸道的细胞内增殖,导致呼吸道各类细胞变性、坏死,病毒颗粒尚可穿过呼吸道黏膜,引起进行性感染,导致淋巴细胞、单核细胞及多核细胞生长特性改变、功能降低甚至溶解、凋亡,从而导致机体免疫功能降低[6]。病毒可激活小鼠的免疫细胞产生氧自由基、NO和大量细胞因子,而这些因子作为免疫介质介导的全身病理反应导致小鼠发病[7],并造成免疫器官损伤和功能下降。免疫球蛋白是具有抗体活性或化学结构上与抗体相似的球蛋白,是一类重要的免疫效应分子,经抗原诱导可转化为抗体,IgM就是其中的一种,其主要参与机体的体液免疫调节,主要作用是与抗原发生免疫反应,生成抗原-抗体复合物,从而阻断病原体对机体的危害。机体在病毒、细菌等感染后,抗原刺激诱导体液免疫应答过程中,IgM产生时间最早,血清中以IgM为代表,形成对付外源性微生物或病毒侵入的第一道防线[8]。本实验中,在小鼠感染FM1病毒后第5天,血清IgM含量食积感染组较正常组及单纯感染组均下降,说明食积小鼠感染FM1病毒感染后,机体体液免疫能力明显下降,这与黎交清等[9]报道的小儿感染的IgM指标有所下降是一致的。而单纯感染组小鼠IgM水平较正常组降低,这与国内报道也是一致的[10-11]。小鼠在感染FM1病毒后第1、3天,单纯感染组及食积感染组小鼠血清IgM含量均较正常组升高,可能与淋巴细胞迅速增殖,从而产生较多的IgM积极参与机体的体液免疫应答,阻断病毒对机体的危害有关。而食积感染组小鼠血清IgM水平较单纯感染组下降明显,可能与阳明积热本身已经对机体的体液免疫能力产生了影响,导致机体的抗感染能力下降,一旦受到病毒的侵袭后,导致机体IgM浓度出现明显降低,进一步影响机体免疫能力及抗感染能力,这与报道的感染期间的细胞免疫功能和补体系统功能相对减弱,机体抗感染能力随之下降也是一致的[12],食积通过调节机体体液免疫影响了机体IgM的含量,从而导致机体抗感染能力下降。
干扰素(IFN)是一种广泛的抗病毒物质,是机体抗病毒感染中最重要的细胞因子之一,在病毒性疾病的康复中有重要地位[13]。有实验研究发现,病毒感染小鼠后,模型组IFN-γ水平较正常组明显降低,说明流感病毒感染导致机体的细胞免疫功能减弱,对免疫系统产生了抑制作用。流感病毒经抗原递呈后活化CD4+T细胞,活化的CD4+Th细胞分泌多种细胞因子,可分化为Th1,Th2两个亚类,正常状态下,TH1/TH2通过分泌细胞因子彼此调节,相互制约,相对平衡,以维持正常免疫状态。本实验中,病毒感染后,小鼠血清IFN-γ/IL-4水平,单纯感染组、食积感染组均较正常组下降,尤其在病毒感染后的第3、5天降低较为明显,食积感染组降低更为明显,食积感染组小鼠TH1/TH2水平较正常组及单纯感染组降低,说明病毒感染引起了机体抗炎与促炎水平的失衡,从而导致了机体免疫功能的紊乱,且食积感染组对机体免疫失衡的影响更为明显。食积感染组较单纯感染组小鼠血清IFN-γ/IL-4水平有下降趋势,但其对机体免疫失衡的影响是否更为严重仍需进一步论证。因此,食积因素可能通过影响机体IgM产生、IFN-γ、IL-4细胞因子水平,导致机体免疫系统发生失调,从而对机体免疫功能产生了影响,说明食积可能与对肺热证的发生、发展存在一定相关性。因此,食积因素可能通过影响小儿机体免疫功能,从而使小儿易于发生呼吸系统感染,本研究提示及时消除食积内因,对于呼吸系统感染性疾病易感人群可以起到防护的目的。
[1]陈超,汪受传.“肺与大肠相表里”理论在儿科临证中的应用[J].中医药学报,2006,34(6):43.
[2]郭海,杨进,龚婕宁,等.连花清瘟胶囊对流感病毒感染小鼠肺组织γ-IFN 的影响[J].河南中医,2007,27(5):29.
[3]欧敏,董建华,段蕴轴.清肺饮对流感病毒感染小鼠免疫功能的调节作用[J].北京中医药大学学报,1998,21(6):21.
[4]王上,于河,等小儿食积的研究进展[J].北京中医药大学学报:中医临床版,2011,18(3):41.
[5]毕可恩,刘爱华,朱有名,等.食积小鼠模型免疫功能的实验研究[J].山东中医学院学报,1991,15(4):48-50.
[6]李华玲.流行性感冒病毒诱导细胞凋亡的研究进展综述[J].国外医学临床生物化学与检验学分册,2001,22(2):85-87.
[7]MoriI,KomatsuT,TakeuchiK,et al.Invivo inductionof a Poptesis by influenza virus[J].JGenvirol,1995,76(11):2869-2873.
[8]黄隽敏,徐爱晖,王明丽,等.合肥地区成人急性上呼吸道病毒感染患者血清IgM测定[J].安徽医科大学学报,2008,43(1):114.
[9]黎清交,曾素萍,黎昌茂,等.白细胞、C反应蛋白和免疫球蛋白检测在小儿肺炎中的运用[J].山东医药,2010,50(9):65-66.
[10]LUJ,YE HP,LOU JT,etal.APPlication of C- reactive Protein in childrenPatients[J].Shanghai Journal of Medical Laboratory Sciences,1999,14(5):266.
[11]LU J,YE HP,ZHANG ZJ,et al.Observation of infant Pneumonia secretion tyPe IgA contentandfull body immuno state[J].Journal of Pracical Pediatrics,1991,(6):20-21.
[12]传兵.支气管肺炎患儿治疗前后血清SIL-2R和T淋巴细胞亚群的水平探讨[J].放射免疫学杂志,2005,18(5):401-402.
[13]靳文学,杨宇.从粘膜免疫系统看“肺与大肠相表里”[J].四川中医,2005,23(12):1-2.

