iASPP蛋白抗体的制备及iASPP在结肠癌组织中的表达及意义
徐洪军 李晓莹 韩 笑 安丽萍 王海莉 关晓辉
(北华大学附属医院,吉林 吉林 132001)
P53凋亡刺激蛋白(ASPP)家族包括3个成员:ASPP1,ASPP2和iASPP〔1〕。ASPP1和 ASPP2蛋白与 P53结合后能激活P53的抑癌功能,iASPP与P53结合后可抑制P53的抑癌功能。本研究利用生物信息学软件分析人iASPP蛋白的二级结构、亲水性、疏水性和抗原性等理化性质,制备多克隆抗体,分析其与结肠癌分化程度、浸润深度、淋巴结转移及预后的关系。
1 材料与方法
1.1 材料
1.1.1 iASPP抗原与实验动物 iASPP抗原由本实验室制备,新西兰大白兔购自吉林省生物制品所。
1.1.2 资料选择 选取北华大学附属医院2005年1月至2010年12月住院手术治疗的结肠癌病人样本30例,其中男16例,女14例,年龄40~75(平均57.5)岁。正常结肠黏膜15例。标本来自北华大学附属医院病理科保存的蜡块。
1.1.3 试剂盒 S-P免疫组织化学染色试剂盒为美国Zymed公司产品,购自北京中山生物技术有限公司。Western印迹、ELISA试剂盒,购自北京西美杰生物技术有限公司。
1.1.4 主要试剂 完全和不完全弗氏佐剂购自北京鼎国生物公司;人iASPP蛋白和辣根过氧化物酶(HRP)标记羊抗兔IgG抗体购自Santa Cruz公司;化学发光法(ECL)试剂盒购自Amersham公司。
1.2 方法
1.2.1 生物信息学分析 登录进入http://www.ncbi.nlm.nih.gov,采用Blastn和Blastx程序,进行同源性检索和保守性分析。采用ProtScale程序、ExPASy工具包程序、SWISS PROT蛋白数据库和DNA star(Protean)生物信息学软件对iASPP的二级结构、抗原性、亲疏水性、结合位点、氨基酸的带电性等理化性质进行分析。
1.2.2 iASPP多肽的设计与合成 根据生物信息学分析和预测,按抗原性、亲疏水性和同源性分析,设计并合成一段多肽,即iASPP:NH2-TAFEKCDPYREGYADCATYL-COOH。多肽的合成与载体蛋白-血蓝素联接交由北京博奥森生物技术有限公司完成。多肽的合成采用9-氟甲氧羰基(Fmoc)固相合成法,利用高效液相法进行纯化,纯化后的样品再用高效液相色谱法(HPLC)分析,纯度为95%。
1.2.3 动物免疫 将纯化后的多肽抗原液250 μl与等体积的弗氏完全佐剂混合,充分乳化后采用背部多点注射法免疫新西兰白兔。2 w后取多肽抗原液加等体积弗氏不完全佐剂相同方法加强免疫,以后每2周免疫1次,共5次,末次免疫后5~7 d于耳缘静脉取血,间接ELISA方法检测血清达理想效价后颈动脉放血,收集兔血清。
1.2.4 免疫兔血清采集及纯化 采用颈总动脉放血法收集兔血清。盐析法初步纯化兔血清。
1.2.5 间接ELISA方法测定血清效价 于注射免疫程序开始前和每次注射免疫后1 w,从兔耳缘静脉取血1 ml,离心取上清测定血清效价。经过包被、洗涤、封闭、洗涤、加一抗、洗涤、加二抗、洗涤、显色、终止反应等过程。酶标仪测定A492值,以(被检标本值-空白值)/(阴性对照值-空白值)即P/N≥2.1为阳性。
1.2.6 多克隆抗体的Western印迹鉴定 蛋白采用十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)转膜,以纯化的免疫兔血清为一抗,羊抗兔HRP-IgG抗体为二抗,以免疫前兔血清为阴性对照,通过ECL显色系统进行Western印迹检测。
1.2.7 免疫组织化学 取组织切片,应用过氧化物酶标记的链霉素染色进行免疫组织化学染色(S-P法):切片脱蜡,水化,水浴法抗原修复,3%H2O2阻断内源性氧化物酶活性。正常血清孵育,滴加 ASPP1抗体,4℃过夜,依次经磷酸盐缓冲液(PBS)洗涤,孵育,二氨基联苯胺(DAB)染色后,苏木精复染,脱水,透明,封片。结果判断:用PBS代替一抗作阴性对照,用已知的阳性切片作阳性对照。染色结果判定以肿瘤细胞胞浆中出现棕黄色颗粒为阳性细胞,高倍镜下取4个视野计数200个细胞,按阳性细胞所占百分比将染色结果分为:阳性细胞<5%为(-);5% ~25%为(+);25% ~50%为(⧺);>50%为(⧻)。
1.3 统计学方法 应用SPSS17.0软件进行分析,采用计数资料四格表及四格表的确切概率法、相关分析等。
2 结果
2.1 多肽抗体的制备和效价 iASPP肽段具有良好的免疫原性,在接受第1次免疫后2 w,体内抗体滴度开始上升,5次主动免疫结束后即第9周,兔抗血清与多肽抗原发生强阳性反应,对照组兔血清不与多肽发生免疫反应。家兔免疫后获得的血清进行倍比稀释,随着血清稀释度的增加,其反应孔OD值降低,以 P/N≥2.1为阳性,间接 ELISA测定效价均大于1∶160 000,表明获得高效价的多抗。
2.2 多肽抗体的特异性 Western印迹分析结果显示转印至PVDF膜上的iASPP蛋白与免疫兔血清形成单一阳性染色带,与其蛋白分子量的理论值相符,兔阴性对照血清无条带出现,表明获得了抗iASPP的多克隆抗体。
2.3 iASPP与结肠癌的组织分化程度、浸润深度、淋巴结转移的差异性及其在组织中的表达 癌组织不同分化程度者iASPP阳性率差异显著(P<0.05);在不同浸润深度及有无淋巴结转移的患者间iASPP表达无显著性差异(P>0.05)。结肠癌组织中iASPP的阳性表达率高于正常结肠组织(P<0.05)。见表1,图 1。
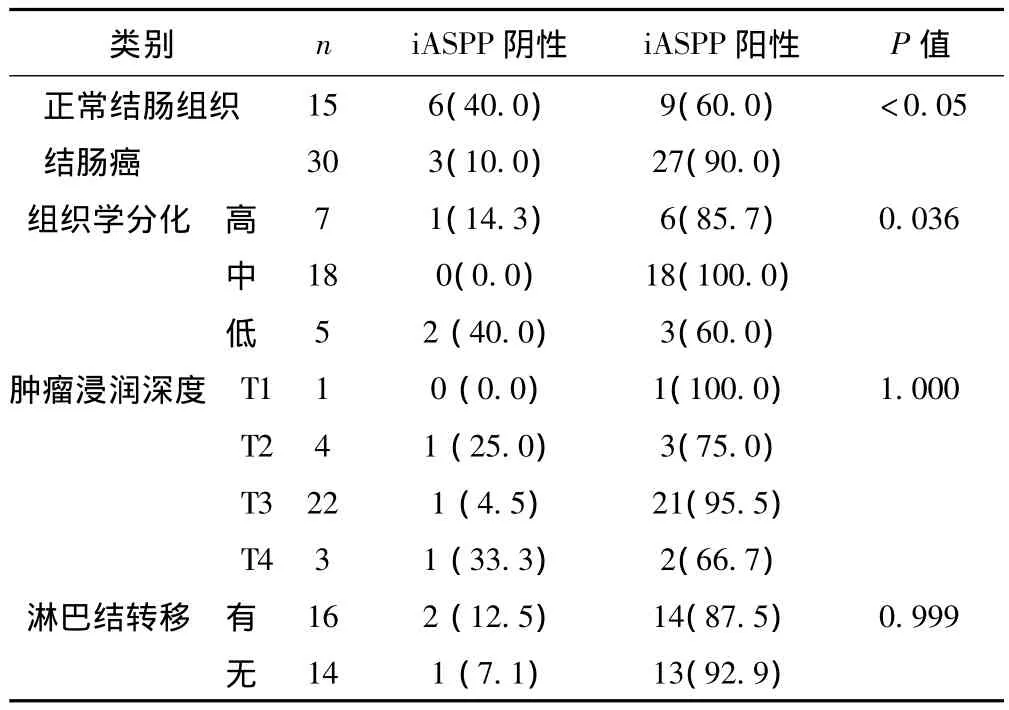
表1 iASPP阳性表达与结肠癌的组织分化程度、浸润深度、淋巴结转移的关系〔n(%)〕
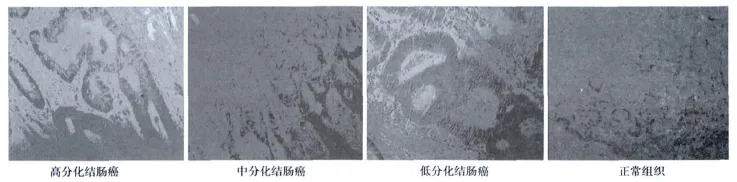
图1 iASPP免疫组化结果(×10)
3 讨论
结肠癌以41~51岁发病率最高,从病因看大多数来自腺瘤癌变,在形态学上可见到炎症、增生、腺瘤、癌变各个阶段以及其对应的染色体改变。多种因素相互作用的结果导致了结肠癌的发生,其中结肠腺瘤是结肠癌发生的重要病因之一〔2〕。结肠癌的腺瘤-癌序列学说中,细胞增殖与凋亡失衡是结肠癌发生的重要机制。
P53是现今公认的与肿瘤发生发展相关性最高的抑癌基因之一〔3〕,近年新发现的ASPP蛋白家族,对P53起调控作用。其作用机制为:ASPP与P53结合形成ASPP-P53复合物作用于原凋亡基因启动子,ASPP的微小变化就可引起P53结合DNA的能力发生改变,从而影响P53诱导凋亡的能力。ASPP1,ASPP2与iASPP作用相反,iASPP是与ASPP1和ASPP2竞争P53的结合位点,影响ASPP-P53复合物与DNA结合的能力,从而阻止P53 的细胞凋亡功能〔4,5〕。
刘航等〔6〕对野生型P53和ASPP蛋白水平正常的8例乳腺癌患者的iASPP蛋白含量进行系统检测,测试结果有7例患者的iASPP含量都比较高。在急性白血病患者细胞中,Zhang等〔4,7,8〕的研究发现 iASPP mRNA 表达水平比正常者及急性白血病完全缓解者要高很多。在白血病细胞中,Liu等〔9,10〕研究发现ASPP1及ASPP2的mRNA低表达与iASPP的mRNA高表达共存的现象,阐述了ASPP1和ASPP2的表达升高和iASPP的表达下调,也许在白血病发病机制中起重要作用。
以上的研究证明,ASPP蛋白是体内P53的关键调节蛋白,ASPP1和ASPP2通过提高原凋亡基因的活力促进P53依赖的细胞死亡,而iASPP与其作用相反。该基因家族与肿瘤的关系具有普遍意义。有文献报道,在正常成人组织中,iASPP有低表达,而其他癌组织中,iASPP表达较为活跃,这与本研究结果部分相符。导致这一结果的原因可能与很多因素有关,还需继续研究与探讨。
综上,可以考虑通过提高ASPP1,ASPP2的高表达,抑制iASPP的表达来提高野生型P53诱导细胞凋亡的功能,达到促进肿瘤细胞凋亡、抑制肿瘤的作用。
1 陈燕平,刘泽军.ASPP蛋白家族在肿瘤细胞凋亡中的作用〔J〕.癌变、畸变突变,2006;6:488-90.
2 陈 坤,舒国通,马新源,等.肠息肉与结直肠癌发病关系队列研究〔J〕.中国公共卫生,2004;20(2):168-70.
3 胡红艳,魏万里.ASPP基因家族与肿瘤的研究进展〔J〕.实用医学杂志,2009;25(15):2593-5.
4 方赞熙,黄如欣,张忠英.P53凋亡刺激蛋白抑制因子的研究进展〔J〕.医学综述,2007;13(9):661-2.
5 张 云,刘泽军.新的抑癌基因ASPP对P53作用的研究进展〔J〕.生命科学,2004;16(2):79-80.
6 刘 航,王 敏.P53调节蛋白ASPPs的分子生物学特性及其与肿瘤的关系〔J〕.医学分子生物学杂志,2007;4(5):427-30.
7 张 云,刘泽军,李 维,等.肿瘤细胞中ASPP2 mRNA的表达及意义〔J〕.第三军医大学学报,2003;25(23):2103-5.
8 Zhang X,Wang M,Zhou C,et al.The expression of iASPP in acute leukemias〔J〕.Leuk Res,2005;29(2):179-83.
9 Liu ZJ,Zhang Y,Zhang XB,et al.Abnormal mRNA expression of ASPP members in leukemia cell lines〔J〕.Leukemia,2004;18(4):880.
10 张 云,刘泽军,刘 彬,等.抑癌基因ASPP家族在肿瘤细胞株中的表达研究〔J〕.临床血液学杂志(输血与检验版),2009;22(1):78-80.

