新型长链芳香酰胺聚合物的合成
刘静媛, 曹金鑫, 黄睛菲, 陈中祝, 王启卫, 邓金根, 朱 槿
( 1. 中国科学院 成都有机化学研究所,四川 成都 610041; 2. 中国科学院大学,北京 100039)
自1996年Gellman小组设计合成出第一个直链多肽折叠物体系以来,设计具有确定二级结构的非天然折叠物的研究引起了化学家极大的兴趣[1~6]。2000年,Gong小组[4,7,8]设计了一类利用分子内三中心氢键形成具有刚性骨架的寡聚芳香酰胺折叠物Ⅰ(Chart 1)。随着链的增长,它们的骨架会弯曲成月牙型或螺旋状,由此获得具有洞穴或螺旋管道的超分子结构。
在制备较长链的芳香酰胺寡聚物过程中,他们尝试了逐步耦合的合成策略,仅得到螺旋圈数不大于三的寡聚物[9]。当采用二酸酰氯和二胺单体进行缩合反应时,并没得到聚合物Ⅱ(Chart 1),却高产率的得到大环化合物[10]。由此说明这类芳香酰胺化合物很强的刚性骨架阻碍了线性长链分子的形成。

Ⅰ ⅡChart 1
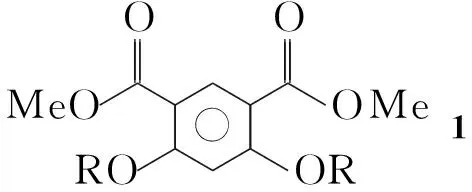
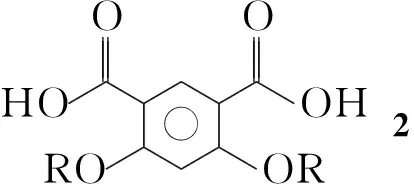
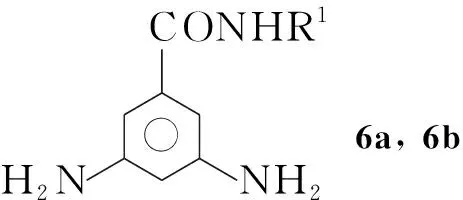
本文在化合物Ⅱ的结构基础上,设计并合成了一类新型芳香酰胺聚合物7a和7b。以4,6-二羟基-1,3-苯二甲酸甲酯为原料,经Williamson反应、水解和酰化反应制得4,6-二烷氧基-1,3-苯二甲酰氯单体3。 由3,5-二硝基苯甲酸为起始原料,经酰化、缩合、还原反应得到二胺单体6a,6b; 6a, 6b分别与3经缩合反应合成了两个新型的长链芳香酰胺聚合物7a和7b(Scheme 1),其结构经1H NMR, IR和GPC表征。


CompabR1-C8H17-C12H25
Scheme1
7a和7b同样因为分子骨架具有一定的刚性,可以发生折叠形成螺旋构象,每层螺旋间的芳环π-π堆积作用可以进一步稳定螺旋构象。分子骨架中的三中心二氢键变为一个氢键后,其骨架的刚性明显减弱,有利于长链骨架的形成。二胺侧链引入的酰胺(-CONHR)可以发生螺旋层间的分子内氢键,进一步稳定其螺旋折叠构象[11]。
1 实验部分
1.1 仪器与试剂
Bu Chi B-545型熔点仪(温度未校正);Bruker-300型核磁共振仪(CDCl3为溶剂,TMS为内标);Thermo Fisher Nicolet 6700型红外光谱仪(KBr压片);MicrOTOF-QⅡ 10203型高分辨质谱仪;SPD-20A型凝胶色谱仪(GPC, THF, TSK gel GMHHR-N, 254 nm, 0.35 mL·min-1, 20 ℃, 133.3 Pa)。
正辛胺和正十二胺,阿拉丁试剂公司;其余所用试剂均为分析纯,其中DMF,N,N-二甲基乙酰胺(DMA),三乙胺,THF,二氯甲烷和甲醇等按常规方法作纯化处理。
1.2 合成
(1)1的合成
在圆底烧瓶中依次加入4,6-二羟基-1,3-苯二甲酸甲酯0.7 g(3.2 mmoL), DMF 30 mL和无水碳酸钾1.8 g,搅拌下于100 ℃反应30 min(反应液呈深红色)。缓慢加入2-(异戊氧基)乙基对甲基苯磺酸酯(TsOR)2.3 g(8 mmoL),于100 ℃反应8 h(TLC监测)。加水200 mL,用二氯甲烷(3×20 mL)萃取,合并有机相,依次用1 mol·L-1盐酸(2×200 mL),饱和碳酸氢钠溶液与饱和食盐水洗涤,用无水Na2SO4干燥,蒸除溶剂后经硅胶柱层析[洗脱剂:V(二氯甲烷) ∶V(甲醇)=100 ∶1]纯化得淡黄色固体4,6-二[2′-(异戊氧基)乙氧基]-1,3-苯二甲酸甲酯11.2 g,产率80%;1H NMRδ: 8.39(s, 1H), 6.57(s, 1H), 4.17(t,J=4.7 Hz, 4H), 3.79(m, 10H), 3.53(t,J=6.8 Hz, 4H), 1.69~1.60(m, 2H), 1.46~1.40(m, 4H), 0.84(d,J=6.6 Hz, 12H)。
(2)2的合成
在圆底烧瓶中依次加入16.7 g(14.8 mmoL),氢氧化钠11.8 g的水(27.6 mL)溶液及甲醇80 mL,搅拌下回流反应4 h(TLC监测,反应液呈深红色)。加水250 mL,用1 mol·L-1盐酸调至pH 2,析出白色固体,抽滤,滤液旋干后用水(200 mL)和二氯甲烷(200 mL)溶解,分液,有机相用饱和食盐水(3×150 mL)洗涤,用无水Na2SO4干燥,蒸除溶剂得淡黄色固体4,6-二[2′-(异戊氧基)乙氧基]-1,3-苯二甲酸(2)5.8 g,产率92%, m.p.148.7 ℃~149.7 ℃;1H NMRδ: 12.37(s, 2H), 8.18(s, 1H), 6.77(s, 1H), 4.27(t,J=4.2 Hz, 4H), 3.73(t,J=4.5 Hz, 4H), 3.51(t,J=6.7 Hz, 4H), 1.66~1.59(m, 2H), 1.42~1.35(m, 4H), 0.85(d,J=6.6 Hz, 12H);13C NMRδ: 165.72, 162.40, 135.86, 112.337, 99.253, 68.972, 68.846, 68.343, 38.089, 24.515, 22.475; ESI-HR-MSm/z: Calcd for C22H34O8Na{[M+Na]+} 449.214 6, found 449.213 6。
(3) 3的合成
在圆底烧瓶中加入2 853.2 mg(2 mmoL)和THF 50 mL,搅拌下慢慢加入草酰氯1.1 mL(1.5 g, 12 mmoL),有气泡冒出,回流反应2 h(TLC监测)。旋干溶剂得淡黄色半固体4,6-二[2′-(异戊氧基)乙氧基]-1,3-苯二甲酰氯(3) 926.8 mg(直接进行下步反应)。
(4) 4的合成
在圆底烧瓶中加入3,5-二硝基苯甲酸1.1 g(5.4 mmoL)和THF 20 mL,搅拌使其溶解;慢慢加入二氯亚砜1.6 mL(2.4 g, 18.6 mmoL), 大量气泡冒出,回流反应2 h(TLC监测)。旋干溶剂得淡黄色半固体3,5-二硝基苯甲酰氯1.2 g(直接进行偶联反应)。
(5) 5的合成(以5a为例)
在圆底烧瓶中依次加入正辛胺(n-C8H17NH2)1.6 g(12.7 mmoL),二氯甲烷100 mL和三乙胺3.9 mL(2.9 g, 28.3 mmoL),冰浴冷却,搅拌下滴加4 3.3 g(14.1 mmoL)的THF(10 mL)溶液,滴毕,反应8 h(TLC监测)。依次用1 mol·L-1盐酸(2×50 mL),饱和碳酸氢钠溶液(2×50 mL)洗涤,用无水Na2SO4干燥,蒸除溶剂后经乙酸乙酯/石油醚重结晶得白色粉末N-辛基-3,5-二氨基苯甲酰胺(5a)。
用类似的方法合成白色粉末N-十二烷基-3,5-二氨基苯甲酰胺(5b)。
5a: 产率85%, m.p.81.0 ℃~82.0 ℃;1H NMRδ: 9.16(t,J=1.86 Hz, 1H), 8.94 (d,J=2.01 Hz, 2H), 6.34(s, 1H), 3.56~3.49(m, 2H), 1.70~1.63(m, 2H), 1.42~1.28(m, 10H), 0.87(d,J=6.78 Hz, 3H);13C NMRδ: 162.71, 148.62, 138.21, 127.16, 120.90, 40.84, 31.74, 30.92, 29.41, 29.20, 29.14, 26.95, 22.59, 14.03; ESI-HR-MSm/z: Calcd for C15H21N3O5Na{[M+Na]+} 346.137 3, found 346.137 1。
5b: 产率80%, m.p.97.7 ℃~98.7 ℃;1H NMRδ: 9.16(s, 1H), 8.94 (d,J=2.00 Hz, 2H), 6.37(s, 1H), 3.56~3.49(m, 2H), 1.70~1.62(m, 2H), 1.26~1.22(m, 18H), 0.87(d,J=6.26 Hz, 3H);13C NMRδ: 162.66, 148.64, 138.23, 127.14, 120.90, 40.83, 31.88, 30.91, 29.59, 29.56, 29.50, 29.42, 29.31, 29.25, 26.95, 22.66, 14.08; ESI-HR-MSm/z: Calcd for C19H29N3O5Na{[M+Na]+} 402.199 9, found 402.199 5。
(6) 7的合成(以7a为例)
在圆底烧瓶中依次加入5a616.0 mg(2 mmoL),二氯甲烷50 mL, 10%Pd-C 193 mg及一滴醋酸,用水泵和氢气球配合置换空气三次,避光条件下于室温反应8 h。过滤,滤液旋干得白色固体6a502.2 mg,粗产率100%(直接投入下步反应)。
在圆底烧瓶中依次加入6a926.8 mg(2 mmoL),三乙胺1.1 mL(7.8 mmoL)及DMA 32 mL,氮气保护,冰浴冷却下加入3 0.9 g(2 mmoL),于室温反应8 h。旋干溶剂后用二氯甲烷(20 mL)溶解,饱和食盐水(2×20 mL)洗涤,用无水Na2SO4干燥,蒸除溶剂得粗品,用二氯甲烷(10 mL)溶解,加入甲醇3 mL,析出固体,过滤,滤饼用二氯甲烷溶解,加入甲醇再次析出固体,如此反复沉淀6次制得淡黄色粉末7a。用类似的方法制得淡黄色粉末7b。
2 结果与讨论
聚合反应在DMA中进行,需加入一定量的三乙胺,在氮气保护、避光条件下室温反应8 h得到黄色粗品,用GPC测定分子量,结果表明,7a和7b粗品的重均分子量(Mw)分别为9 921和29 560;分子量分布(Mw/Mn)分别为2.6和1.8。经适量的二氯甲烷溶解粗品,在溶液中加入甲醇,析出的沉淀再用适量的二氯甲烷溶解,再加入甲醇析出沉淀,如此重复操作多次,可以得到分子量分布较窄、分子量更高的聚合物,达到分段纯化聚合物的目的。其分段纯化后的GPC分析结果见表1。从表1可见,7a的Mw提高至19 343,Mw/Mn提高到1.3; 7b的Mw提升至51 550。这类聚合物折叠可形成大约6个芳香基为一圈的螺旋构象[11],纯化的7a和7b折叠后对应的螺旋环数(turn)分别为9和23。更长的链长、更好的成膜性将有助于系统了解这类聚合物的折叠性质,相关研究正在进行中。从聚合物的IR数据可见,7a和7b的酰胺N-H伸缩振动分别在3 352 cm-1和3 354 cm-1; C-N伸缩振动分别在1 546 cm-1和1 548 cm-1;两种酰胺的C=O伸缩振动分别在1 672 cm-1和1 601 cm-1处有很强的吸收峰,聚合后形成的共轭体系使得C=O伸缩振动吸收明显向低波数移动(表1)。

表 1 聚合物的GPC和IR数据Table 1 Data of GPC and IR for polymers

δ图1 聚合物的1H NMR谱图Figure 1 1H NMR spectra of polymers

Ⅲ
Chart2
聚合物的1H NMR谱图(图1)显示,苯环的4个不同H分别在9.17~9.20, 8.67~8.69, 7.93~7.96和6.54~6.55处出现宽峰,与其结构相似的三聚体(Ⅲ, Chart 2)[11]分别在对应的8.79, 8.50, 7.92和6.54处出峰,与其相比聚合物的苯环H均发生了一定的位移,最大化学位移Δδ=0.4。
IR和1H NMR的分析进一步说明,通过上述缩合反应得到了酰胺聚合物7。
3 结论
设计了3,5-二胺基苯甲酰胺和4,6-二烷氧基-1,3-苯二甲酰氯两种单体。通过一锅煮的方法合成了一类新型的长链芳香酰胺聚合物衍生物。该类化合物具有很好的成膜性能,其骨架具有一定的刚性,有望折叠成螺旋管道,在离子通道、离子膜等方面具有潜在的应用价值。
[1] Appella D H, Christianson L A, Gellman S H,etal.β-Peptide foldamers:Robust helix formation in a new family ofβ-amino acid oligomers[J].J Am Chem Soc,1996,118:13071-13072.
[2] Gellman S H, Foldamers. A manifesto[J].Acc Chem Res,1998,31:173-179.
[3] Hill D J, Mio M J, Moore J S,etal. A field guide to foldamers[J].Chem Rev,2001,101:3893-3895.
[4] Gong B. Crescent oligoamides:From acyclic “macrocycles” to folding nanotubes[J].Chem Eur J,2001,7:4336-4342.
[5] Huc I. Aromatic oligoamide foldamers[J].Eur J Org Chem,2004,17(1):17-29.
[6] Guichard G, Huc I. Synthetic foldamers[J].Chem Commun,2011,47:5933-5941.
[7] Gong B, Zeng H, Zhu J,etal. Creating nanocavities of tunable sizes:Hollow helices[J].Proceedings of the National Academy of Sciences,2002,99:11583-11588.
[8] Zhu J, Parra R D, Gong B,etal. A new class of folding oligomers:Crescent oligoamides[J].J Am Chem Soc,2000,122:4219-4220.
[9] Zhang A, Ferguson J S, Gong B. Improving foldamer synthesis through protecting group induced unfolding of aromatic oligoamides[J].Org Lett,2006,8:5117-5120.
[10] Yuan L, Sanford A R, Gong B,etal. Synthesis of crescent aromatic oligoamides[J].J Org Chem,2005,70:10660-10669.
[11] Cao J X, Zhu J, Gong B,etal. Preparation and helical folding of long-chain aromatic polyamides[J].Chem Commun,2012,48:11112-11114.

