比伐卢定的聚乙二醇化修饰*
何 燕, 邓言波, 王良友
(1. 苏州大学 医学部 放射医学与防护学院,江苏 苏州 215123; 2. 苏州中科天马肽工程中心有限公司,江苏 苏州 215101)
比伐卢定(BVLD)是由20个氨基酸(D-Phe-Pro-Arg-Pro-Gly-Gly-Gly-Gly-Asn-Gly-Asp-Phe-Glu-Glu-Ile-Pro-Glu-Glu-Tyr-Leu)组成的水蛭素的衍生物,是凝血酶的直接可逆的二价抑制剂[1],可以与凝血酶的催化位点和阴离子结合位点(底物识别位点)结合[2]。BVLD于2000年12月15日被美国FDA批准上市。
BVLD是一种合成的多肽药物,单次剂量为250 mg,价格昂贵。其在肾功能正常的患者体内的清除半衰期为25 min,虽然比伐卢定于2000年被批准用于经皮冠状动脉腔内血管成形术的抗凝治疗,在2005年被批准用于接受经皮冠状动脉介入治疗的抗凝治疗[3],但是昂贵的价格限制了其在临床上的应用。因此,开发长效、安全、经济的类似药物十分必要。蛋白质经聚乙二醇化修饰(PEGylation)后能显著改善其特性,如增加蛋白质对酶的稳定性、延长蛋白质在血浆中的半衰期、降低抗原性和免疫原性等[4],已有多个PEG修饰的蛋白药物上市[5]。
本文将BVLD多肽链7-甘氨酸(Gly)用半胱氨酸(Cys)取代,以PEG定点修饰巯基,采用多肽固相合成法制得[Cys]7-BVLD(2); 2与mPEG-MAL(3a~3c)偶联合成了三个PEG修饰的BVLD衍生物——[Cys(mPEG2000-MAL)]7-BVLD(1a), [Cys(mPEG5000-MAL)]7-BVLD(1b)和[Cys(mPEG10000-MAL)]7-BVLD(1c),其结构经MS确证。PT和TT评价结果表明,1a~1c均表现出良好的抗凝活性,尤其是1b的抗凝活性优于BVLD。
1 实验部分
1.1 仪器与试剂
创新通恒半制备高效液相色谱仪[Phenomenex C18柱,250 mm×30 mm(100 Å,10 μ),流动相A: 0.05%TFA水溶液,B: 0.05%TFA(三氟乙酸)/70%CH3CN/H2O,流速20 mL·min-1,检测波长215 nm];戴安U3000型高效液相色谱仪[HPLC, Prosphere C18柱,250 mm×4.6 mm(100 Å, 5 μ),流动相同前,流速1 mL·min-1]; Bruker MTQ型质谱仪。
固相合成载体CTC树脂(原始替代度为1.3 mmol·g-1), DCC(N,N′-二环己基碳二亚胺), HOBt(1-羟基苯并三氮唑)以及10 种Fmoc-保护氨基酸,上海吉尔生化公司;TFA, Acros; EDT(乙二硫醇)和TMBS(三甲基溴硅烷), Fluka;聚乙二醇的平均分子量为mPEG2000-OH, mPEG5000-OH和mPEG10000-OH, Sigma;其余所用试剂为分析纯。
1.2 合成
(1) mPEG-MAL(3a~3c)的合成通法
在反应瓶中依次加入mPEG-OH 1 mmol的CH2Cl2(5 mL)溶液,Et3N 6 mmol和对甲苯磺酰氯6 mmol,搅拌下于室温反应20 h(TLC监测)。于40 ℃减压旋蒸除去溶剂,加预冷无水乙醚沉降,过滤,滤饼用二氯甲烷溶解,依次用0.1%柠檬酸钠溶液(3×10 mL),饱和NaCl溶液(3×足量)洗涤,无水Na2SO4干燥12 h,于40 ℃减压旋蒸除去溶剂,乙醚沉降,抽滤,滤饼干燥得白色粉末mPEG-OTs(Ⅰa~Ⅰc)。
在反应瓶中依次加入Ⅰa~Ⅰc1 mmol的DMF(10 mL)溶液,邻苯二甲酰亚胺盐(PPI) 6 mmol, N2保护下于120 ℃反应4 h。于90 ℃减压旋蒸除去溶剂,依次加入无水乙醇与水合肼, 回流反应2 h。于60 ℃减压旋蒸除去溶剂,残余物用二氯甲烷溶解,过滤,滤液依次用水(3×10 mL),饱和NaCl溶液(3×足量)洗涤,无水Na2SO4干燥12 h,于40 ℃减压旋蒸除去溶剂,乙醚沉降,抽滤,滤饼干燥得白色粉末mPEG-NH2(Ⅱa~Ⅱc)。
在反应瓶中加入Ⅱa~Ⅱc1 mmol的二氧六环(40 mL)溶液,搅拌下于80 ℃加马来酸酐4 mmol,反应30 min。于55 ℃减压旋蒸除去溶剂,乙醚沉降,抽滤,滤饼用醋酸酐溶解,加入无水醋酸钠,搅拌下于100 ℃反应45 min(反应液由淡黄色逐渐变为褐色液体)。加水(10倍体积),分液,水层用CH2Cl2(3×10 mL)萃取,合成并有机层,用饱和NaCl溶液(3×足量)洗涤,无水Na2SO4干燥12 h,于40 ℃减压旋蒸除去溶剂,乙醚沉降,抽滤,滤饼干燥得淡黄固体3a~3c。
Ⅰa~3c的产量及产率见表1。
(2) [Cys]7-BVLD(2)的制备
CTC树脂15.00 g, HOBt和HBTu为缩合剂,按照反应的投料比,称取相应量的Fmoc-Leu-OH, Fmoc-Tyr(tBu)-OH, Fmoc-Glu(OtBu)-OH, Fmoc-Pro-OH, Fmoc-Ile-OH, Fmoc-Phe-OH, Fmoc-Asp(OtBu)-OH, Fmoc-Gly-OH, Fmoc-Asn(Trt)-OH, Fmoc-Cys(Trt)-OH, Fmoc-D-Phe-OH和Fmoc-Arg(Pbf)-OH,根据[Cys]7-BVLD的氨基酸顺序,按标准的Fmoc固相多肽合成方法(图1)合成 D-Phe-Pro-Arg(Pbf)-Pro-Gly-Gly-Cys7(Trt)-Gly-Asn(Trt)-Gly-Asp(OtBu)-Phe-Glu(OtBu)-Glu(OtBu)-Ile-Pro-Glu(OtBu)-Glu(OtBu)-Tyr(tBu)-Leu-CTC(2-CTC)。按照8 mL·g-1树脂用量配制并加入裂解液,以混合溶剂[V(TFA) ∶V(苯甲硫醚) ∶V(EDT) ∶V(苯甲醚)=90 ∶5 ∶3 ∶2]为裂解液,于0 ℃反应90 min。过滤,滤液旋转蒸发除去TFA,加冷冻无水乙醚(6倍体积)沉淀出白色固体,3 000 rpm离心5 min,滤集固体用水溶解,冰冻干燥至恒重得白色干粉2粗品62 mg。

表 1 Ⅰa~3c的产量及产率Table 1 Output and yield of Ⅰa~3c
图1Fmoc固相多肽合成2-CTC的流程图
Figure1The flow chart of the Fmoc solid phase peptide synthesis of 2-CTC
*V(六氢吡啶) ∶V(DMF)=1 ∶3
2粗品经HPLC纯化得2,纯度大于95%(HPLC),其结构经MS和氨基酸组成分析确证。由MS分析可知,在1 112.2处有主峰,与理论分子量2 223.99分子带两个电荷一致。2经酸性水解(6 mol·L-1盐酸水溶液,于110 ℃反应22 h,下同)的氨基酸组成实测值与理论值(括号内)相符:Asp 1.99(2), Glu 4.11(4), Pro 3.09(3), Arg 0.96(1), Gly 4.21(4), Tyr 1.07(1), Phe 1.92(2), Ile 0.99(1), Leu 0.98(1)。
(3)1a~1c的合成通法
在反应瓶中加入2的水(10 mL)溶液,用5%碳酸氢钠溶液调至pH 7~8,加入3a~3c,于室温反应至终点(HPLC监测)。HPLC分离提纯得1a~1c,纯度大于95%, MALDI-TOF-MS分析结果表明,在4 232附近有一系列峰,相邻两峰分子量相差约44,具有聚乙二醇的典型结构特征。经酸性水解的氨基酸组成实测值与理论值(括号内)相符。1a: Asp 1.99(2), Glu 4.11(4), Pro 3.09(3), Arg 0.96(1), Gly 4.21(4), Tyr 1.07(1), Phe 1.92(2), Ile 0.99(1), Leu 0.98(1)。1b: Asp 2.00(2), Glu 4.31(4), Pro 3.18(3), Arg 1.03(1), Gly 4.13(4), Tyr 1.02(1), Phe 1.82(2), Ile 1.06(1), Leu 1.03(1)。1c: Asp 1.95(2), Glu 4.06(4), Pro 2.92(3), Arg 0.96(1), Gly 4.21(4), Tyr 1.06(1), Phe 1.92(2), Ile 1.01(1), Leu 0.97(1)。
1.3 1的抗凝活性评价
(1)1的凝血酶原时间(PT)测定
将PT试剂和受检血浆置37 ℃水浴中预温5 min。取试管1支,加入受检血浆0.1 mL,一定量的比伐卢定或1(用pH 7.4的Tris-HCl缓冲液配制成所需终浓度),置37 ℃水浴中预温30 s,再加入预温的PT试剂0.2 mL,混匀,立即启动秒表计时。不断地倾斜试管至液体流动缓慢趋于停止时,记录所需时间。重复三次,取平均值,空白对照为Tris-HCl缓冲液,测试结果见表2。
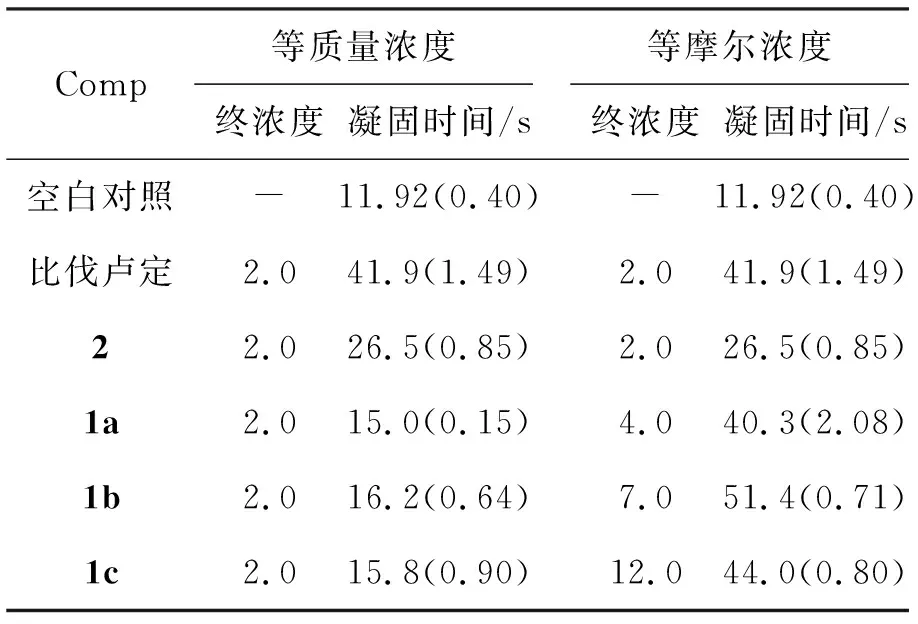
表 2 1的PT评价数据*Table 2 PT evaluation data of 1
*终浓度/μg·mL-1, 凝固时间栏括号内为标准差
由表2可见,1a~1c不仅在等质量浓度测定条件下仍保留了一定的抗凝活性;而且在等摩尔浓度下也保持了良好的抗凝活性,其中1b的抗凝活性优于比伐卢定。
(2)1的凝血酶时间(TT)测定
取受检血浆0.1 mL于试管中,加入一定量的比伐卢定或1(用pH 7.4的Tris-HCl缓冲液配制成所需终浓度),置37 ℃水浴中,预温5 min,再加入0.1 mL标准化“凝血酶”试剂,同时启动秒表记录血浆凝固时间。重复三次,取平均值,测试结果见表3。从表3可以看出,1a~1c均具有较好的抗凝活性(正常对照平均值18.0 s)。
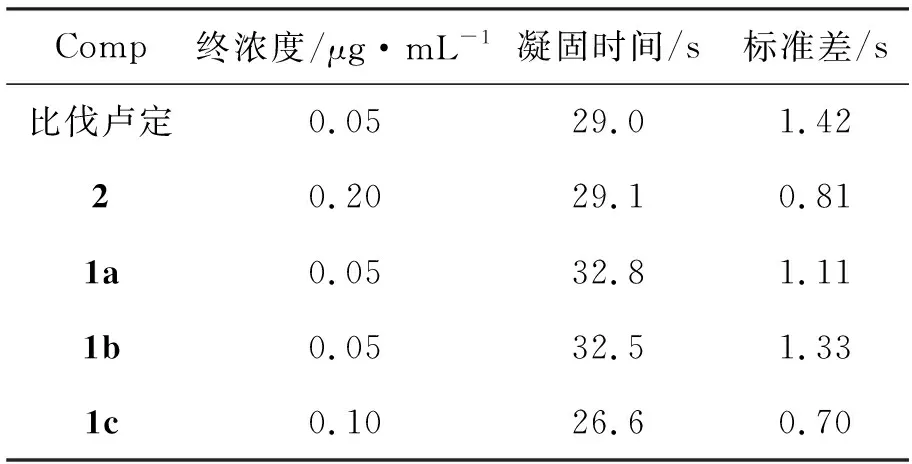
表 3 1的TT评价数据Table 3 TT evaluation data of 1
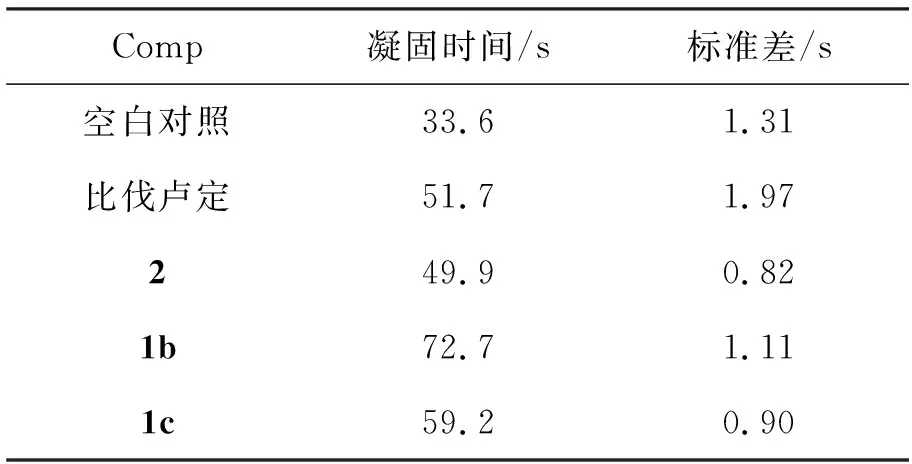
表 4 1的APTT评价数据(等质量浓度)*Table 4 APTT evaluation data of 1
*终浓度0.04 μg·mL-1
(3) 1的活化部分凝血酶时间(APTT)测定
取APTT反应液0.1 mL和受检血浆0.1 mL于塑料离心管中,并加入5 μL的比伐卢定或1(用pH 7.4的Tris-HCl缓冲液配制成终浓度0.04 μg·mL-1的溶液),置 37 ℃水浴中预温3 min。再加入预温的APTT催化剂0.1 mL,混匀,立即启动秒表计时。不断地倾斜试管至有絮状沉淀生成时,记录所需时间。重复三次,取平均值,测试结果见表4。由表4可见,1a~1c仍保持了良好的抗凝活性,其中,1b的抗凝活性最佳。
2 结果与讨论
比伐卢定的构效关系研究表明,其氨基端带正电荷区域(D-Phe-Pro-Arg-Pro)和羧基端带负电荷区域(Asn-Gly-Asp-Phe-Glu-Glu-Ile-Pro-Glu-Glu-Tyr-Leu)是其与凝血酶结合的两个关键区域,而5-位至8-位的4个Gly只起连接作用,因此选择7-位或8-位的甘氨酸进行聚乙二醇修饰是理想的位点。初步活性评价表明,本研究合成的三种不同平均分子量的1a~1c能保持较好的体内抗凝活性,在相同摩尔浓度下,1b的抗凝活性优于比伐卢定,有望进一步开发成具有比比伐卢定更长半衰期的抗凝药物。
[1] Reed M D, Bell D. Clinical pharmacology of bivalirudin[J].Pharmacotherapy,2002,22:105S-11S.
[2] Maraganore J M, Bourdon P, Jablonski J,etal. Design and characterization of hirulogs:A novel class of bivalent peptide inhibitors of thrombin[J].Biochemist ry,1990,29(30):7095.
[3] Rassen J A. Safety and effectiveness of bivalirudin in routine care of patients undergoing percutaneous coronary intervention[J].European Heart Journal,2010,31:561-572.
[4] 王良友,刘克良 . 多肽和蛋白质的聚乙二醇化修饰方法[J].有机化学,2003,23(11):1320-1323.
[5] Ryan S M, Mantovani G, Wang X,etal. Advances in PEGylation of important biotech molecules:Delivery aspects[J].Expert Opinion Drug Delivery,2008,5(4):3712383.
——非均布滤饼的局部比阻与平均比阻的测定与计算方法

