饥饿诱导增生性瘢痕成纤维细胞自噬发生*
吕 雷, 林 康, 高伟阳, 何智灵, 高自勉, 李浙峰, 李俊杰
增生性瘢痕(hypertrophic scar,HS)是病理性瘢痕的一种,是以成纤维细胞增殖失控、胶原过度沉积为主要特征的结缔组织疾病,其发病机制至今仍不清楚。自噬是广泛存在于真核细胞中的生命现象,在多种退变性疾病的病理过程中亦起着极为重要的作用。目前研究表明自噬与心肌[1]、肾脏[2]等器官纤维化密切相关,其在增生性瘢痕的形成过程中是否起作用,目前尚不清楚。本研究应用饥饿诱导方法来观察增生性瘢痕中成纤维细胞自噬现象及自噬水平,以探讨自噬在增生性瘢痕中的作用和意义。
材料和方法
1 材料
DMEM培养基(Gibco),胎牛血清(四季青),EBSS(Gibco),单丹磺酰戊二胺(monodansylcadaverine,MDC)荧光染料(Gibco),RIPA细胞裂解液、SDSPAGE凝胶配制试剂盒(上海碧云天公司),BCA蛋白浓度测定试剂盒及ECL发光液(Thermo),微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)、自噬相关蛋白Beclin-1及GAPDH兔抗人多克隆抗体(CST);羊抗兔辣根过氧化物酶IgG(北京康为世纪公司),Trizol(Invitrogen),RT-PCR试剂盒(Thermo),SYBR Green I Master(Roche)。
2 成纤维细胞培养
增生性瘢痕标本来源于手术切除的增生性瘢痕组织,色泽红,质硬,高出皮肤表面,瘢痕形成不超过1年,取材部位无感染和溃疡,且未经任何治疗,不伴有肿瘤或其它结缔组织疾病。采用组织块培养法进行原代培养,在无菌条件下切除瘢痕表皮及皮下组织,在少量胎牛血清中将标本切成1 mm×1 mm×1 mm左右的组织块置于25 cm2培养瓶中,2 h后翻转培养瓶,加入含10%胎牛血清的DMEM培养基。当原代细胞生长成单层,用0.25% 胰蛋白酶消化,按1∶2的比例传代培养,实验用第3~6代细胞。
3 实验分组
选择生长状态良好3~6代的成纤维细胞,接种于6孔细胞培养板,含10%胎牛血清的DMEM培养基培养24 h。细胞分为4组,用EBSS平衡盐溶液饥饿细胞 1 h、2 h、3 h,对照组用 10% 胎牛血清的DMEM培养液。处理组和对照组均重复3次以上。
4 Western blotting检测LC3和Beclin-1蛋白表达
在6孔板中将各组细胞用预冷PBS洗2遍后,加入适量的细胞裂解液(radio immunoprepciption assay buffer,RIPA)和蛋白酶抑制剂(phenylmethanesulfonyl fluoride,PMSF),超声裂解提取蛋白。BCA法测定蛋白浓度,12%SDS-PAGE电泳,将LC3目的蛋白转至0.22 μm PVDF膜上,Beclin-1和内参照转至0.45 μm 的膜上,5% 脱脂牛奶常温下封闭,孵LC3抗体(1∶1 000)、Beclin-1 抗体(1∶1 000)及GAPDH抗体(1∶1 000)4℃过夜,孵育辣根过氧化物酶标记的Ⅱ抗(1∶3 000),ECL发光液显色。
5 实时荧光定量RT-PCR检测LC3和Beclin-1 mRNA表达
以Trizol法提取上述方法刺激后获取的细胞总RNA,并用紫外分光光度计检测RNA浓度及纯度(A260/A280>1.8)。根据浓度取1 μg总 RNA 按照逆转录试剂盒操作说明将RNA逆转录为cDNA,进行PCR扩增。LC3上游引物5’-CAACATGAGCGAGTTGGTCAAGA-3’,下游引物 5’-ACTCACCATGCTGTGCTGGTTC-3’;Beclin-1 上游引物 5’-ATGCAGGTGAGCTTCGTGTG-3’,下 游 引 物 5’-CTGGGCTGTGCTAAGTAATGGA-3’;GAPDH 上游引物 5’-AACGGATTTGGTCGTATTGGG-3’,下游引物 5’-TCGCTCCTGGAAGATGGTGAT-3’。以上引物由上海基康生物技术有限公司合成。在无菌去酶的Eppendorf管中按照说明书将配置好的real-time PCR反应液(反应总体积为20 μL)离心数秒,混匀后迅速置入Roche LightCycler®480实时荧光定量PCR仪中,两步法qRT-PCR扩增程序:预变性95℃ 5 min,95℃10 s,60 ℃ 10 s,72 ℃ 10 s,45 个循环,获得各样本待测基因的 Ct值。采用2-ΔΔCt法进行试验数据处理,其结果代表各目的基因表达的相对定量,以对照组作为矫正样本。
6 MDC荧光染色
按Biederbick等[3]实验方法,将细胞处理完后,去培养基,PBS洗2次,用0.05 mmol/L MDC于37℃温育50 min后,吸去染料,PBS洗2次,4%多聚甲醛固定15 min,PBS洗2次,晾干后立刻用荧光显微镜在400倍视野下观察,激发滤片为365 nm,阻断滤片为430 nm。
7 透射电镜扫描
各组取1瓶细胞,处理后并离心成团,在EP管中加入2%戊二醛4℃固定过夜,PBS漂洗,1%锇酸固定,1%醋酸铀块染,梯度丙酮脱水,包埋液包埋、固化,半薄切片及甲苯胺蓝染色进行定位,LKB-V超薄切片机超薄切片,透射电镜下观察成纤维细胞。
8 统计学处理
数据以均数±标准差(mean±SD)表示,统计学采用组间单因素方差分析及LSD法进行两两比较,统计软件采用 SPSS 13.0软件处理,以P<0.05为差异有统计学意义。
结 果
1 Western blotting检测 LC3和Beclin-1的蛋白表达
饥饿处理 1 h后 LC3-II/LC3-Ⅰ和 Beclin-1/GAPDH增高,2 h达到高峰,3 h逐渐下降,与对照组相比差异有统计学意义(P<0.05);Beclin-1在饥饿处理1 h后表达增高,2 h达到高峰后逐渐下降,与对照组相比差异有统计学意义(P<0.05),见图1。
2 荧光定量RT-PCR检测LC3和Beclin-1的mRNA表达
LC3 mRNA表达在饥饿处理1 h后即有增高,2 h达到高峰,3 h下降,与对照组相比差异有统计学意义(P<0.05);Beclin-1 mRNA在饥饿处理1 h后表达增高,2 h达到高峰,3 h逐渐下降,与对照组相比差异有统计学意义(P<0.05),见图2。
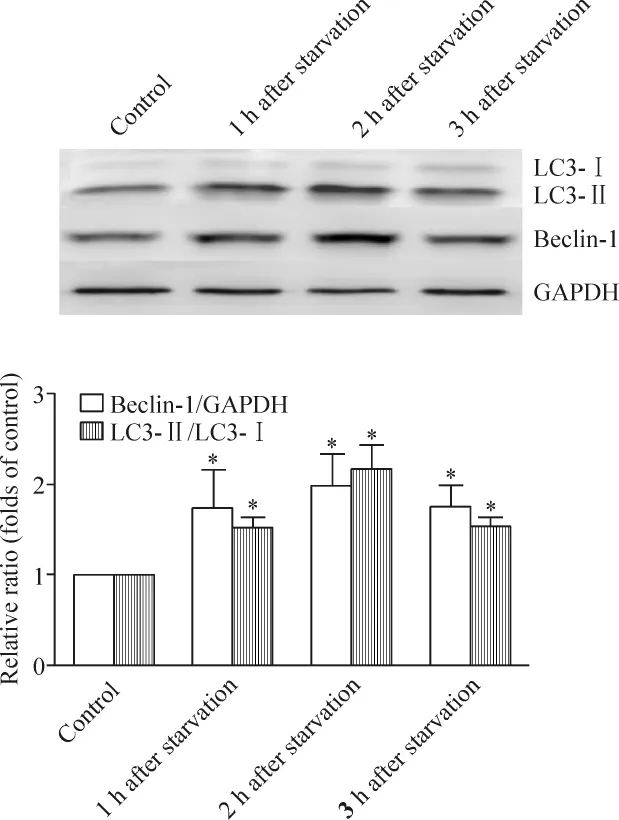
Figure 1.Western blotting analysis of protein expression of LC3 and beclin 1.Mean ± SD.n=3.*P <0.05 vs control.图1 各组细胞LC3和Beclin-1蛋白的表达
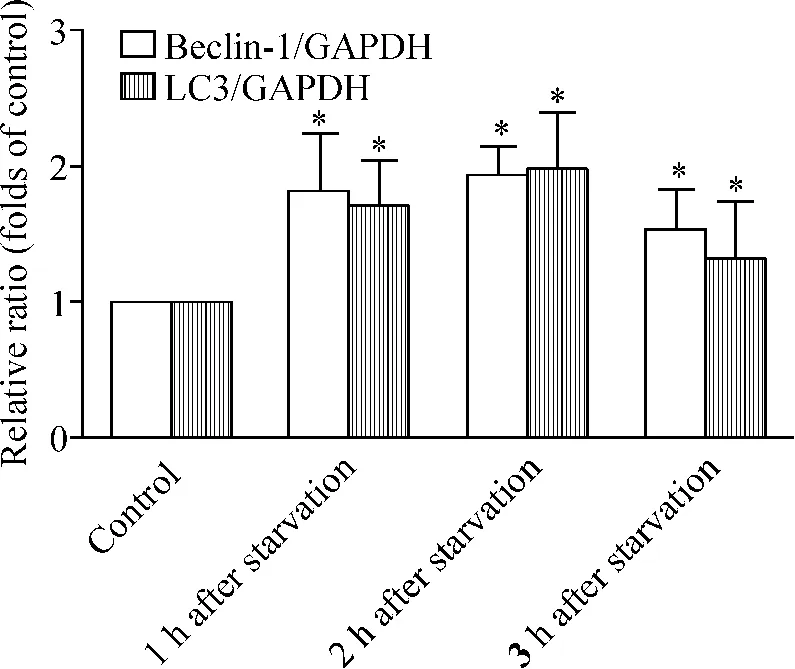
Figure 2.LC3 and Beclin-1 mRNA expression assessed by realtime fluorescence quantitative RT-PCR.Mean±SD.n=3.*P < 0.05 vs control.图2 各组细胞LC3和Beclin-1 mRNA的表达
3 MDC荧光染色观察
MDC荧光染料作为自噬泡的示踪剂,在荧光显微镜下呈蓝绿色点状结构,多分布于核周。对照组细胞中可见少量的点状结构;饥饿处理2 h后,MDC阳性细胞数明显增加,蓝绿色点状密度也明显升高,见图3。
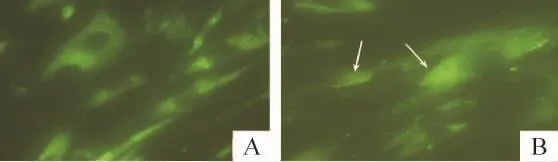
Figure 3.MDC staining of the autophagic vacuoles in hypertrophic scar fibroblasts(×400).A:control;B:2 h after starvation.图3 增生性瘢痕成纤维细胞MDC荧光染色
4 透射电镜观察
透射电镜下可见,对照组细胞核较大,核仁明显,胞浆内清晰可见线粒体、内质网。饥饿处理2 h后细胞胞浆内可见大量囊泡状结构,在高倍镜下可见双层膜结构,包含着未消化的胞浆成分或细胞器,见图4。
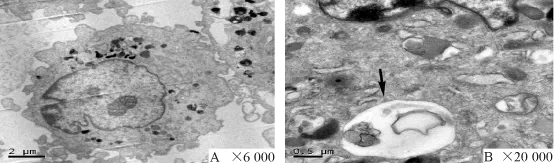
Figure 4.Electron micrographs of hypertrophic scar fibroblasts.A:control;B:2 h after starvation.图4 电镜观察增生性瘢痕成纤维细胞
讨 论
自噬广泛存在于真核细胞中,是一个细胞内物质通过溶酶体被降解的过程,生命体借此保持正常的生长发育、细胞分化及代谢平衡,以维持细胞内环境的稳定[4]。当自噬功能被抑制或干扰时,细胞的降解功能会出现障碍,并导致多种疾病的发生,如肿瘤、神经退行性疾病等[5-7]。近年来研究发现自噬在心肌、肾脏等器官纤维化发生发展过程中发挥重要的作用。Tannous等[1]发现自噬不足促进心肌间质纤维化。Kim等[2]研究表明自噬与肾纤维化有关,诱导自噬能明显降低胶原I的蛋白表达。在皮肤中也发现增生性瘢痕组织自噬表达水平较正常皮肤组织明显降低,提示增生性瘢痕的发生可能与自噬不足有关[8]。然而,能否在体外细胞水平诱导增生性瘢痕成纤维细胞发生自噬,成为进一步研究自噬与增生性瘢痕形成关系的关键。
饥饿法是目前诱导细胞自噬的一种经典方法,在哺乳动物细胞的自噬研究中应用广泛[9-10]。本实验设计采用EBSS代替培养液,为增生性瘢痕成纤维营造饥饿环境,然后检测自噬相关指标,研究营养缺乏对增生性瘢痕成纤维细胞自噬的影响。
LC3是酵母菌自噬相关蛋白Atg8在哺乳动物中的同源体,调控微管蛋白的组装和去组装,参与自噬体的形成。LC3具有2种形式:LC3-Ⅰ和 LC3-Ⅱ。LC3-Ⅱ定位于前自噬泡和自噬泡膜表面,常作为自噬的特异性标志物。Beclin-1是酵母Atg6/Vps30在哺乳动物中的同源体,表达于反面高尔基网状结构,与Ⅲ型PI3K和Atg14L结合形成复合体,调控自噬前体产生和自噬体形成[11]。我们应用Western blotting及荧光定量RT-PCR检测LC3-Ⅱ和Beclin-1蛋白和mRNA的表达,随饥饿时间延长而升高,2 h达到高峰,较对照组明显升高,表明饥饿可诱导成纤维细胞自噬的发生。通过MDC荧光染色观察,饥饿处理2 h,MDC阳性细胞数较对照组明显增加;电镜是证明自噬现象的金标准,我们在电镜下观察到饥饿处理2 h细胞内存在自噬体,进一步证实饥饿可诱导成纤维细胞自噬的发生。
增生性瘢痕发病机制复杂,自噬在其中的作用及机制尚不清楚,可能与细胞凋亡[12]、胶原降解[13]等有关。本实验在体外成功应用饥饿诱导出增生性瘢痕成纤维细胞的自噬,为进一步在细胞及分子水平研究自噬与增生性瘢痕形成的关系提供一定的基础,从而为将来防治增生性瘢痕提供理论依据和新的治疗靶点。
[1] Tannous P,Zhu H,Johnstone JL,et al.Autophagy is an adaptive response in desmin-related cardiomyopathy[J].Proc Natl Acad Sci U S A,2008,105(28):9745-9750.
[2] Kim SI,Na HJ,Ding Y,et al.Autophagy promotes intracellular degradation of type I collagen induced by transforming growth factor(TGF)-β1[J].J Biol Chem,2012,287(15):11677-11688.
[3] Biederbick A,Kern HF,Elsässer HP.Monodansylcadverine(MDC)is a specific in vivo marker for autophagic vacuoles[J].Eur J Cell Biol,1995,66(1):3-14.
[4] Levine B,Kroemer G.Autophagy in the pathogenesis of disease[J].Cell,2008,132(1):27-42.
[5] Jin S,White E.Tumor suppression by autophagy through the management of metabolic stress[J].Autophagy,2008,4(5):563-566.
[6] Winslow AR,Rubinsztein DC.Autophagy in neurodegeneration and development[J].Biochim Biophys Acta,2008,1782(12):723-729.
[7] 胡鹏飞,赖东武,何 红.自噬在晚期糖基化终产物诱导的内皮细胞凋亡中的作用[J].中国病理生理杂志,2012,28(6):1006-1011.
[8] Shi JH,Hu DH,Zhang ZF,et al.Reduced expression of microtubule-associated protein 1 light chain 3 in hypertrophic scars[J].Arch Dermatol Res,2012,304(3):209-215.
[9] Kroemer G,Marino G,Levine B.Autophagy and the integrated stress response[J].Mol Cell,2010,40(2):280-293.
[10] 江立波,张小磊,徐华梓,等.细胞自噬对饥饿环境下椎间盘髓核细胞的保护作用[J].中国病理生理杂志,2012,28(7):1302-1307.
[11] Kihara A,Kabeya Y,Ohsumi Y,et al.Beclin-phosphatidylinositol 3-kinase complex functions at the trans-Golgi network[J].EMBO Rep,2001,2(4):330-335.
[12] Gordy C,He YW.The crosstalk between autophagy and apoptosis:where does this lead?[J].Protein Cell,2012,3(1):17-27.
[13] Ishida Y,Yamamoto A,Kitamura A,et al.Autophagic elimination of misfolded procollagen aggregates in the endoplasmic reticulum as a means of cell protection[J].Mol Biol Cell,2009,20(11):2744-2754.

