黄斑蓝子鱼皮肤黏液对刺激隐核虫及一些病原菌的抑杀作用
黎睿君 刘 芳 王方华, 李安兴
(1. 中山大学有害生物控制与资源利用国家重点实验室, 水产品安全教育部重点实验室, 广州 510275;2. 华南理工大学轻工与食品学院, 广州 510640)
黄斑蓝子鱼(Siganus oramin)属于鲈形目(pereiformes)、蓝子鱼科(Siganidae), 是近海暖水性小型鱼类。它适宜生长的水温和盐度范围较广, 是南海区域普遍养殖的鱼类之一。前期研究发现, 黄斑蓝子鱼对刺激隐核虫(Cryptocaryon irritans)感染具有明显抵抗力, 其血清中存在一种新奇的抗寄生虫蛋白(APP), 该蛋白对刺激隐核虫幼虫和滋养体具有强烈的杀灭作用[1]。鱼类的黏膜是抵御寄生虫感染的第一道重要屏障, 已知鱼类的黏液中含有诸多抑杀病原的活性物质[2,3], 且鱼类表皮黏液的免疫学功能证实[4,5]。黄斑蓝子鱼体表黏液是否对刺激隐核虫同样具有杀灭活性是本研究的出发点。前期研究发现APP在体外对多子小瓜虫(Ichthyophthirius multifiliis)和布氏锥虫(Trypanosoma brucei brucei)同样具有较强的杀灭作用, 对金黄色葡萄球菌(Staphylococcus aureus)、枯草芽孢杆菌(Bacillus subtilis)和海豚链球菌(Streptococcus iniae)等 3种革兰氏阳性菌以及大肠杆菌(Escherichia coli)、霍乱弧菌(Vibrio cholerae)、温和气单胞菌(Aeromonas sobria)、迟钝爱德华氏菌(Edwardsiella tarda)、溶藻弧菌(Vibrio alginolyticus)和美人鱼发光杆菌杀鱼亚种(Photobacterium damselae subsp.)等6种革兰氏阴性菌均有抑菌效果, 但对于黑曲霉(Aspergillus niger)和小麦赤霉菌(Gibberella saubinetii)两种真菌则无抑菌作用[6]。因此, 在研究黄斑蓝子鱼皮肤黏液是否对刺激隐核虫同样具有杀灭活性的同时, 开展了黏液对上述病原杀灭活性的验证, 同时选取了南海区较为常见的四种海水经济鱼类, 即斜带石斑鱼(Epinephelus coioides)、美国红鱼(Sciaemops ocellatus)、花尾胡椒鲷(Plectorhinchus cinctus)、 卵形 鲳 鲹(Trachinotus ovatus)的皮肤黏液作为对照。探究黄斑蓝子鱼皮肤黏液抗刺激隐核虫活性, 以及研究该黏液对APP相关抑杀病原的作用, 为进一步研究黄斑蓝子鱼对刺激隐核虫的天然抗性提供了基础, 为深入开展 APP蛋白的研究提供了新的路径。
1 材料与方法
1.1 实验用鱼
1.2 实验虫株
刺激隐核虫(C. irritans)GD1株由本实验室保存,多子小瓜虫(I. multifiliis)由中国水产科学院珠江水产研究所赵飞博士提供, 布氏锥虫(T. brucei brucei)由中山大学华南寄生生物研究中心伦照荣教授提供。
1.3 实验菌株
金黄色葡萄球菌(S. aureus)ATCC25923 株、大肠杆菌(E. coli)、温和气单胞菌(A. sobria)、霍乱弧菌(V. cholerae)、副溶血弧菌(Vibrio Parahaemolyticus)、溶藻弧菌(V. alginolyticus)、海豚链球菌(S.iniae)、星形诺卡氏菌(Nocadia asteroides)、美人鱼发光杆菌杀鱼亚种(P. damselae subsp.)、小麦赤霉菌(G. saubinetii)、黑曲霉菌(A. niger)均为本实验室保存。
1.4 黏液样品的制备
用玻片轻轻刮取实验鱼背部黏液, 溶于 PBS(pH 7.4), 4000 r/min, 4℃离心20min, 取上清液, 冷冻干燥后−20℃保存。实验时, 取冻干的样品重溶于PBS, BCA法测定黏液样品蛋白浓度。
1.5 对刺激隐核虫、多子小瓜虫和布氏锥虫的杀灭作用试验
参照但学明等阻动实验方法[7], 在96孔培养板中, 每孔分别加入100 μL含有刺激隐核虫幼虫(200个/100 μL)或刺激隐核虫滋养体(200 个/100 μL)的虫液, 同时向每孔中加入 20 μL(5.0 mg/mL)黄斑蓝子鱼黏液, 轻轻混匀, 1h后统计各孔中寄生虫的死亡率, 以显微镜下观察虫体纤毛或鞭毛不摆动为死亡判定依据。同时从各孔取少量处理后的虫液于载玻片上, 用于显微镜观察。以斜带石斑鱼、美国红鱼、卵形鲳 鲹和花尾胡椒鲷的黏液作为对比组, 灭菌海水作为空白对照组。黏液对多子小瓜虫幼虫及布氏锥虫的处理方法同上。
1.6 黄斑蓝子鱼黏液最低杀虫浓度的测定
将黄斑蓝子鱼皮肤黏液用 PBS(pH 7.4)稀释到5.0、4.0、3.0、2.0、1.0和0.5 mg/mL, 其余处理方法同上, PBS作为空白对照, 1h 后统计各寄生虫死亡率。
1.7 对细菌的抑制作用试验
抑菌活性试验 参照Nagashima, et al.[8]方法,金黄色葡萄球菌和大肠杆菌在 37℃下培养, 温和气单胞菌、霍乱弧菌、副溶血弧菌、溶藻弧菌、海豚链球菌、星形诺卡氏菌、美人鱼发光杆菌杀鱼亚种在28℃下培养, 18—48h后观察抑菌圈的大小, 试验所用皮肤黏液均用PBS(pH 7.4)稀释到5.0 mg/mL。
最小抑菌浓度的测定 将处于对数生长期的金黄色葡萄球菌、霍乱弧菌、海豚链球菌、溶藻弧菌、温和气单胞菌和副溶血弧菌分别稀释至 105CFU/mL, 向96孔板中加入50 μL菌液。将黄斑蓝子鱼黏液用 PBS(pH 7.4)稀释至 5.0、2.5、1.25、0.63、0.32、0.16、0.08、0.04 mg/mL, 每孔加入 100 μL 黏液溶液, 放置各细菌于对应培养温度的生化培养箱静置培养, 24h时测其A600值, 具有显著性抑菌效果的最低黏液蛋白浓度为其最小抑菌浓度。
1.8 对真菌抑制作用试验
接种小麦赤霉菌和黑曲霉菌于斜面 PDA固体培养基, 30℃培养 48h, 去离子水冲洗, 收集孢子,将孢子浓度稀释至104CFU/mL, 与等体积5 mg/mL的黄斑蓝子鱼皮肤黏液混合, 30℃静置培养 3h, 涂板计数, 观察其生长情况。
1.9 数据处理
实验中的数据用 SPSS 16.0中 One-wayAnova法进行平均值方差计算和显著性差异分析(DUNCAN法), P值显著性差异临界水平为0.05。
2 结果
2.1 皮肤黏液对寄生虫的杀灭作用
黄斑蓝子鱼(S. oramin)皮肤黏液对刺激隐核虫幼虫的致死率与其他4种实验鱼黏液相比存在显著性差异(图1)。共孵育60min后, 黄斑蓝子鱼皮肤黏液对刺激隐核虫幼虫的致死率为 100%, 而花尾胡椒鲷、美国红鱼、斜带石斑鱼和卵形鲳等4种鱼的黏液对刺激隐核虫幼虫的致死率分别为(26.67±2.92)% 、 (25.00±3.27)% 、 (31.67±5.8)% 、(18.33±3.27)%, 均不及 50%, 其中卵形鲳 鲹黏液的作用效果与空白对照组相近。
在光学显微镜下观察, 黄斑蓝子鱼黏液作用于刺激隐核虫幼虫5min后, 大部分幼虫出现停止运动,形态由椭圆形变为圆形(图2B和D), 纤毛从虫体表面脱落(图 2E), 虫体表层逐渐破裂, 并有大量内含物释放(图2C、F和G), 其他4种实验鱼皮肤黏液与刺激隐核虫作用后, 大部分幼虫活动正常, 死亡的幼虫没有发生虫体形态变化(图 2H), 空白对照组除少量自然死亡, 其他活动正常。
黄斑蓝子鱼黏液与刺激隐核虫滋养体共孵育5min后, 滋养体外膜出现分离(图 3B), 细胞壁有孔洞形成, 并伴随内含物释放(图3C和D), 30min后,整个滋养体被破坏(图3E)。其他4种实验鱼皮肤黏液与滋养体作用后, 滋养体形态无明显变化(图3F)。
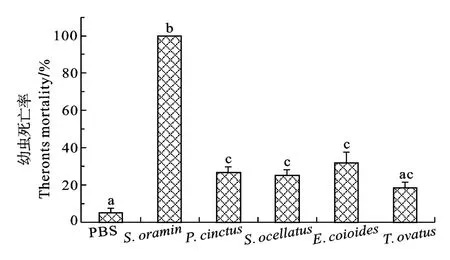
图1 经5种实验鱼皮肤黏液作用60min后的刺激隐核虫幼虫死亡率Fig. 1 Theronts mortality of C. irritans incubated with the skin mucus of five species fish for 60min
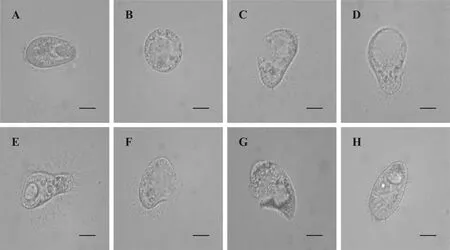
图2 光学显微镜下黄斑蓝子鱼皮肤黏液对刺激隐核虫幼虫的作用观察Fig. 2 Light microscopy analysis of the effect of rabbitfish skin mucus on C. irritans
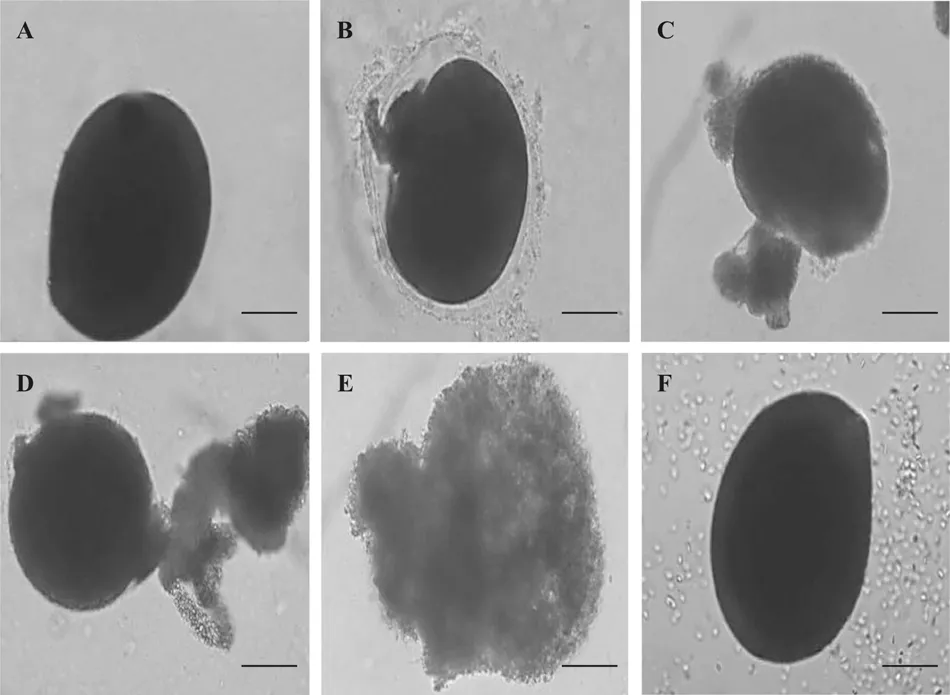
图3 光学显微镜下黄斑蓝子鱼皮肤黏液对刺激隐核虫滋养体的作用观察Fig. 3 Light microscopy analysis of the effect of S. oramin skin mucus on C. irritans trophonts
黄斑蓝子鱼皮肤黏液与多子小瓜虫共孵育60min后, 多子小瓜虫的死亡率达100%, 而花尾胡椒鲷、美国红鱼、斜带石斑鱼和卵形鲳 鲹皮肤黏液对多子小瓜虫幼虫的致死率分别达到(23.33±2.92)%、(30.50±3.27)%、(50.25±5.84)%和(26.67±3.27)%(图4)。黄斑蓝子鱼黏液作用于多子小瓜虫5min后, 光学显微镜下观察发现, 大部分幼虫虫体形态由椭圆形变圆形(图 5B), 虫体纤毛脱落, 表层破裂, 伴随内含物泄漏(图5 C、D和E), 其他四种鱼皮肤黏液作用多子小瓜虫后, 大部分幼虫没有死亡, 死亡的幼虫没有发生虫体形态变化。
黄斑蓝子鱼皮肤黏液与布氏锥虫共孵育 60min后, 布氏锥虫的死亡率达100%, 花尾胡椒鲷、美国红鱼、斜带石斑鱼和卵形鲳 鲹皮肤黏液对布氏锥虫的致死率分别达到(32.33±3.31)%、 (23.15±2.83)%、(18.50±2.66)%和(19.67±3.59)%(图 6)。倒置显微镜观察发现, 死亡的锥虫停止运动, 虫体变形破裂。
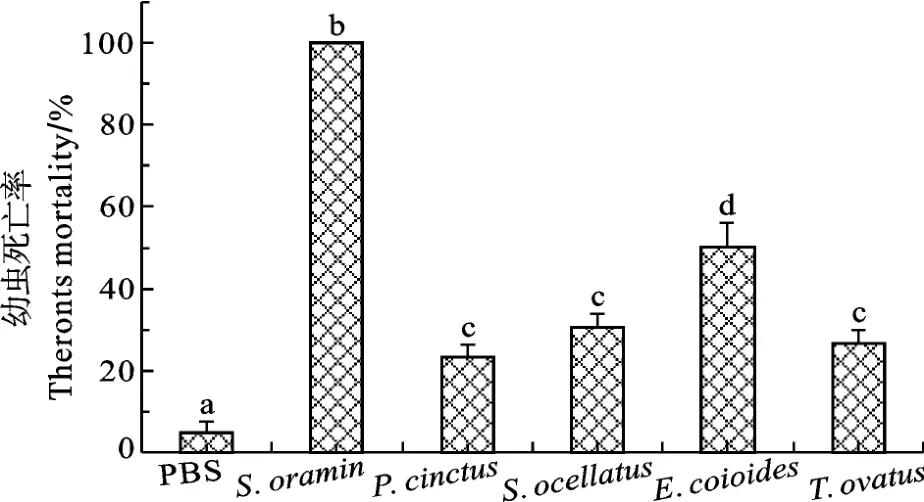
图4 经5种实验鱼皮肤黏液作用60min后的多子小瓜虫幼虫死亡率Fig. 4 Theronts mortality of I. multifiliis incubated with the skin mucus of five species of fish for 60min
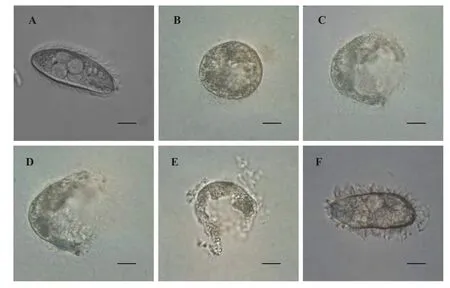
图5 光学显微镜下观察黄斑蓝子鱼皮肤黏液对多子小瓜虫的作用Fig. 5 Light microscopy analysis of the effect of S. oramin mucus on I. multifiliis
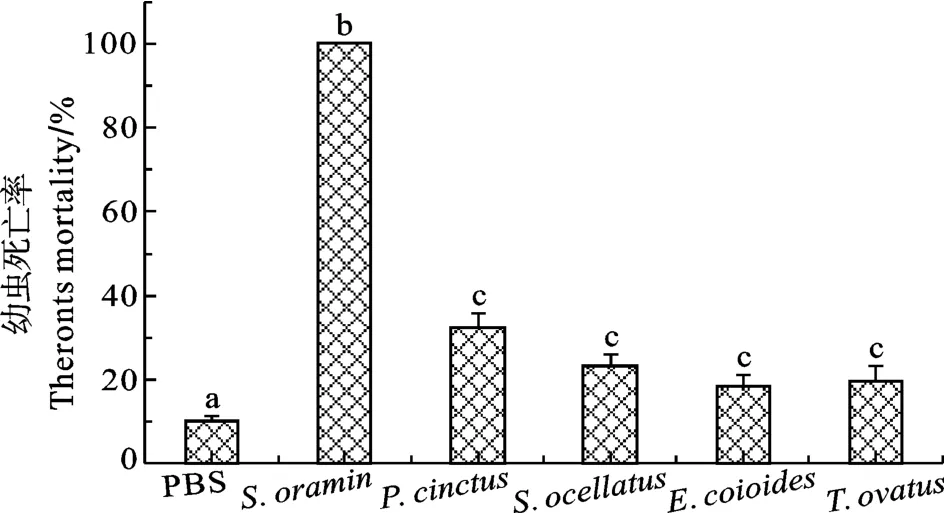
图6 经5种实验鱼皮肤黏液作用60 min后的布氏锥虫死亡率Fig. 6 Theronts mortality of T. brucei brucei incubated with the skin mucus of five species fish for 60 min
黄斑蓝子鱼皮肤黏液蛋白对3种寄生虫的最低杀虫浓度(Minimum Parasiticidal Concentration, MPC)测定结果显示, 其对刺激隐核虫、多子小瓜虫和布氏锥虫的MPC分别为4.0、5.0和3.0 mg/mL。蛋白浓度为5.0 mg/mL的黏液在作用5min后, 对刺激隐核虫幼虫致死率达100%; 4.0 mg/mL蛋白浓度的黏液作用 5min后, 刺激隐核虫的死亡率达到(61.67±5.84)%, 60min后其死亡率接近100%; 3.0 mg/mL蛋白浓度的黏液作用 30min后, 刺激隐核虫死亡率达到(43.33±5.84)%(图7)。对于4.0 mg/mL和3.0 mg/mL蛋白浓度的黏液在作用5min后, 多子小瓜虫的死亡率分别可达(64.00±2.92)%和(45.67±5.84)%, 在30min后死亡率分别上升到(84.33±5.84)%和(68.67±2.92)%(图8)。同样为4.0 mg/mL和3.0 mg/mL蛋白浓度的黏液在作用5min后, 对布氏锥虫的致死率分别为(86.86±2.26)%和(76.29±5.08)%, 60min 后致死率达 100%(图 9)。
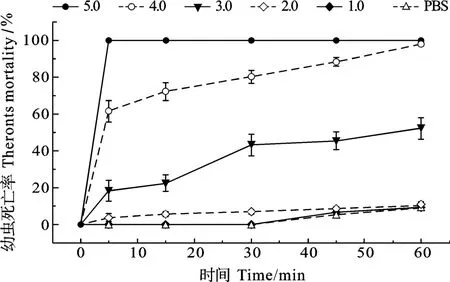
图7 不同浓度黄斑蓝子鱼皮肤黏液对刺激隐核虫幼虫的作用Fig. 7 Effect of different concentrations of S. oramin skin mucus on C. irritans theronts
2.2 黏液对病原菌的抑制作用
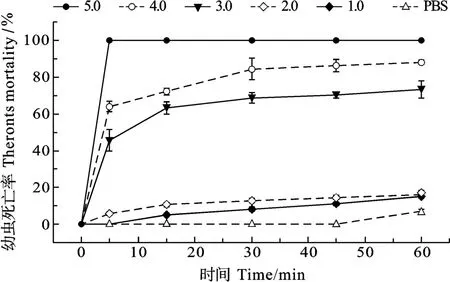
图8 不同浓度黄斑蓝子鱼皮肤黏液对多子小瓜虫幼虫的作用Fig. 8 Effect of different concentrations of S. oramin skin mucus on I. multifiliis theronts
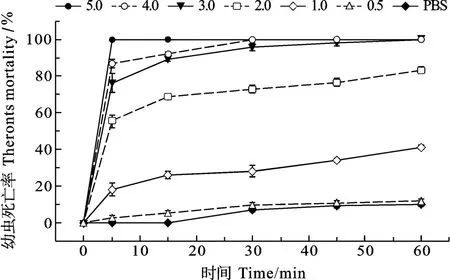
图9 不同浓度黄斑蓝子鱼皮肤黏液对布氏锥虫的作用Fig. 9 Effect of different concentrations of S. oramin skin mucus on T. brucei brucei theronts
黏液抑菌实验结果显示, 黄斑蓝子鱼皮肤黏液除了对大肠杆菌没有抑菌活性外, 对其他 8种实验细菌皆有明显的抑菌活性, 对金黄色葡萄球菌ATCC25923 株、霍乱弧菌和星形诺卡氏菌的抑菌活性较强; 斜带石斑鱼皮肤黏液对所有实验细菌都有明显的抑菌圈, 其中对霍乱弧菌抑菌活性较强(表1、图 10)。 卵形鲳、花尾胡椒鲷和美国红鱼皮肤黏液在实验中没有表现出抑菌活性。
在最低抑菌浓度(Minimum Inhibitory Concentration, MIC)测定中, 黄斑蓝子鱼皮肤黏液对金黄色葡萄球菌、霍乱弧菌、海豚链球菌、溶藻弧菌、温和气单胞菌和副溶血弧菌的 MIC分别为0.16、0.16、0.08、0.63、0.63和 0.63 mg/mL。
在黏液对真菌的抑菌实验中, 5种实验鱼皮肤黏液对小麦赤霉菌和黑曲霉菌没有明显的抑菌活性,与空白对照相比, 无显著性差异。
3 讨论
本实验研究结果表明, 相对于其他实验用鱼,黄斑蓝子鱼黏液, 表现出显著的杀灭刺激隐核虫活性。在鱼类寄生虫侵染宿主过程中, 寄生虫首先附着在皮肤或鳃等部位, 因此宿主在抵御寄生虫过程中, 黏液是第一道屏障, 在之前的研究中发现, 黄斑蓝子鱼较其他实验中的 7种鱼, 对刺激隐核虫的感染强度最低[1]。黄斑蓝子鱼黏液抗刺激隐核虫活性在一定程度解释了该鱼对刺激隐核虫的不敏感性。
黄斑蓝子鱼皮肤黏液存在一种新的杀寄生虫机制。在以往的杀虫物质研究中, piscidin2可以杀灭多子小瓜虫和刺激隐核虫, 它会引起刺激隐核虫幼虫肿胀和空泡化, 但没有引起虫体破裂, 对淡水小瓜虫的滋养体和包囊没有作用[9]; 抗刺激隐核虫抗体可以使幼虫死亡, 幼虫运动减慢聚集成团, 同时幼虫会分泌一些黏性物质, 使纤毛缠绕在一起[7]。在本研究中, 刺激隐核虫和多子小瓜虫的幼虫在经过黄斑蓝子鱼皮肤黏液作用后, 均出现纤毛脱落、虫体肿胀、外膜破裂和内容物泄漏等现象, 因此推测黄斑蓝子鱼皮肤黏液存在一种新的杀虫机制。
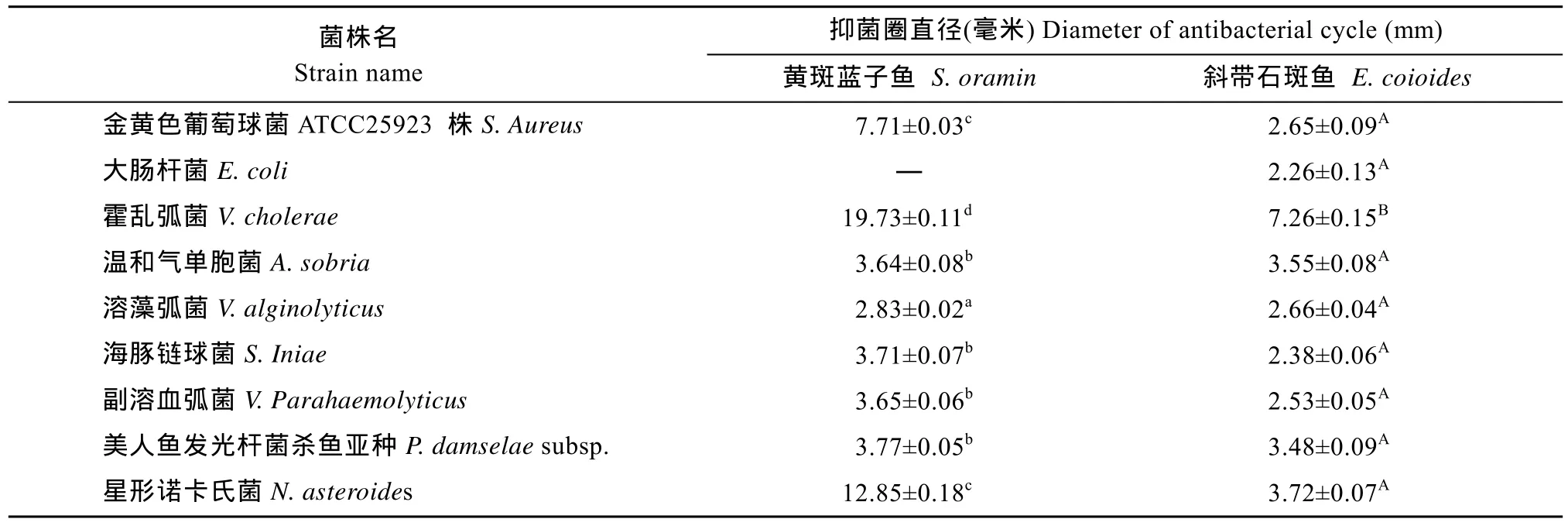
表1 黄斑蓝子鱼和斜带石斑鱼皮肤黏液对9种细菌抑菌效果Tab. 1 Antibacterial activity of skin mucus from S. oramin and E. coioides
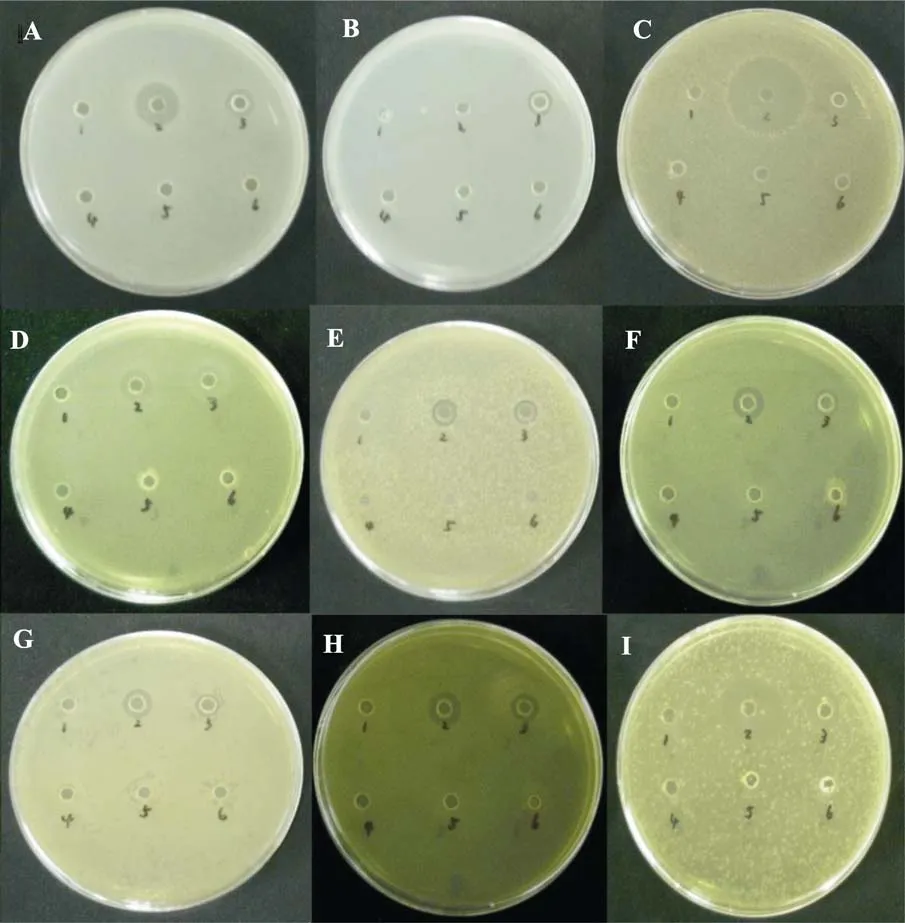
图10 五种实验鱼黏液对9种细菌的抗菌活性Fig. 10 Antibacterial activity of mucus of five species of fish
关于黏液抗菌实验结果, 黄斑蓝子鱼皮肤黏液除了对大肠杆菌没有抑菌活性之外, 对其他 8种实验细菌皆表现出明显的抑菌活性, 说明黄斑蓝子鱼皮肤黏液具有广泛的抑菌谱。点蓝子鱼(Siganus guttatus)和褐蓝子鱼(Siganus fuscescens)的黏液对嗜水气单胞菌、大肠杆菌、美人鱼发光杆菌杀鱼亚种、鼠伤寒沙门氏菌、腐败希瓦菌, 鳗弧菌和副溶血性弧菌具有抑菌活性[8], 该报道与本研究结果相似。在黏液抗真菌实验中, 黄斑蓝子鱼皮肤黏液对实验采用的2种真菌孢子没有明显的抗性。真菌孢子的细胞壁较厚, 对环境的耐受力强, 抗菌活性物质很难对真菌孢子造成破坏, 至于黄斑蓝子鱼皮肤黏液对其他真菌是否有抗菌活性有待研究。再有, 不同的黏液粗提溶剂对黏液的抗菌活性可能会产生影响。分别用纯水、乙醇和二氯甲烷对13种鱼类的黏液进行粗提, 发现这三种溶剂所提取的抗菌活性物质的抗菌效果表现出明显差异[10]。
黄斑蓝子鱼皮肤黏液抗寄生虫和抗菌活性物质可能为同一物质。Wang, et al.发现纯化的APP不仅对刺激隐核虫具有杀灭活性, 同时对金黄色葡萄球菌和大肠杆菌具有杀灭活性[1,6]。据此推测, 黄斑蓝子鱼皮肤黏液中的抗寄生虫因子可能同样具有抗菌活性。迄今为止, 所发现的抗菌活性物质同时对寄生虫具有抗性的种类较少。目前发现了一些抗菌肽对利什曼原虫、疟原虫以及阿米虫等具有抗性[11—13]。而在鱼类中, 从虹鳟分离到的类组蛋白(Histone-like protein, HLP)对卵圆鞭毛虫有致死作用[14], 从杂交条纹鲈分离到的piscidin2对刺激隐核虫、车轮虫和卵圆鞭毛虫有致死作用, 斑点叉尾中类似 Hbβ蛋白可以杀死多子小瓜虫[15], 这些蛋白只具有抗寄生虫活性。若黄斑蓝子鱼皮肤黏液中的抗寄生虫因子兼具抗菌活性, 其杀微生物机制值得进一步研究。
在本研究中, 黄斑蓝子鱼黏液无论是对海水鱼类寄生虫、淡水鱼类寄生虫和哺乳动物寄生虫均表现出明显的抗虫效果, 说明它没有抗寄生虫特异性,它是否对其他的寄生虫还有明显的作用需要进一步的实验证明。

