硫氰酸亚铜产品纯度的测定
张铁莉,刘征原
(唐山师范学院 化学系,河北 唐山 063000)
硫氰酸亚铜是一种优良的无机颜料,可用作船底防污涂料、果树防护、聚氯乙烯塑料的阻燃与消烟剂、润滑油脂的添加剂、非银盐系感光材料、有机合成催化剂、聚合反应调节剂、海水电池的电极材料、聚硫橡胶的稳定剂、玻璃纤维染色的载体及牙齿磨料等。利用工业废液生产硫氰酸亚铜具有经济价值和社会效益[1]。本文对工业废液制备所得硫氰酸亚铜产品中的硫氰酸根离子和总铜含量进行了分析测定,建立了滴定法测定硫氰酸亚铜中硫氰酸根离子和总铜含量的容量分析方法。容量分析法测定样品时,关键步骤之一是要对试样进行适当的处理,制备适宜的测定试液。本文采用不同方法制备了硫氰酸根离子和铜的测定试液,采用佛尔哈德返滴定法测定了硫氰酸根离子的含量,用间接碘量法测定了总铜含量。
1 实验部分
1.1 测定原理
1.1.1 佛尔哈德返滴定法测定硫氰酸根
1.1.1.1 SCN-测定试液的制备
硫氰酸亚铜几乎不溶于水,硫氰酸根的测定试液由样品与NaOH溶液加热反应后的滤液得到[1]。试液的制备基于如下反应:
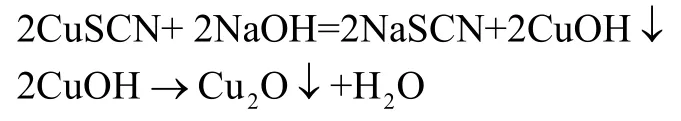
Cu2O不溶于冷水和热水,可经过滤除去,滤液可作为硫氰酸亚铜样品中SCN-的测定试液。
1.1.1.2 SCN-的测定
用铁铵矾作指示剂的佛尔哈德返滴定法包括 2个过程:首先,试液中的SCN-与过量的硝酸银标准溶液反应,使得 SCN-全部沉淀;然后,用 NH4SCN标准溶液返滴定剩余的硝酸银。所涉及到的反应如下:
转化反应:
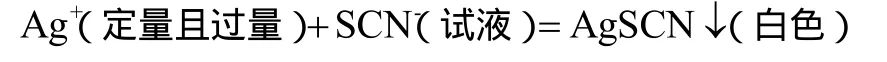
滴定反应:

指示终点反应:

滴定过程中,试液中的SCN-以AgSCN沉淀形式定量析出,当溶液中剩余的 Ag+定量沉淀后,稍过量的 SCN-与Fe3+生成红色络合物,指示到达终点。
1.1.2 碘量法测定总铜含量
1.1.2.1 Cu2+测定试液的制备
因为间接碘量法测定的是以Cu2+形式存在的铜,所以测定硫氰酸亚铜样品中的总铜含量,宜采用氧化性的酸溶解试样。本文分别采用硫酸—硝酸和过氧化氢—硝酸两种不同方法分解试样,制备了Cu2+测定试液。
1.1.2.2 Cu2+的测定
在微酸性溶液中,Cu2+与碘化钾定量反应生成碘,以硫代硫酸钠标准溶液为滴定剂,以淀粉为指示剂,根据硫代硫酸钠标准溶液的用量可计算铜的含量。所涉及到的反应如下:
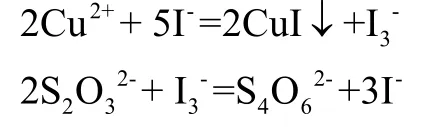
间接碘量法必须在弱酸性或中性溶液中进行,在测定Cu2+时,用NH4HF2控制溶液的酸度为pH3-4。CuI沉淀表面易吸附少量碘,这部分碘不与淀粉作用,致使终点提前。为此,在临近终点时加入KSCN溶液,使CuI沉淀转化为溶解度更小的CuSCN沉淀,而CuSCN不吸附I2,从而将被吸附的I2释放出来,提高测定结果的准确度。
1.2 试剂
1.2.1 测定SCN-的试剂[2]
0.048 15 mol·L-1NH4SCN标准溶液(按照试液的测定方法标定);1:2(v/v)HNO3;400 g·L-1铁铵矾溶液(1 mol·L-1HNO3溶液);0.100 1 mol·L-1AgNO3标准溶液。
1.2.2 测定总铜的试剂
浓硫酸;浓硝酸;30%过氧化氢;20% NH4HF2溶液;100 g·L-1KI溶液;K2Cr2O7基准物质;0.106 5 mol·L-1Na2S2O3标准溶液(用重铬酸钾基准物质标定的浓度);100 g·L-1KSCN溶液;5 g·L-1淀粉溶液。
1.3 实验方法
1.3.1 SCN-的测定方法
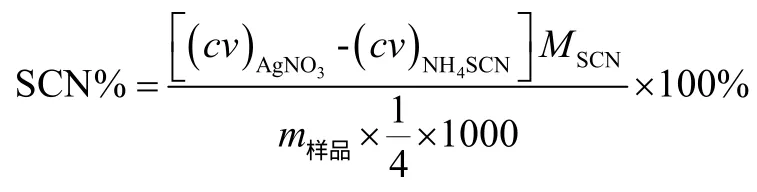
用差减法准确称取硫氰酸亚铜样品0.3 g,置于100 mL烧杯中,加入30 mL水,再加入25 mL 0.5 mol·L-1NaOH溶液,在不断搅拌下加热至微沸,保持 5 min,取下趁热用中速滤纸过滤于100 mL容量瓶中,用水分多次洗涤沉淀,至洗出液呈中性,并检查无SCN-(用Fe3+检查,至不显示红色),用去离子水稀释滤液到刻度,混匀,作为SCN-的待测试液[1]。准确移取25.00 mL SCN-测定试液于250 mL锥形瓶中,加入4 mL1:2(v/v)HNO3,摇匀后,加入10.00 mL 0.100 1 mol·L-1AgNO3标准溶液,2 mL铁铵矾指示剂溶液,充分摇匀,再用0.048 15 mol·L-1NH4SCN标准溶液滴定至有稳定的淡粉色出现,即为终点,记录消耗NH4SCN标准溶液的体积。根据称量硫氰酸亚铜样品的质量和NH4SCN标准溶液的浓度和滴定消耗的体积,计算试样中硫氰酸根离子的含量。计算公式如下:
1.3.2 总铜的测定方法
准确称量0.3 g硫氰酸亚铜样品于250 mL碘量瓶中,加入5 mL硫酸和3 mL硝酸,在不断搅拌下加热分解[3],溶液呈蓝绿色,继续加热除去过量的酸,至近干,碘量瓶底部有残渣析出。或按照上述方法加入5 mL过氧化氢,2 mL硝酸分解硫氰酸亚铜样品。向上述试样分解后所得残渣中加入 100 mL去离子水,使之溶解,然后按照文献[4]方法,加入10 mL NH4HF2溶液,摇匀,再加入10 mL KI溶液,轻轻摇匀,立刻用Na2S2O3标准溶液滴定至呈浅黄色,加入2 mL淀粉指示剂,继续滴定至呈浅蓝色,再加入 10 mL 100 g·L-1KSCN,溶液蓝色加深,再继续用Na2S2O3标准溶液滴定至蓝色刚好消失即为终点,此时溶液呈米色或浅肉红色。硫氰酸亚铜样品中总铜含量的计算公式为:
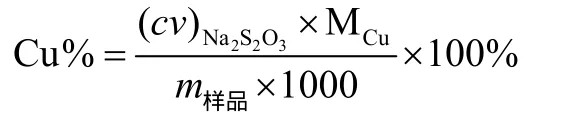
2 结果与讨论
在两种不同反应条件下由废液制备得到的硫氰酸亚铜,分别记作样品 1和样品 2。实验中对样品均进行了 3次平行测定。
2.1 硫氰酸亚铜样品中SCN-的测定
采用滴定分析法测定样品时,首先要使被测定的组分以适宜的形式存在于溶液中,硫氰酸亚铜几乎不溶于水,根据文献[3]方法,测定 SCN-的试液由样品与NaOH溶液加热反应制备。为了定量得到SCN-,采用热过滤,得到的滤液作为SCN-待测试液。为了提高测定SCN-的准确度,采用与被测 SCN-试液同样的佛尔哈德返滴定法标定NH4SCN标准溶液。实验测得硫氰酸亚铜样品中SCN-含量如表1所示。佛尔哈德法的最大优点是在酸性介质中进行,能够消除许多酸根离子的干扰,选择性高。用佛尔哈德返滴定法测定硫氰酸亚铜中的SCN-,滴定终点十分明显,测定结果准确。
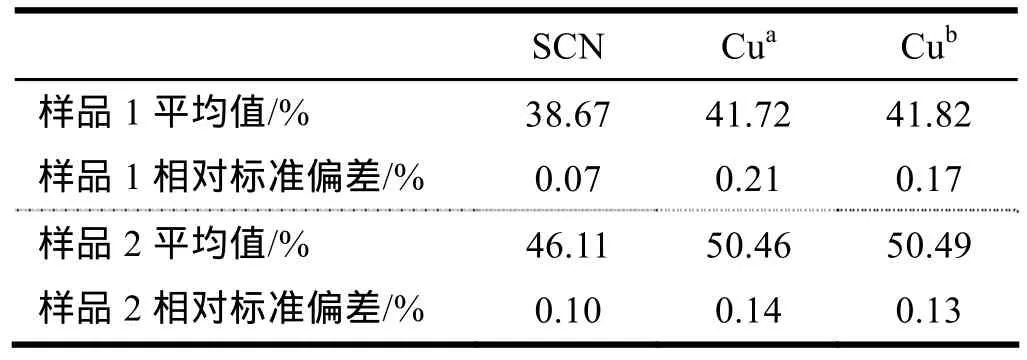
表1 硫氰酸亚铜样品中SCN-和总铜含量的测定
2.2 硫氰酸亚铜样品中总铜的测定
测定硫氰酸亚铜样品纯度时,首先应测定总铜含量[3]。采用间接碘量法测定铜时,实际上直接测定的是Cu2+,因此,试样经过溶解处理后,要求试样中的铜要全部以Cu2+形式存在于试液中。根据氰化铜样品制备铜试液的方法[4],首先采用硫酸—硝酸分解硫氰酸亚铜样品,使试样中的铜以Cu2+存在于试液中。因为碘量法测定时,溶液应为弱酸性,酸性不能太强,否则,Na2S2O3分解影响测定,因此,上述试液需要蒸发近干,以除去试液中剩余的酸;但是因为硫酸的沸点较高,蒸发近干需要的时间较长,不利于提高分析速度。为此,实验研究了用过氧化氢代替硫酸,采用过氧化氢—硝酸分解硫氰酸亚铜样品,溶样时,过氧化氢加入后反应进行较快,会产生大量气泡,若不尽快加入硝酸,可能会使试液溢出!因此加入过氧化氢后,要尽快加入硝酸,这样反应能够平稳地进行,溶液很快变成天蓝色,并且很快就可将试液蒸发近干,有利于提高分析速度。之后,用去离子水溶解残渣,即可得到间接碘量法测定硫氰酸亚铜样品中总铜含量的待测试液。
滴定剂 Na2S2O3标准溶液的浓度用基准物质重铬酸钾标定[5]。按照上述方法,实验测得了硫氰酸亚铜样品中总铜含量,测定结果如表1所示。
比较表1的测定结果可知,用两种不同的方法分解试样制备Cu2+试液,测得总铜含量一致(相对标准偏差小于0.2%)。采用该方法测定了两种不同的硫氰酸亚铜样品,3次测定结果的精密度均较好。需要说明的是,由于样品1的纯度较低,用过氧化氢—硝酸分解硫氰酸亚铜样品后所得残渣,用水溶解时有少量黄色不溶物,推测是样品1中的杂质产生的,但不影响样品中总铜的测定结果(因为该方法与硝酸—硫酸分解样品时的测定结果是一致的)。而样品2的纯度较高,用同样的方法处理样品2时,无不溶物。此外,用硝酸—硫酸分解硫氰酸亚铜样品 1和样品 2时的残渣均全部溶于水,无不溶物,说明硝酸—硫酸法分解样品的能力更强,但蒸发近干需要的时间长,不利于提高分析速度。因此,本文提出用过氧化氢—硝酸分解硫氰酸亚铜样品制备总铜含量的测定试液是一种较好的方法。
3 结论
分别采用佛尔哈德返滴定法和间接碘量法测定了两种硫氰酸亚铜样品中的硫氰酸根和总铜的含量。硫氰酸根的待测试液由样品与NaOH溶液通过加热反应制备;总铜的待测试液分别采用硫酸—硝酸和过氧化氢—硝酸两种方法与样品反应制备,两种制备试液的方法所测得总铜的含量一致。通过比较可认为,用过氧化氢—硝酸制备总铜测定试液具有方便、快速的优点。
[1] 王丽波.用脱硫废液生产硫氰酸亚铜的方法.燃料与化工,2011,42(2):59-61.
[2] 华中师范大学,东北师范大学,陕西师范大学,北京师范大学.分析化学实验(第三版)[M].北京:高等教育出版社,2001:89.
[3] 顾先觉,田丰碧.硫氰酸亚铜的自动自动电位滴定法测定[J].云南化工,1989(2):25-26.
[4] 高新华.氰化镀铜溶液中铜含量的多种方法测定[J].丹东化工,1995(3):41-42.
[5] 华中师范大学,东北师范大学,陕西师范大学,北京师范大学.分析化学实验(第三版)[M].北京:高等教育出版社,2001:85.

