表达miR-192的重组腺病毒的构建及其在肝细胞中的表达分析
代晓朋 ,李军锋 ,张红飞 ,张伟 ,赵光宇 ,于虹 ,郭彦 ,周育森
1.军事医学科学院 微生物流行病研究所,病原微生物生物安全国家重点实验室,北京 100071;
2.郑州大学 公共卫生学院,河南 郑州 450001
微小RNA(microRNA,miRNA)是一种内源性的高度保守的由19~25个核苷酸组成的非编码RNA,它能在转录后水平上通过调节靶基因表达,参与细胞的凋亡与增殖、组织的分化、抗病毒免疫等生物学过程[1-2]。在对miRNA的功能研究中,怎样使miRNA有效地高表达是一个重要方面。构建表达miRNA的真核表达载体及将化学合成的miRNA模拟物(mimic)转染细胞是目前常用的方法。但对部分细胞,如肝癌细胞系HepG2而言,存在转染效率不高且重复性差等问题。而腺病毒表达系统具有宿主范围广、能在非复制型细胞中表达、复制效率高、没有插入突变、表达水平高等特点[3-5],因而得到广泛应用。
miRNA-192(miR-192)在肝细胞癌[6]、乳腺癌[7]、肺癌[8]、糖尿病患者肾脏[9]中表达异常,提示miR-192可能与这些肿瘤的发生发展有密切的关系。深入研究miR-192对肝细胞功能的影响及分子机制是我们关注的问题。为了在肝细胞中高效表达miR-192,我们拟选择构建腺病毒表达系统,将miR-192前体基因插入重组腺病毒载体进行包装,感染肝细胞后检测其表达情况。视网膜母细胞瘤基因1(retino⁃blastoma 1,RB1)为调控细胞周期的重要分子,其mRNA的3'UTR区域含miR-192结合序列[8],我们将研究miR-192在肝细胞中是否调节RB1的表达。本工作将为探讨miR-192在肝细胞中的功能及调节的靶基因提供基础。
1 材料和方法
1.1 材料
QBI-293A细胞、HepG2细胞、含pAdEasy-1腺病毒骨架的大肠杆菌BJ5183感受态、空腺病毒、pAdTrack腺病毒载体系统均为本研究室留存;大肠杆菌DH5α感受态、DNA marker、DNA凝胶回收试剂盒和小量质粒提取试剂盒均购自北京全式金生物技术有限公司;pMD18-T载体系统、M-MLV反转录酶、RNase抑制剂购自TaKaRa公司;胎牛血清、高糖型 DMEM 培养液(C12430)、LipofectAMINE2000试剂购自Invitrogen公司;限制性内切酶购自NEB公司;定量PCR仪为Eppendorf公司产品;引物由上海生物工程有限公司合成。
1.2 穿梭载体pAdTrack-miR-192的构建和鉴定
根据miR-192前体基因序列(GenBank:NR_029578.1)设计扩增引物(表1)。提取HepG2细胞基因组,以其为模板扩增miR-192前体基因。琼脂糖电泳回收大小正确的条带,与pMD-18T克隆载体相连,氨苄西林选择培养,挑克隆菌培养后提质粒酶切鉴定,对条带大小正确的克隆进行序列测定。将测序正确的重组质粒用KpnⅠ和SalⅠ酶切,切下miR-192前体基因,连接到经相同酶切的pAdTrack穿梭载体中,转化大肠杆菌DH5α感受态细胞,卡那霉素抗性选择阳性克隆,提质粒并用XhoⅠ/BamHⅠ双酶切鉴定,正确的重组质粒(含有2个BamHⅠ酶切位点)理论上被切为750 bp、3.8 kb、5.1 kb等3条片段。将插入miR-192前体基因的穿梭载体命名为pAdTrack-miR-192。
1.3 miR-192重组腺病毒载体pAd-miR-192的构建
将构建的pAdTrack-miR-192用PmeⅠ酶切线性化,转化含腺病毒骨架pAdEasy-1的大肠杆菌BJ5183感受态,卡那霉素抗性选择培养24 h,挑选10个最小的克隆,根据文献[10]用快速裂解法进行初步筛选,选择条带最大的克隆,提质粒并转化大肠杆菌DH5α感受态进行扩增,提质粒后用PacⅠ酶切鉴定,进行琼脂糖凝胶电泳,如大条带大于30 kb、小条带大小为3或4.5 kb,说明该克隆为重组成功的腺病毒,命名为pAd-miR-192。
1.4 细胞培养和转染
在DMEM培养液(2 mmol/L谷氨酰胺,10%胎牛血清,100 U/mL青霉素,100 μg/mL链霉素)中,于5%CO2、37℃恒温孵箱中培养QBI-293A细胞。转染用试剂为Invitrogen公司的LipofectAMINE2000,转染方法依据操作说明书。
1.5 miR-192重组腺病毒的包装和滴度测定
将重组成功的pAd-miR-192载体经PacⅠ酶切线性化后,用胶回收试剂盒回收,经DNA定量后转染QBI-293A细胞,培养7 d后在显微镜下观察细胞空斑病变,在荧光显微镜下观察EGFP的表达,当细胞中出现病变且视野中几乎或局部全为绿色荧光时,表明重组腺病毒在QBI-293A细胞中包装成功。收集包装腺病毒的细胞,于-70℃/37℃反复冻融3次以裂解细胞,离心后取含有病毒的上清液于-70℃保存备用。取空腺病毒和miR-192重组腺病毒再次感染QBI-293A细胞以扩增病毒。经过3次扩增,根据文献[11]的方法将病毒上清按1∶5的比例梯度稀释,根据感染细胞中绿色荧光细胞的阳性数计算病毒滴度及感染复数(MOI)。
1.6 miR-192重组腺病毒在HepG2细胞中的表达和检测
在六孔板中接种HepG2细胞(2.5×105/孔),培养条件与QBI-293A一致,在恒温孵箱中37℃培养18 h。吸去培养液,每孔补加新鲜的培养液500 μL。以空腺病毒为对照,每组重复3次。按照MOI为20的标准加入miR-192重组腺病毒,吸附1 h后补加1.5 mL培养液继续培养,72 h后用荧光显微镜观察绿色荧光的表达情况,以确定重组腺病毒是否感染HepG2细胞。收集成功感染的细胞检测细胞中miR-192和RB1的表达。
1.7 q-PCR检测病毒感染细胞中miR-192和RB1 mRNA的相对表达
依据茎环法定量检测细胞中miRNA[12],设计茎环逆转录引物和定量检测上游引物(表1)。收集感染构建的含miR-192前体基因的重组腺病毒和对照空腺病毒的HepG2细胞,提取RNA后,采用miR-192和U6茎环逆转录引物,用M-MLV酶进行反转录,然后用miR-192和U6定量检测上游引物分别和茎环结构通用下游引物组合,根据各组细胞miR-192 和 U6检测的 Ct值,利用 2-ΔΔCt法进行相对定量分析,检测miR-192在病毒感染细胞后是否表达miR-192。
用Primer Express 3.0软件设计RB1的定量检测引物(表1)。取过表达miR-192的细胞和对照细胞的RNA各1 μg,用M-MLV反转录为cDNA,然后用RB1和β-actin定量检测引物,以β-actin为内参,实时定量PCR检测RB1 mRNA和β-actin的Ct值,利用 2-ΔΔCt法进行相对定量分析。
1.8 统计学分析
统计学分析所用软件为GraphPad Prism 4,比较方式为成组t检验,P<0.05(双侧)表明差异具有统计学意义。
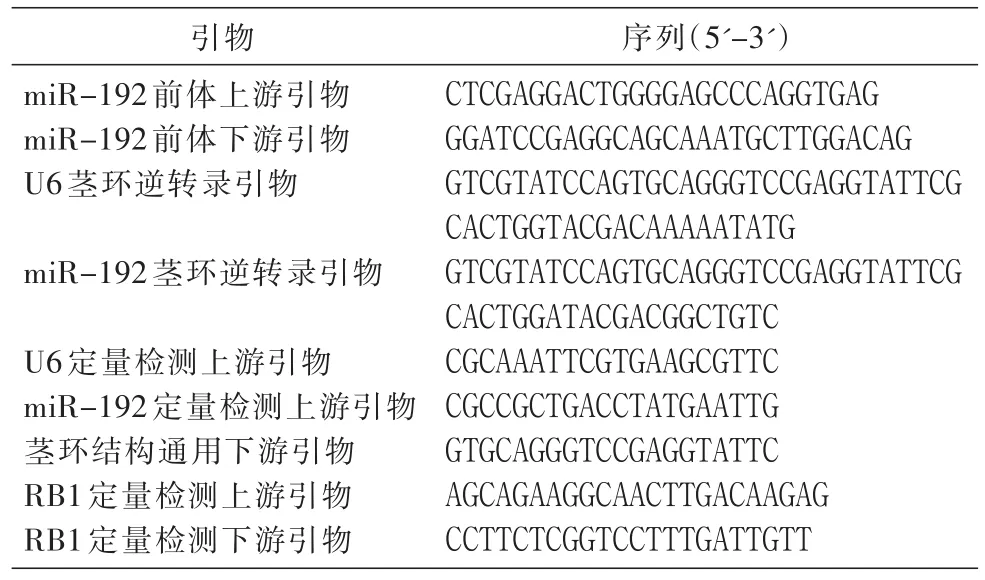
表1 所需引物及序列
2 结果
2.1 miR-192前体基因的克隆
以HepG2细胞提取的基因组为模板扩增miR-192前体基因,胶回收约670 bp的扩增产物,连接T载体,构建重组载体T-miR-192,对T-miR-192进行EcoRⅠ/HindⅢ双酶切鉴定(图1)。酶切鉴定正确后,交北京奥科鼎盛生物科技公司进行序列测定,表明获得的miR-192基因序列与GenBank中完全一致。
2.2 表达miR-192的重组腺病毒载体的构建
依据前述方法将miR-192前体基因与穿梭载体pAd-Track连接,用BamHⅠ/XhoⅠ双酶切(图2),酶切片段大小与理论值一致,表明构建了穿梭载体pAdTrack-miR-192。将鉴定正确的pAdTrackmiR-192用PmeⅠ酶切线性化后转化含pAdEasy-1腺病毒骨架的大肠杆菌BJ5183感受态细胞,用卡那霉素抗性的培养基选择培养,挑选最小的克隆菌扩增快速裂解鉴定,初步筛选,筛选到克隆后转化大肠杆菌DH5α感受态扩增质粒后用PacⅠ酶切鉴定,切出约4.5 kb的条带,与理论值相符(图2),表明构建了表达miR-192的重组腺病毒载体pAd-miR-192。
2.3 含miR-192前体基因的重组腺病毒的包装和扩增
将经PacⅠ酶切线性化的重组腺病毒载体pAd-miR-192转染QBI-293A细胞,于5%CO2、37℃培养箱中孵育,荧光显微镜下检测绿色荧光蛋白的表达。转染第8 d时,在普通荧光显微镜下检测到细胞病变,且绿色荧光充满视野中的绝大多数细胞(图3),提示病毒包装成功。收集包装细胞,-70℃/37℃反复冻融3次以收获重组腺病毒pAd-miR-192,将病毒冻融上清液反复感染QBI-293A细胞以大量扩增并收获病毒。经过3次扩增,根据文献[11]的方法将病毒上清按1∶5的比例梯度稀释,根据感染细胞中绿色荧光细胞的阳性数计算病毒滴度为4×107PFU/mL,MOI为18。

图1 miR-192前体基因的克隆和鉴定
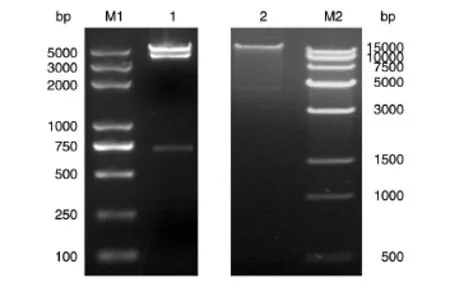
图2 表达miR-192重组腺病毒载体的鉴定
2.4 含miR-192前体基因的重组腺病毒细胞中的miR-192表达分析及靶基因分析
在六孔板中接种HepG2细胞,在恒温孵箱中于37℃培养18 h,将扩增的含miR-192前体基因的重组腺病毒与对照空腺病毒经滴定后感染HepG2细胞,72 h后在荧光显微镜下观察,可见视野中有大量绿色荧光(图4A),说明重组腺病毒成功感染了HepG2细胞。收集2组细胞进行miR-192及RB1定量检测。结果表明,转染含miR-192前体基因腺病毒的细胞中,miR-192的表达显著高于转染空腺病毒的细胞(P<0.001)(图4B),说明构建的含miR-192前体基因的腺病毒感染HepG2细胞后,miR-192的表达水平远高于对照细胞,即成功构建了可以高效表达miR-192的重组腺病毒,同时也建立了miR-192高表达细胞模型。为了检测3'非翻译区含miR-192结合位点的RB1在肝细胞是否是miR-192的靶基因,对2组细胞的RB1 mRNA进行了相对定量分析。结果表明,感染重组腺病毒后细胞中RB1 mRNA的表达水平明显下降(P<0.001)(图4C),表明在肝细胞中miR-192能够靶向RB1 mRNA。
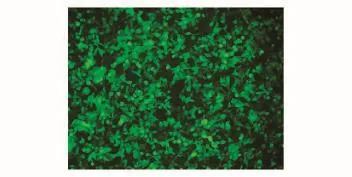
图3 荧光显微镜下检测pAd-miR-192转染QBI-293细胞后GFP的表达(×200)
3 讨论
miR-192最初由Lagos-Quintana等[13]克隆,随后由Lim等[14]证实。目前确定miR-192前体基因位于人11号染色体上,与miR-194成簇共同转录;在肝组织和结肠组织中高表达,而在癌组织中低表达,在一些肝癌组织中其序列发生了突变。研究表明,在肺癌组织中miR-192低表达,抑制肺癌细胞系A549、H460、95D的增殖。在结肠癌细胞中,p53调节miR-192表达,miR-192的表达进而抑制肿瘤治疗的靶标二氢叶酸还原酶的翻译,可以促进细胞G1和G2期的阻滞,参与了p53抑制肿瘤的过程[15]。
miR-192在肝细胞中表达丰度高,然而有关其对肝细胞功能的影响及调控的分子机制的报道却很少,一些未知的功能和机制有待研究和阐明。在对miRNA进行功能研究中,它的过表达和抑制是其中的一个重要而基本的环节。考虑到腺病毒具有感染效率高、宿主广泛、容易制备表达、不整合入染色体、表达效率高等优点,我们选择构建miRNA的腺病毒载体。通过对所构建的miR-192腺病毒的表达进行分析检测,发现miR-192在HepG2细胞中的表达显著提高,建立了miR-192过表达肝细胞模型,为进一步研究其对肝细胞的功能影响打下了基础。为了鉴定miR-192调控的分子,选择在肺癌中的miR-192靶标分子RB1进行检测,发现在肝癌细胞中过表达miR-192同样可以明显降低细胞中RB1 mRNA的水平。该实验验证了在肝癌细胞中RB1为miR-192的靶标分子。综上,我们建立的miR-192高表达肝细胞模型,在丰度和功能上实现了miR-192的过量表达,而且可用来验证靶基因。这为我们进行miR-192的肝功能研究奠定了重要基础,同时也为其他miRNA的研究提供了一种简单高效表达所需miRNA的方法。

图4 含miR-192前体基因的重组腺病毒感染肝细胞后miR-192的表达及靶基因分析
[1]Baltimore D,Boldin M P,O'Connell R M,et al.MicroRNAs:new regulators of immune cell development and function[J].Nat Immunol,2008,9(8):839-845.
[2]O'Connell R M,Rao D S,Chaudhuri A A,et al.Physiologi⁃cal and pathological roles for microRNAs in the immune sys⁃tem[J].Nat Rev Immunol,2010,10(2):111-122.
[3]Pandori M,Hobson D,Sano T.Adenovirus-microbead conju⁃gates possess enhanced infectivity:a new strategy for local⁃ized gene delivery[J].Virology,2002,299(2):204-212.
[4]Nasz I,Adam E.Recombinant adenovirus vectors for gene therapy and clinical trials[J].Acta Microbiol Immunol Hung,2001,48(3-4):323-348.
[5]Adam E,Nasz I.Adenovirus vectors and their clinical applica⁃tion in gene therapy[J].Orv Hetil,2001,142(38):2061-2070.
[6]Yang J,Zhou F,Xu T,et al.Analysis of sequence variations in 59 microRNAs in hepatocellular carcinomas[J].Mutat Res,2008,638(1-2):205-209.
[7]Yang S,Du J,Wang Z,et al.Dual mechanism of deltaEF1 expression regulated by bone morphogenetic protein-6 in breast cancer[J].Int J Biochem Cell Biol,2009,41(4):853-861.
[8]Feng S P,Cong S J,Zhang X,et al.MicroRNA-192 target⁃ingretinoblastoma1 inhibitscellproliferation and induces cellapoptosisin lung cancercells[J].Nucleic AcidsRes,2011,39(15):6669-6678.
[9]Kato M,Zhang J,Wang M,et al.MicroRNA-192 in diabetic kidney glomeruli and its function in TGF-beta-induced colla⁃gen expression via inhibition ofE-box repressors[J].Proc Natl Acad Sci USA,2007,104(9):3432-3437.
[10]范晶,梁梓,伏秦超,等.一种经济、简便和准确鉴定重组质粒的方法[J].生物技术,2010,20(3):54-56.
[11]He T C,Zhou S B,Costa L T,et al.A simplified system forgenerating recombinantadenoviruses[J].Proc NatlAcad Sci USA,1998,95(5):2509-2514.
[12]鲍春旸,李军锋,张慧娜,等.用于鉴定microRNA靶基因的新型双萤光素酶报告基因系统的构建及应用[J].生物技术通讯,2011,22(5):651-656.
[13]Lagos-Quintana M,Rauhut R,Meyer J,et al.New microR⁃NAs from mouse and human[J].RNA,2003,9(2):175-179.
[14]Lim L P,Glasner M E,Yekta S,et al.Vertebrate microRNA genes[J].Science,2003,299(5612):1540.
[15]Song Bo,Wang Yuan,Kenji K,et al.miR-192 regulates dihy⁃drofolate reductase and cellular proliferation through the p53-mirna circuit[J].Clin Cancer Res,2008,14(24):8080-8086.

