一串红自封顶型品种内源激素含量特征分析
陈洪伟,洪培培 (北京农学院城乡发展学院,北京 102206)
杨建玉 (北京市石景山区业余大学暨石景山社区学院,北京 100043)
王红利,智利婷 (北京农学院园林学院,北京 102206)
刘克锋 (北京农学院城乡发展学院,北京 102206)
一串红自封顶型品种内源激素含量特征分析
陈洪伟,洪培培 (北京农学院城乡发展学院,北京 102206)
杨建玉 (北京市石景山区业余大学暨石景山社区学院,北京 100043)
王红利,智利婷 (北京农学院园林学院,北京 102206)
刘克锋 (北京农学院城乡发展学院,北京 102206)
为了解一串红(Salviasplendens)‘彩铃红’株型突变机理,以‘彩铃红’和其野生型品系‘35’的一级侧枝和扦插苗(一级侧枝为插穗)为材料,通过测定侧芽萌动前后‘彩铃红’和‘35’的茎尖、茎节及根的内源激素含量,分析了两者内源激素含量特征差异。结果表明,在侧芽萌动前和后,‘彩铃红’和‘35’不同组织中生长素、细胞分裂素、脱落酸含量和茎节中生长素与细胞分裂素比值差异较大。侧芽萌动前,‘彩铃红’茎尖和茎节生长素含量均比‘35’低,茎节内细胞分裂素活性成分含量高于‘35’,茎节内脱落酸含量低于‘35’,茎节内生长素与细胞分裂素比值低于‘35’。侧芽萌动后,‘彩铃红’茎尖和茎节生长素含量均比‘35’高,茎尖和根尖细胞分裂素含量高于‘35’,茎节脱落酸含量远低于‘35’,茎节内生长素与细胞分裂素比值高于‘35’。
一串红(Salviasplendens);株型突变体;顶端优势;内源激素
植物激素对植物分枝发育和株型具有重要的调控作用[1],而植物的分枝与株型在很大程度上受顶端优势的影响[2],顶端优势解除直接导致侧芽的生长发育。对诸多植物分枝突变体(如拟南芥、水稻、豌豆、矮牵牛、马铃薯和玉米等模式植物和农作物)的研究表明,分枝能力或分枝类型突变,是由于基因突变影响植物激素合成或降解有关的酶促反应,而最终影响有关激素的合成或降解,致使顶端优势减弱或增强,从而目前改变分枝发育和株型形成[3-8]。植物的顶端优势是受一种或多种激素共同调控的复杂的生命现象。目前生长素(IAA)、细胞分裂素(CTK)与顶端优势的相关研究较多,脱落酸(ABA)等也有报道。
一串红(Salviasplendens)为唇形科鼠尾草属植物,其花色鲜艳,观赏期长,在我国园林绿化中占有极为重要的地位,是花卉配置及花坛中必不可少的常用植物材料,特别是北方城市“五·一”和“十·一”花坛、花带主要材料之一。国内生产一串红通常多行人工摘心以解除顶端优势促进分枝。本课题组在对一串红种质资源收集、整理及选育过程中,从收集的野生型品系‘35’中发现顶端优势丧失,不必摘心株型自然成球的株型突变体,经系统选育后通过北京市林木品种审定委员会品种审定,命名为‘彩铃红’。‘彩铃红’在营养生长早期主茎茎节每节均可萌发侧芽并伸长生长形成一级侧枝,之后一级侧枝每枝节继续萌发侧芽并伸长生长形成二级侧枝,生命周期内可形成至四级侧枝。品系‘35’尽管生命周期内也形成至四级侧枝,但只有主茎开花后,花下3~4节茎节的侧芽才伸长形成一级侧枝,二级侧枝亦是在一级侧枝开花后花下3 ~4节枝节的侧芽伸长。与品系‘35’相比,‘彩铃红’分枝形成早,分枝数量多,分枝能力极强。本研究以一串红‘彩铃红’与品系‘35’为试验材料,采用高效液相色谱-质谱联用技术对‘彩铃红’和其野生型品系‘35’的内源生长素、细胞分裂素及脱落酸含量进行测定,分析‘彩铃红’和‘35’植株中与顶端优势相关内源植物激素含量特征,以期为研究‘彩铃红’株型突变机理提供参考。
1 材料与方法
1.1 材料

A:野生型品系‘35 ’ B:‘彩铃红’
以一串红收集品系‘35’和自该品系株型突变体中选育出的‘彩铃红’为试验材料。生长过程中,‘彩铃红’植株顶端优势弱,分枝能力强(图1)。
1.2 方法
试验材料种植在北京农学院科技园2号温室。剪取‘彩铃红’和品系‘35’带3个枝节的一级侧枝扦插于蛭石中,室温保持25℃左右,约15 d生根成活。在扦插苗茎节上侧芽萌动后,剪取‘35’和‘彩铃红’扦插苗的茎尖、茎节及根尖作为侧芽萌动后内源激素含量测定材料。扦插时同时剪取‘35’和‘彩铃红’插穗的顶芽与相同部位枝节作为侧芽萌动前测定内源激素含量的材料。取材后,迅速将材料投于液氮中速冻并保存。样品材料编号见表1。

表1 样品材料编号
采用高效液相色谱-质谱联用技术(HPLC-ESI/MSn)测定样品材料内源激素IAA、CTK、ABA含量。质谱分析在全扫描模式下进行,MS-MS数据利用软件Xcalibur 2.1(Thermo-Finnigan)进行分析。所有测定均在北京林业大学生物科学与技术学院分子生物实验室完成。
2 结果与分析
2.1 ‘彩铃红’和品系‘35’不同生长发育时期不同组织部位生长素含量分析
侧芽萌动前后,‘彩铃红’和品系‘35’茎尖、茎节和根尖生长素含量如表2所示。
由表2可知,侧芽萌动前,‘彩铃红’茎尖生长素含量是3.954ng/gFW,35生长素含量为29.838ng/gFW,前者仅为后者的13.2%;在茎节中,‘彩铃红’生长素含量为23.473ng/gFW,‘35’生长素含量是32.259ng/gFW,前者是后者的72.5%。在侧芽萌发前,无论是茎尖还是茎节,‘彩铃红’生长素含量都比‘35’低。
侧芽萌动后,‘彩铃红’茎尖中生长素含量是31.002ng/gFW,‘35’是16.599ng/gFW,前者是后者的186.8%;在已萌侧芽的茎节处,‘彩铃红’生长素含量是10.255ng/gFW,‘35’生长素含量是7.315ng/gFW,前者是后者140.2%;‘彩铃红’根尖中生长素含量是9.167ng/gFW,‘35’是29.039ng/gFW,前者是后者的31.6%。
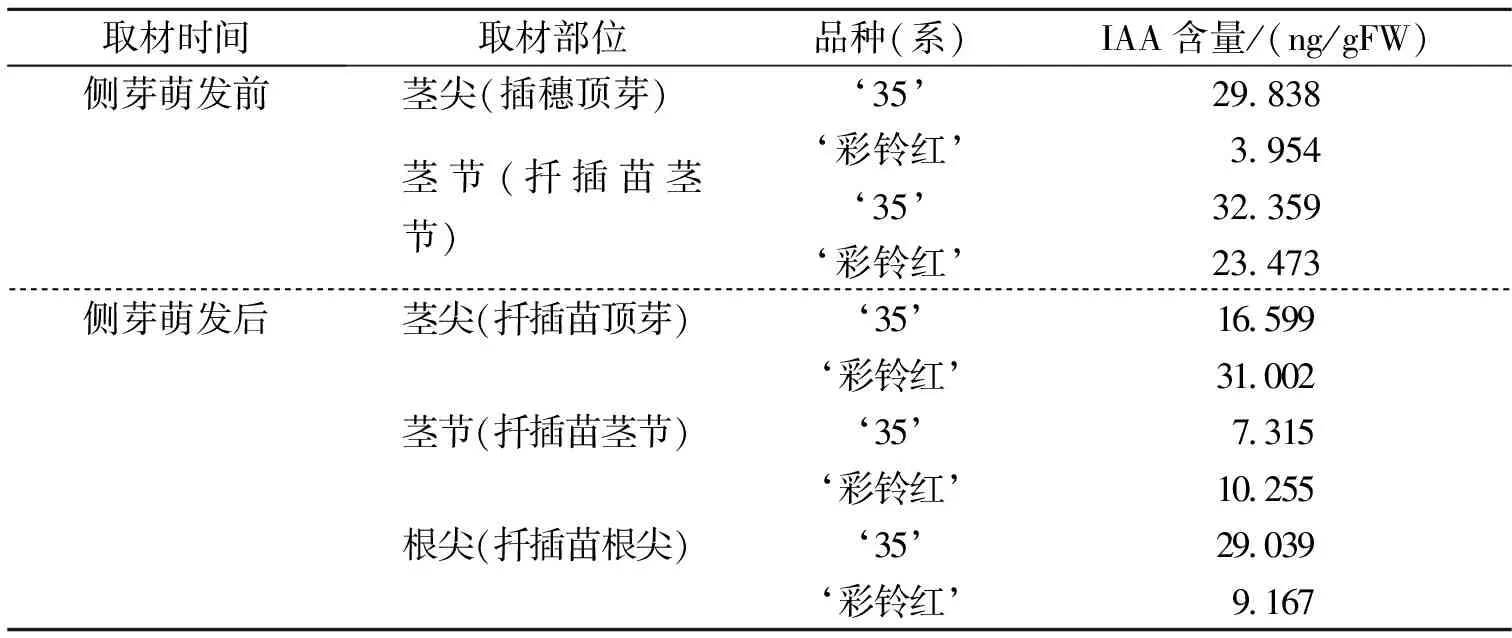
表2 侧芽萌动前后‘彩铃红’与‘35’不同组织的生长素含量
2.2 ‘彩铃红’和品系‘35’不同生长发育时期不同组织部位细胞分裂素含量
细胞分裂素对植物生长发育有十分重要的作用,它促进细胞分裂,参与分生组织的维持,可直接促进侧芽的发生[9]。Z(玉米素)和ZR(玉米素核苷)是本质上具有生物活性的细胞分裂素。而iP(N6-(△2-异戊烯基)腺嘌呤)分解代谢后,可以产生Z[10]。对不同生长发育时期‘彩铃红’和‘35’植株的这3种物质含量进行测定,测定结果见表3。

表3 侧芽萌动前后‘彩铃红’与‘35’不同组织细胞分裂素含量 ng/gFW
由表3可以看出,在侧芽萌动前,除Z外,‘彩铃红’茎节中iP与ZR的含量均高于‘35’,分别为8.1387ng/gFW和0.8370ng/gFW。虽然‘彩铃红’中Z的含量低于‘35’,仅为0.0776ng/gFW,但是,由于Z是由iP分解代谢后所得,因此总体来看,在侧芽未萌动前,‘彩铃红’茎节内细胞分裂素活性成分的含量要高于‘35’,利于其侧芽的萌动及伸长生长。‘彩铃红’茎尖中Z、iP含量低于‘35’,ZR含量高于‘35’,CTK总量略低于‘35’。在侧芽萌动后,‘彩铃红’植株茎节中细胞分裂素含量(Z、ZR、iP总量)低于‘35’,分别为0.0998ng/gFW、1.471ng/gFW,但其茎尖和根尖中3种细胞分裂素总含量高于‘35’,特别是根尖中,‘彩铃红’3种细胞分裂素总含量为4.5058ng/gFW,而35为0.0597ng/gFW,前者远远高于后者。
2.3 ‘彩铃红’和品系‘35’不同生长发育时期不同组织部位脱落酸含量分析
表4为 ‘彩铃红’及‘35’侧芽萌动前后不同组织部位内脱落酸的含量。
由表4可知,在侧芽萌发前,‘彩铃红’茎尖组织中ABA含量是69.423ng/gFW,‘35’中的含量是176.974ng/gFW,前者是后者的39.2%;在茎节中,‘彩铃红’植株中ABA含量是18.045ng/gFW,‘35’中的含量是43.886ng/gFW,前者是后者的41.1%。侧芽萌发后,‘彩铃红’茎尖组织中ABA含量是175.393ng/gFW,‘35’中的含量是41.085ng/gFW,前者是后者的39.2%;在茎节中,‘彩铃红’植株中ABA含量是58.589ng/gFW,‘35’中的含量是1152.377ng/gFW,前者是后者的5.1%;在根尖中,‘彩铃红’植株中ABA含量是149.111ng/gFW,‘35’中的含量是32.452ng/gFW,前者是后者的459.5%。侧芽萌发前,‘彩铃红’茎尖和茎节中ABA含量低于‘35’;侧芽萌发后,‘彩铃红’茎尖和根尖中ABA含量高于‘35’,茎节中ABA含量远低于‘35’。
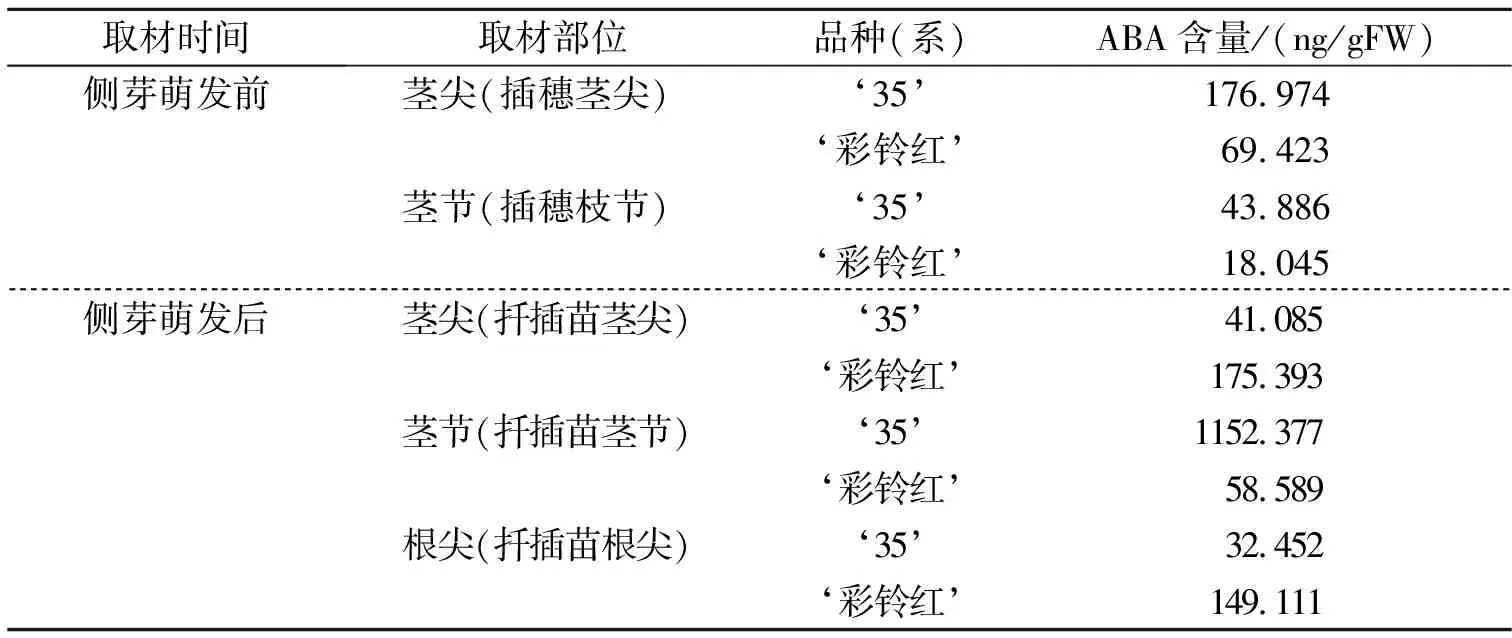
表4 侧芽萌动前后‘彩铃红’与‘35’不同组织脱落酸含量
2.4 不同生长发育时期‘彩铃红’及‘35’侧芽萌动前后茎节内生长素与细胞分裂素的比值
研究发现,生长素并不能起始细胞的增殖,同时细胞的增殖并不能引起器官的发生,生长素与细胞分裂素的比例以及与其他因素之间的互作共同调控这一过程[11]。由此可见,生长素与细胞分裂素的比值对植株侧芽生长起重要的作用。
表5为‘彩铃红’及‘35’侧芽萌动前后茎节内生长素与细胞分裂素的比值。由表5可以看出,在侧芽萌动前,‘彩铃红’茎节内IAA/Z的比值高于‘35’,但IAA/iP与IAA/ZR的比值均低于‘35’,特别是‘彩铃红’IAA/iP比值远远低于‘35’。在侧芽萌动后,‘彩铃红’茎节内IAA/CTK比值上升,IAA/Z由302.630上升到3536.153,IAA/ZR由28.044上升到138.766,IAA/iP由2.884上升到445.863,;而‘35’仅IAA/Z升高,IAA/iP和IAA/ZR反而下降,且3项比值均低于‘彩铃红’。

表5 ‘彩铃红’及‘35’侧芽萌动前后茎节内生长素与细胞分裂素的比值
3 讨论
生长素影响植物顶端优势。不同器官对生长素浓度有不同的要求,芽生长的最适浓度远远低于茎生长的最适浓度,于是当茎顶端产生的高浓度生长素极性运输到侧芽时,则抑制其生长。本试验中,侧芽萌动前,‘彩铃红’茎尖和茎节生长素含量均比‘35’低。生长素主要由茎尖和嫩叶合成,然后沿主茎极性向下运输。侧芽萌动前,‘35’植株顶芽内合成大量的生长素并向下运输,不断积累于其作用部位,即茎节处,以抑制侧芽的生长。而‘彩铃红’植株在侧芽萌动前顶芽所合成的生长素量较少,因此向下运输并作用于侧芽部位的生长素含量较‘35’少,有利于其侧芽的萌动。
细胞分裂素主要是在根尖合成的,并向地上部分运输,因此本试验在侧芽萌动后,不仅检测了茎节中细胞分裂素的含量,而且还检测了根尖中细胞分裂素的含量。有研究表明,细胞分裂素的合成是受生长素调控的,它可以进入侧芽,促进侧芽的生长[7]。同时,生长素还可以影响细胞分裂素的运输方向及其在植物体中的分布,比如抑制细胞分裂素进入侧芽[12-13]。在‘彩铃红’植株的根尖内,细胞分裂素活动相对旺盛,合成量比‘35’高。但是由于在侧芽萌动后,‘彩铃红’的茎节处生长素的含量相对较高,抑制了细胞分裂素向侧芽处的运输。
Christne等[14]研究发现生长素与细胞分裂素的比值与侧芽的早期发育及生长有关,生长素与细胞分裂素的比值高,则侧芽生长的慢,相反则侧芽生长的快。本试验对‘彩铃红’及‘35’茎节内生长素与细胞分裂素的比值分析显示,在侧芽萌动前,‘彩铃红’茎节内生长素与细胞分裂素的比值总体低于‘35’。
虽然目前普遍认为侧芽的形成与发育是生长素与细胞分裂素相互作用的结果,但也有研究显示,其他激素也参与了侧芽的萌发与侧枝的生长。Pei[15]在对eral突变体的研究中发现,植株去顶前外施生长素可以增加脱落酸的含量,去顶后植株中脱落酸含量降低,可以促进侧芽的形成,说明脱落酸对侧枝的形成起抑制作用。也有报道[14]认为脱落酸与芽的休眠相关,且脱落酸的浓度与侧芽萌发的早期没有直接关系,但是在侧芽生长的晚期,当生长素与细胞分裂素的浓度不再影响侧枝发育时,脱落酸对侧枝的生长起负调控作用。本试验对‘彩铃红’及其野生型茎节内脱落酸的含量测定结果表明,在侧芽萌发后,‘彩铃红’茎节内脱落酸含量远低于‘35’茎节内脱落酸含量。
植物分枝发育受环境因素、遗传因素和植物激素多重调控[7]。本试验从生理学方面对一串红‘彩铃红’与其野生型‘35’的内源激素测定。一串红‘彩铃红’未萌茎节内生长素含量较低,而细胞分裂素含量相对较高,可能导致其侧芽不断萌动并形成侧枝。在不同发育时期不同组织部位中‘彩铃红’和‘35’激素含量存在较大差异。‘彩铃红’株型形成应该是多种激素共同调控的结果。此外,目前报道独角金内酯(strigolactones,SL)是发现的第三类植物激素,其与植物分枝相关[16]。一串红中是否存在独角金内酯及其类似物,它们是否参与调控‘彩铃红’分枝,以及‘彩铃红’和‘35’内源激素(生长素、细胞分裂素、脱落酸)含量差异是否导致‘彩铃红’株型形成,有待进一步研究。
致谢:感谢北京林业大学蒋湘宁教授和北京农学院花宝光教授在本研究中给予的指导与帮助。
[1]刘颖慧,袁进成,抗艳红.激素调控植物顶端优势的分子生物学进展[J].中国农学通报,2005,21(3) :86-89,178.
[2]夏玉凤,夏桂雪,汪翠琴,等.生长素与植物顶端优势[J].河北师范大学学报(自然科学版),2008,32(4) :523-525.
[3]Sorefan K,Booker J,Haurogne K,et al.MAX4 and RMS1 are orthologous dioxygenase-like genes that regulate shoot branching inArabidopsisand pea[J].Genes and Development,2007,17:1469-1474.
[4]Schwartz S H,Qin X,Loewen M.The biochemical characterization of two carotenoid cleavage enzymes fromArabidopsisindicatesthat a carotenoid derived compound inhibits lateral branching[J].Journal of Biological Chemistry,2004,279:46940-46945.
[5]Foo E,Bullier E,Goussotm,et al.The branching gene RAMOSUS1 mediates interactions among two novel signals and auxin in pea[J].Plant Cell,2005,17:464-474.
[6]Snowden K,Simkina A,Janssen B,et al.The decreased apical dominance/petunia hybrida carotenoid cleavage dioxygenase 8 gene affects branch production and plays a role in leafsenescence root growth and flower development[J].Plant Cell,2005,17:746-759.
[7]Mcsteen P,Leyser O.Shoot branching[J].Annual Review of Plant Biology,2005,56:353-374
[8]Schmitz G,Theres K.Shoot and inflorescence branching[J].Current Opinion in Plant Biology,2005,8:506-511.
[9]Wckson M,Thimann K V.The antagonism of auxin and kinetin in apical dominance[J].Physiol Plant,1958,11:62-74.
[10]布坎南B B,格鲁伊森姆W,琼斯R L(瞿礼佳,顾红雅,白书农等译校).植物生物化学与分子生物学[M].北京:科学出版社,2004:711-720.
[11]李亚栋,张 芊,孙学辉,等.植物分枝发育的调控机制[J].中国农业科技导报,2009,11(4) :1-9.
[12]Harrison M A,Kaufman P B.The role of hormone transport and metabolism in apical dominance in oats[J].Bot Gaz,1984,145:293.
[13]Phillips I D J.Apical dominance[J].Annual Review of Plant Biology,1975,26:341.
[14]Christne A,Beveridge G,James L Weller,et al.Axillary meristom development budding relationships between networks controlling flowering branching and photoperiod responsiveness[J].Plant Physiol,2003,131:927-934.
[15]Pei Z,Ghassemian M,Kwak C M,et al.Bi-directional inflorescence development inArabidopsisthaliana:Acropetal initiation of flowers and basipetal initiation of paraclades[J].Science,1998,282:287-290.
[16]刘拥海,俞 乐,丁君辉,等.植物激素对分枝发育的协同调控作用研究进展[J].植物生理学报,2012,48 (10):941-948.
2013-05-20
国家自然科学基金项目(31100509);北京市教育委员会科技计划项目(KM201210020005);北京农学院科研质量提高经费项目(PXM2012_014207_000010)。
陈洪伟(1979-),女,博士,讲师,主要从事园林植物育种与改良研究。
[作者简介]刘克锋,E-mail:liukefeng006@163.com。
S681.4;Q946.885
A
1673-1409(2013)17-0015-05

