微波辅助水提梓树根皮中抑菌成分的研究
邵金华,黄国文,刘 恭
湖南科技学院生化系,湖南永州 425100
梓树皮为紫葳科梓属乔木植物梓树(Catalpa ovata G.Don)的皮,又名梓白皮、梓皮、梓木白皮、梓根白皮、土杜促,可入药,据《本草纲目》记载,具有清热、解毒、杀三虫和利尿的功能[1,2]。梓属植物中主要的化学成分有环烯醚萜类成分[3-5]、萘醌类成分[6,7]、苯酚类化合物[8]及一种新的苯乙烯双糖苷类[9]化合物。目前,国内外对梓树在医药临床方面的研究报告很多[10],而对其在抗菌作用及抗菌成分方面的报道却很少。梓树的研究主要集中在梓树幼苗的培育,梓树果实,梓树花药及梓树叶有效成分的研究上[11],而对其根皮在抗菌作用及抗菌成分方面报道较少。本实验以梓树根皮为实验材料对其抗菌活性进行了系统研究,并对其结果进行整理。旨在为植物抗菌化合物的开发利用提供一个新的资源,同时也为梓属植物资源的开发利用提供一个新思路,对于日益严峻的药品安全问题多劈一条路。
1 材料、试剂及仪器
1.1 材料
梓树根皮(采自湖南省永州市祁阳县)
枯草芽孢杆菌(Bacillus subtilis)(来自学校微生物实验室)
1.2 试剂
牛肉膏(生化试剂)、蛋白胨(生化试剂)、氯化钠(分析纯)、氢氧化钠(分析纯)、琼脂(生化试剂)、70%乙醇(分析纯)等。
1.3 仪器
XH-MC-1实验室微波合成仪(北京祥鹄科技发展有限公司)、01J2003-04型立式压力蒸汽灭菌器筒(上海博迅实业有限公司)、DZF-6051型真空干燥箱(上海贺德实验设备有限公司)、SW-CJ-2F洁净工作台(苏州安泰空汽技术有限公司)、HWS智能型恒温恒湿培养箱(宁波市科技园区新江南仪器有限公司)等。
2 实验方法
2.1 原料处理
将梓树皮用毛刷刷洗干净,用剪刀将其剪碎,然后放入烘箱中在65℃条件下将其烘干,用植物粉碎机将其粉碎,最后过40目筛(一定要把绒毛刷干净)。
2.2 供试菌株和菌悬液的制备
将枯草芽孢杆菌首先活化,然后转接入制备好的试管斜面上,于37℃恒温培养箱内培养24 h。用接种环挑取一环菌体放入装有10 mL无菌水的锥形瓶中,充分摇匀,制成菌悬液,备用。用1 mL无菌吸管吸取1 mL已充分混匀的枯草芽孢杆菌菌悬液,精确地放0.5 mL至10-1的试管中,此即为10倍稀释。将多余的菌液放回原菌液中。另取一支1 mL吸管插入10-1试管中来回吹吸菌悬液三次,进一步将菌体分散、混匀,用此吸管吸取10-1菌液1 mL,精确地放0.5 mL至10-2试管中,此即为100倍稀释。其余依次类推。在每个倒入培养基的平板中分别加入200 uL已制备好的10-5枯草芽孢杆菌菌悬液,用涂布棒将其均匀涂抹在培养基的平板上,放置一段时间后备用。
2.3 抑菌活性的测定方法
用打孔机将滤纸圆片打成4 mm的圆片,在烘箱中经高压灭菌后,将其放在提取溶液中和空白对照的水中浸泡30 min,沥去多余的试液,将滤纸片用无菌镊子夹取,放入涂好菌液的培养基平板上。每皿成“+”形对称放置4张圆片,平行做三组,剩余一组为对照组。置于37℃恒温培养箱内培养24 h。培养结束后,用游标卡尺测量培养基中抑菌圈的直径(除去滤纸片的直径)。
2.4 单因素试验
用电子天平精确称取梓树皮2 g,若干份,分别在不同微波功率、料液比、微波提取时间、微波提取温度条件下提取,收集滤液,过滤。用干热灭菌过的滤纸片蘸取提取液和空白液,沥干后将其放入涂有枯草芽孢杆菌的培养基平板上,在培养箱中37℃下培养48 h后,测定抑菌圈的大小,以抑菌圈的直径大小为指标来研究该因素对抑菌化合物提取的影响。
2.5 正交实验
根据单因素实验的结果,以等量的提取剂(水)为空白对照,以微波功率、料液比、微波提取时间、温度为因素进行L9(34)正交实验,根据正交实验结果确定最佳工艺。
3 结果与分析
3.1 单因素实验
3.1.1 微波功率对抑菌化合物的影响
在提取时间为9 min、料液比为1∶20、温度为50℃时,微波功率对抑菌化合物提取的影响如图1所示。从图1可以看出:微波功率在100~300 W之间,随着功率的增加,抑菌圈的直径明显增大,而微波在300~500 W之间,抑菌圈直径的大小随着功率的增大反而减小。可见并不是微波功率越高对抑菌化合物的提取越好,由此可得微波功率在300 W时,对梓树皮中抑菌化合物的提取最好.
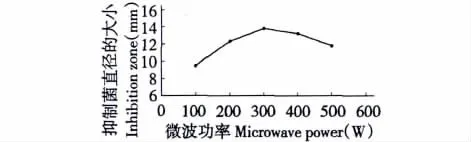
图1 微波功率对抑菌化合物提取的影响Fig.1 The effect of microwave power on extraction of antibacterial compounds
3.1.2 料液比对抑菌化合物提取的影响
在提取时间为9 min、微波功率为300 W、温度为50℃时,料液比对抑菌化合物提取的影响如图2所示。从图2可以看出,料液比在1∶10~1∶15之间,随着料液比的增大,抑菌圈的直径增大,而在1∶15~1∶30之间,抑菌圈直径的大小随着料液比的增大反而明显减小。一般来说,料液比越大,即溶剂用量越大,抑菌化合物得率也随之增大,试验结果显示当溶剂用量达到一定值后,得率降低,此时提取物质已基本提取完全。且过大的料液比会造成溶剂和能源的浪费,因此从降低成本等综合考虑,单因素试验确定料液比为1∶15(g/mL)比较合理。
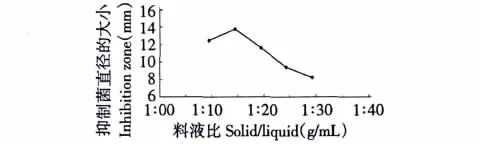
图2 料液比对抑菌化合物提取的影响Fig.2 The effect of extraction time on extraction of antibacterial compounds
3.1.3 提取时间对抑菌化合物提取的影响
在料液比为1∶15、微波功率为300 W、温度为50℃时,提取时间对抑菌化合物提取的影响如图3所示。从图3可以看出,随着微波时间的增加,抑菌化合物抑菌圈显著提高.微波时间为9 min时得率达到最大,随后抑菌化合物抑菌圈不断下降(图3)。因此.最佳微波处理时间为9 min.原因可能是由于被微波辐射极性分子在电磁场中快速转向,产生相互摩擦,引起胞内温度迅速升高,快速高温使内部压力超过细胞空间膨胀能力,导致细胞内细胞器被破坏,加快促进抑菌化合物的扩散和渗透.但微波的强热效应长时问作用后,导致抑菌化合物发生分解。
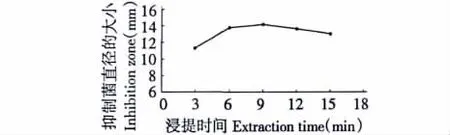
图3 提取时间对抑菌化合物提取的影响Fig.3 The effect of extraction time on extraction of antibacterial compounds
3.1.4 温度对抑菌化合物提取的影响
在料液比为1∶15、微波功率为300 W、提取时间为9 min时,温度对抑菌化合物提取的影响如图4所示。从图4可以看出,温度在30~40℃之间,随着温度的升高,抑菌圈的直径增大,继续升高温度,抑菌圈直径的大小随着提取温度的升高反而减小。因为,温度的升高,降低了提取液的黏度,增大了扩散系数,增大抑菌化合物溶解度,提高了提取率。温度为40℃时抑菌化合物抑菌圈达到最大,继续升高温度,提取率反而下降。

图4 浸提温度对抑菌化合物提取的影响Fig.4 The effect of temperature on extraction of antibacterial compounds
3.2 正交实验
在单因素试验基础上,对微波功率、微波萃取时间、提取温度和料液比4个因素进行了L9(34)正交试验,每个试验做3次重复。其因素水平见表1,正交试验结果见表2,方差分析见表3。

表1 因素水平表Table 1 Factors and levels
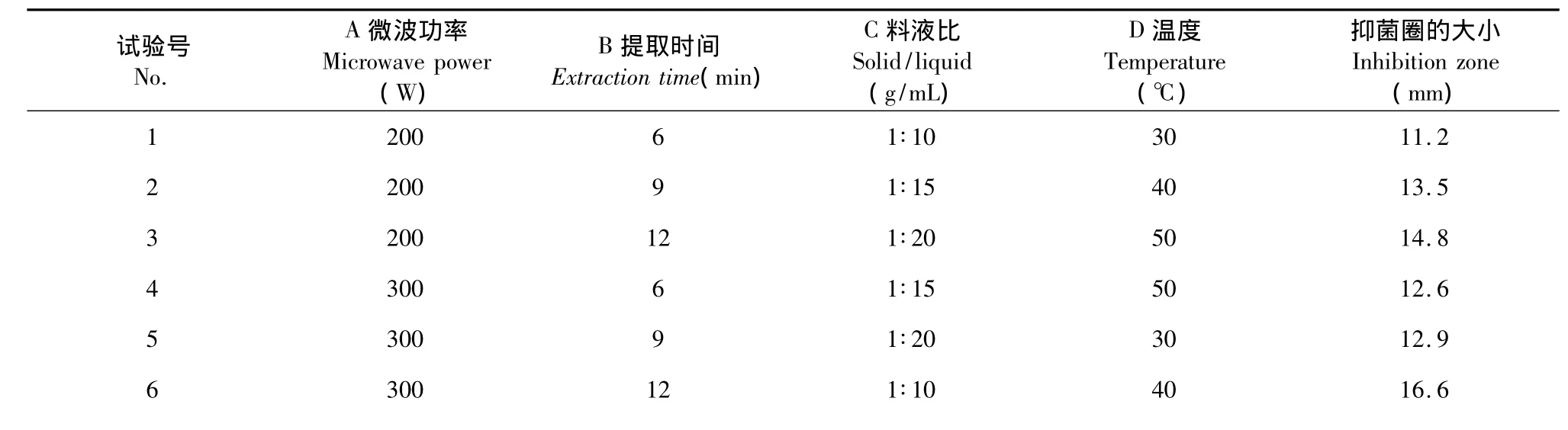
表2 L9(34)正交试验Table 2 Orthogonal test L9(34)
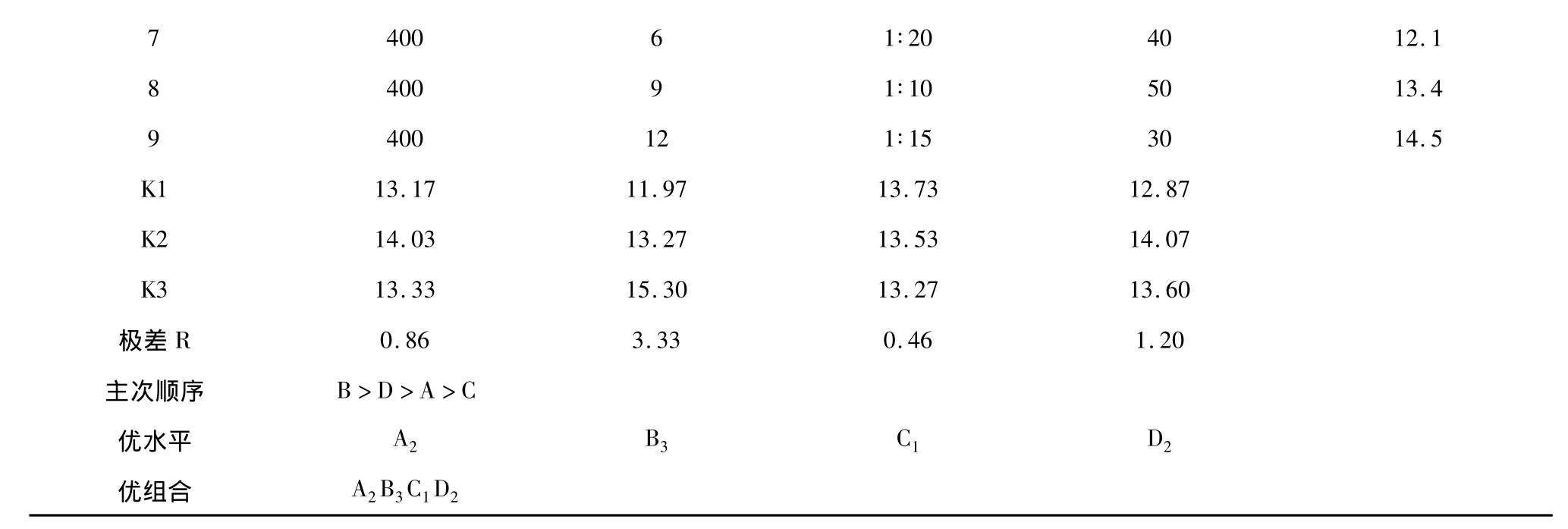
7 400 6 1∶20 40 12.1 8 400 9 1∶10 50 13.4 9 400 12 1∶15 30 14.5 K1 13.17 11.97 13.73 12.87 K2 14.03 13.27 13.53 14.07 K3 13.33 15.30 13.27 13.60极差R 0.86 3.33 0.46 1.20主次顺序 B>D>A>C优水平 A2 B3 C1 D2优组合 A2B3C1D2

表3 方差分析Table 3 Analysis of variance
由表2中的极差分析可知,影响梓树皮中抑菌化合物提取主次顺序为:B>D>A>C,最优组合为:A2B3C1D2,即微波萃取时间>提取温度>微波功率>料液比。此顺序同方差分析的结果一致(见表3)。从方差分析的结果可以看出,微波提取时间对抑菌化合物提取有及极显著的影响,提取温度对抑菌化合物的提取有显著影响,料液比和微波功率对抑菌化合物的提取影响不显著。由此得出,提取梓树皮中抑菌化合物的最佳工艺条件为:微波功率300 W,提取时间12 min,料液比1∶10,温度40℃。由于正交表中没有此组合,因此采用此提取条件进行验证试验。
3.3 最佳条件的验证试验
按照上述最佳工艺条件A2B3C1D2制备三份供试液,进行验证试验。结果测得梓树皮中抑菌化合物的平均抑菌直径为17.22 mm,由此证明该方法稳定可行。
4 结论
微波辅助提取梓树根皮中活性物质的正交试验中,4个影响因素的主次顺序为:微波萃取时间>提取温度>微波功率>料液比。
通过正交试验得到最佳的提取工艺条件为:微波功率300 W,提取时间12 min,料液比1∶10,温度40℃;采用此条件试验,抑菌化合物的抑菌直径可达17.22 mm。
微波辅助提取法具有简单、省时、产率高的优点,为梓树根皮的深入开发利用提供了新的技术途径。
1 Chinese Academy of Sciences,Flora of China Editorial Committee.69th Flora of China.Beijing:Science Press,1997.
2 Wang QZ,Liang JY.Azusa real benzo bark furans.Herbs,2005,36(2):164-166.
3 Kimura K,Okuda T,T kano T.Studies on the constituents of Catalpa ovata G.Don.Iactive principles of fruits.Yao Xue Za Zhi(药学杂志,日),1962,83:635-638.
4 Kauai E,Machida K,Kikuchi M.Studies on the constituents of Catalpa species I Iridoids from Catalpae fiuctus.Chem Pharm Bull,1996,44:1607-1609.
5 Wang QZ,Liang JY.Zi chemical constituents.Herbal medicine,2003,34(7):2-4.
6 V-Ortiz de Urbina A,Martin ML,Fenrandez B.In vitro antispasmodic activity of peracetylated penstemonoside,aucubin and catalpol.Planta Med,1994,60:512-515.
7 Fujiwara A,Toshiyuki Mori,Akira Iida.Antitumor-promoting naphthoquinones from Catalpa ovata.J Nat Prod,1998,61:629-632.
8 Inouye H,Ueda S,moue K.(2R)-Catalponone,a biosynthetic intermediate for prenyl naphthoquinone congeners of the wood of Catalpa ovata.Phytochemistry,1981,20:1707-1710.
9 Li C.Excerpt phenolic compounds in Azusa leaves.International J Chin Med Volumes,2002,24:358-359.
10 Nozaka T,Watanabe F,Ishino M.A mutagenic new iridoid in the water extract of Catalpae fructus.Chem Pharm Bull,1989,37:2838-2840.
11 Seter WN,Setzer MC.Plant-derived triterpenoids as potential antineoplastic agents.Mini Rev Med Chem,2003,3:540-556.

