人脐带间充质干细胞向Raji细胞迁移并促进其增殖的研究
赖 菁, 刘革修, 祝爱珍, 陈盛亭△
(暨南大学 1第一临床医学院, 2医学院血液病研究所, 广东 广州 510632)
人脐带间充质干细胞向Raji细胞迁移并促进其增殖的研究
赖 菁1, 刘革修2, 祝爱珍1, 陈盛亭1△
(暨南大学1第一临床医学院,2医学院血液病研究所, 广东 广州 510632)
目的体外研究人Burkitt淋巴瘤细胞系Raji细胞和人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,hUC-MSC)间的相互作用,探讨MSC在恶性肿瘤治疗中的潜在应用前景。方法将Raji细胞和hUC-MSC进行直接接触和非接触共培养,观察MSC对Raji细胞的作用,采用CCK-8法观察Raji细胞的增殖情况,流式细胞术检测Raji细胞周期的变化,同时应用siRNA干扰技术分析血管内皮生长因子(VEGF)在MSC向Raji细胞迁移过程中的作用(即用siRNA阻断Raji细胞VEGF的表达),ELISA法检测Raji细胞培养上清VEGF的分泌量,qRT-PCR法检测Raji细胞VEGF mRNA表达的变化。结果MSC及其条件培养基(MSC-conditioned medium,MSC-CM)均促进Raji细胞的增殖,72 h MSC-CM培养的Raji细胞增殖活性为0.99±0.05,而对照组为0.71±0.07(P<0.01)。无论是直接接触还是条件培养基均促使Raji细胞从G0/G1期向S期的转化,MSC-CM的作用尤其明显,S期的细胞数目由16.33±1.37增加到28.50±1.41,而G0/G1期细胞数目则由77.70±1.57下降到54.40±1.57(P<0.01)。siRNA干扰Raji细胞后,VEGF无论是在蛋白水平还是mRNA水平都明显下降,且MSC向Raji细胞的趋化能力也显著降低(96.00±5.28vs143.00±7.20,P<0.01)。结论MSC具有向Raji细胞趋化的作用,其机制与Raji细胞分泌VEGF呈正相关;MSC可促进Raji细胞从G0/G1期向S期转化,从而促进Raji细胞的增殖。
人脐带间充质干细胞; Raji细胞; 血管内皮生长因子
近年来关于间充质干细胞(mesenchymal stem cells,MSC)与肿瘤的关系已有不少研究,但仍颇俱争论。一方面,Khakoo等[1]的实验证实,MSC可通过抑制丝氨酸/苏氨酸蛋白激酶(serine/threonine protein kinase,Akt)活性,直接接触抑制卡波西肉瘤细胞的生长而不依赖宿主自身的免疫系统;MSC亦可通过下调抗凋亡因子Bcl-2,并诱导产生凋亡因子caspase-3,促进肿瘤细胞凋亡[2-3]。另一方面,有报道MSC可通过整合素依赖机制与肿瘤细胞直接接触增强肿瘤细胞抗凋亡的能力和耐药性[4-5];也可分泌一系列可溶性细胞因子,如白细胞介素6(interleukin 6,IL-6)、趋化因子配体5(chemokine ligand 5, CCL5)等促进肿瘤的生长和转移[6-7];还可以通过免疫逃逸,参与构建肿瘤基质等方式促进肿瘤的发生发展[8-11]。由于MSC表达一系列的趋化因子受体和黏附分子,如CXCR4、CCR7、E选择蛋白等,使其具有向缺血、炎症病灶及肿瘤定向迁移的能力[12-13],目前也有较多基于MSC的肿瘤趋向性而将其作为基因载体靶向肿瘤细胞的基因治疗研究[14-16]。
淋巴瘤是一类血液系统的恶性肿瘤,其与实体肿瘤既有相似之处,又有其特殊的病理生理特点。目前临床上大部分淋巴瘤属于非霍奇金淋巴瘤,近几年发病率有增加的趋势。而侵袭性和惰性淋巴瘤病人的存活率仍然较低[17]。因此如何加强淋巴瘤尤其是侵袭性非霍奇金淋巴瘤的治疗仍是目前亟待解决的问题。MSC与淋巴瘤细胞的关系目前尚少有报道。本实验中我们以人Burkitt淋巴瘤细胞系Raji细胞和人脐带MSC(human umbilical cord MSC,hUC-MSC)为研究对象,探索淋巴瘤细胞与MSC的关系。
材 料 和 方 法
1细胞株及主要试剂
脐带由暨南大学第一附属医院妇产科提供,均征得产妇及家属的同意。Raji细胞为暨南大学血液病研究所原冻存种子。胶原酶IV、DMEM/F12、RPMI-1640培养基和胎牛血清购自Gibco;CCK-8检测试剂盒购自Dojindo;周期试剂盒由暨南大学检测中心提供;Lipofectamine 2000(Lip-2000)和引物合成均为Invitrogen产品;ELISA试剂盒购自R&D;Transwell小室购自Corning;Giemsa染料购自南京建成生物科技公司;结晶紫染料购自上海碧云天生物科技研究所。
2方法
2.1hUC-MSC的分离和培养 无菌取正常足月产健康婴儿的脐带,PBS洗净残留血液,剥离脐静脉、脐动脉,保留Wharton胶,并剪至约1 mm×1 mm×1 mm大小的组织块,用含0.2%胶原酶IV、1×105U/L青霉素和100 mg/L链霉素的培养基于37 ℃恒温振荡消化4 h。消化后用10倍体积的PBS稀释并过滤,所得滤液离心后用含10%胎牛血清的DMEM/F12完全培养基重悬,以1×106cells/cm2密度接种于T25培养瓶中,3 d后全量换液,待细胞90%融合后0.25%胰酶消化,按1∶2或1∶3的比例传代,P 3细胞进行流式细胞表面标志及成骨成脂诱导分化鉴定[18]。本实验所用脐带MSC均为3~7代。
2.2Raji细胞的培养 人Burkitt淋巴瘤细胞株Raji细胞,用含10%胎牛血清、1×105U/L青霉素和100 mg/L链霉素的RPMI-1640培养基于37 ℃、5%CO2孵箱中培养,每2 d换液传代。所有实验均使用处于对数生长期的Raji细胞,实验组中有MSC条件培养基(conditioned medium,CM),为单层铺满MSC更换新鲜培养基正常培养12 h后0.22 μm过滤所得,对照组Raji细胞也使用DMEM/F12培养基培养。
2.3CCK-8检测MSC对Raji细胞增殖的影响 将Raji以1×104cells/well接种至96孔板,每孔体积200 μL,实验组为与MSC直接培养(MSC∶Raji=1∶10,MSC经丝裂霉素15 mg/L作用3h使其停滞生长)及与其CM培养,同时设无细胞的空白对照组调零,每组5个复孔。为了保证细胞有充足的营养,每24 h换液。分别在24、48、72、96 h加入CCK-8,孵育4 h后全自动酶标仪上检测各孔的吸光度值(测量波长480 nm,参考波长630 nm)。
2.4MSC对Raji细胞周期的影响 Raji细胞分3组:常规培养对照组(normal culture group)、与MSC直接共培养组(direct coculture group)和MSC条件培养基组(conditioned medium group)。以每孔5×105个细胞接种至6孔板,培养48 h后,收集各组细胞,PBS洗2遍,预冷70%乙醇4 ℃固定过夜,PBS洗2遍,离心弃PBS,加入500 μL PI 染液(碘化丙啶及RNase A 终浓度均为50 mg/L),37 ℃避光孵育30 min,流式细胞仪检测进行细胞周期分析。
2.5siRNA干扰技术分析血管内皮生长因子(vascular endothelial growth factor,VEGF)在MSC向Raji细胞迁移中的作用
2.5.1siRNA的转染 VEGF特异siRNA序列参考文献[19],为AUG UGA AUG CAG ACC AAA GAA dTdT和UUC UUU GGU CUG CAU UCA CAU dTdT,由Invitrogen公司合成。将siRNA与Lip-2000用无血清无抗生素1640培养基稀释混合后室温静置20 min,加入接种了Raji细胞的6孔板中, 37 ℃培养6 h,更换新鲜不含抗生素的培养液继续培养至24 h。
2.5.2细胞分4组 VEGF-siRNA处理组(VEGF-siRNA group,Lip-2000 + VEGF siRNA)、阴性错配对照组 (negative group, Lip-2000 + 错配的siRNA)、脂质体对照组 (Lip group,含Lip-2000 + 常规培养的Raji细胞)和正常对照组 (normal group,常规培养的Raji细胞)。
2.6ELISA法检测Raji细胞培养上清VEGF 采用R&D 公司Quantikine Human VEGF ELISA 试剂盒检测。24 h后将以上各组Raji细胞以1 200 r/min 离心5 min收集细胞上清液, 置-80 ℃保存待测。测量前将上清液室温解冻,按照VEGF ELISA 试剂盒操作要求依次加样、孵育、洗涤、酶标仪450 nm 测各组A值,计算VEGF的浓度(ng/L)。
2.7qRT-PCR法检测Raji细胞VEGF mRNA的表达
2.7.1RNA的提取 取上述各组Raji细胞与MSC间接共培养(采用孔径0.4 μm Transwell小室,MSC接种至下室,Raji细胞接种至上室)24 h后,根据RNAiso Plus说明书提取RNA。
2.7.2cDNA合成 根据天根试剂盒说明书,取1~5 μL所提取的总RNA,将其逆转录成cDNA。
2.7.3qRT-PCR 取1 μL稀释10倍的逆转录产物为模板,参照天根Quant SYBR Green PCR 试剂盒进行荧光定量PCR,反应体系20 μL。引物序列参照文献[19],VEGF引物序列反义链5’-CCCTGCCCCCTTCAATATTC-3’,正义链5’-AGGAAAGTGAGGTTACGTGCG-3’;GAPDH引物序列反义链5’-TTCACCACCATGGAGAAGGCT-3’, 正义链5’-ATGGCATGGACTGTGGTCATG-3’。反应条件95 ℃ 2 min;95 ℃15 s; 56 ℃ 15 s; 72 ℃ 30 s。每个样本设3个平行反应,同时扩增 GAPDH为内参照,以 2-ΔΔCt方法计算 VEGF mRNA的相对表达量。
2.8Transwell体外迁移趋化实验 MSC无血清饥饿处理24 h,24孔Transwell小室预先用单纯培养基平衡过夜。上室加入饥饿处理后的1×109/L MSC 无血清悬液100 μL,为了避免血清的干扰,下室Raji细胞均用无血清的培养基重悬。下室分3组:正常Raji组(Raji group)、Raji+siRNA组(Raji-siRNA group)和单纯培养基组(medium group),总体积600 μL,Raji细胞数均为1×105个,每组3个复孔。常规培养24 h后,PBS将小室洗2遍,用棉棒轻轻擦去小室内侧未迁移的细胞,90%乙醇固定30 min, 风干,结晶紫染色15 min后将小室底面朝上,分别取上、下、左、右、中5个视野于正置显微镜下拍照并计数,取其平均值比较各组间迁移至膜背面的细胞数量差别。
3统计学处理
数据以均数±标准差(mean±SD)表示, SPSS 13.0分析数据,多组间采用单因素方差(ANOVA)分析, 组间两两比较采用最小显著差异法(LSD法),时间趋势采用重复测量设计的方差分析,以P<0.05为差异有统计学意义。
结 果
1hUC-MSC细胞的培养及形态特点
原代接种后24 h即可见少量细胞贴壁,呈纺锤形或多角形,细胞生长缓慢,10 d后当细胞亚融合时生长速度显著增快。传代至第3代的hUC-MSC呈长梭形,细胞体积较大,胞质丰富,细胞核及核仁明显,流式细胞术检测其高表达CD44和CD29,不表达造血干细胞标志CD34和CD45,不表达HLA-DR和CD106;经成骨成脂分化诱导,可分化为成骨细胞和脂肪细胞。

Figure 1. Giemsa staining of hUC-MSC (passage 3).
图1第3代hUC-MSC的Giemsa染色
2MSC对Raji细胞生长的促进作用
CCK-8结果显示,随着时间的增加,与MSC直接接触培养及与MSC-CM培养的Raji细胞增殖比对照培养的Raji细胞明显较快。随着培养时间的增加,促Raji细胞增殖作用增加,三者随时间变化的趋势有统计学意义(P<0.05)。与MSC-CM培养72 h尤其明显,细胞增殖活性A值为0.99±0.05,而对照组为0.71±0.07,两者差异显著(P<0.01),见图2。

Figure 2. MSC promote the growth of Raji cells.Mean±SD.n=5.**P<0.01vsRaji cells.
图2MSC促进Raji细胞的生长
3MSC对Raji细胞周期的影响
流式细胞术检测结果显示,培养48 h后,无论是与MSC直接接触培养还是通过MSC-CM培养的Raji细胞,其S期的比例都明显增高(P<0.05),而G0/G1期细胞比例减少(P<0.05),见图3、表1。
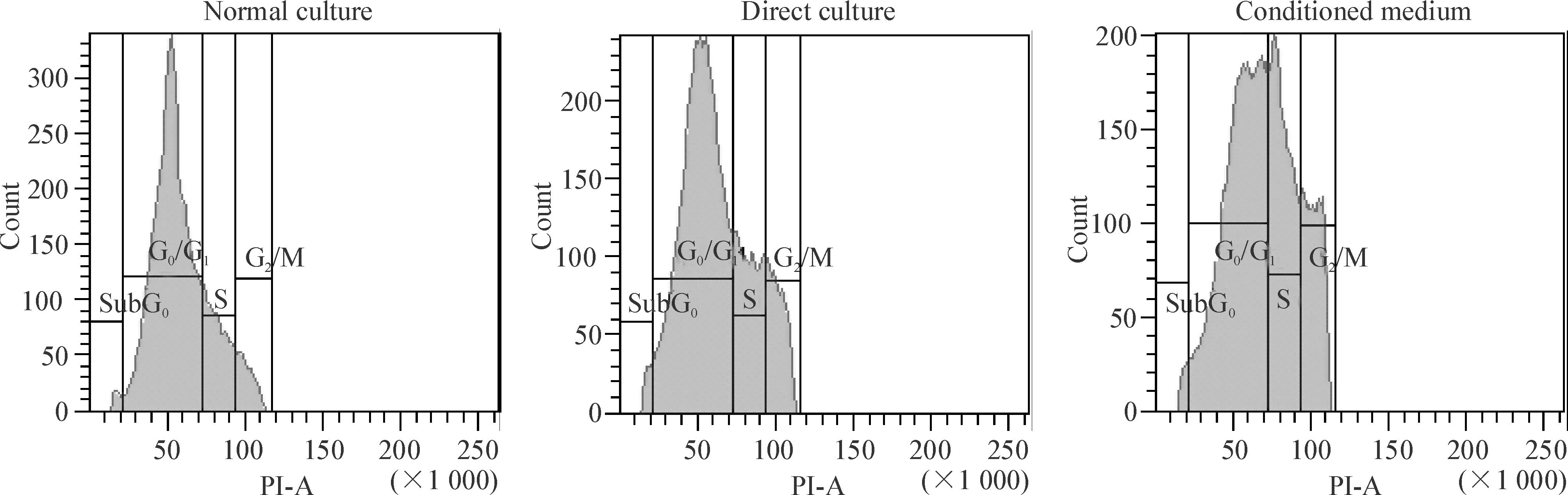
Figure 3. Effect of MSC on the cell cycle of Raji cells detected by flow cytometry.
图3MSC对Raji细胞细胞周期的影响
表1MSC对Raji细胞细胞周期的影响
Table 1. Effect of MSC on the cell cycle of Raji cells (mean±SD.n=3)

GroupG0/G1(%)S(%)G2/M(%)Normalculture77.70±1.5716.33±1.375.97±1.33Directcoculture68.40±1.58*19.47±1.38*12.80±1.29*Conditionedmedium54.40±1.57*28.50±1.41*17.10±1.26*
*P<0.05vsnormal culture group.
4ELISA法检测Raji细胞培养上清VEGF
各组培养24 h时上清的VEGF结果见表2。正常对照组Raji细胞上清VEGF含量为(306.82±53.12)ng/L,脂质体对照组及阴性错配组与其相比无显著差异(P>0.05),因此实验结果可排除脂质体毒性和siRNA的非特异性干扰作用。VEGF -siRNA 转染的Raji细胞组VEGF显著下降至(176.42±29.26)ng/L,差异有统计学意义(P<0.01)。
表2上清VEGF含量
Table 2. The concentration of VEGF in the supernatant(ng/L.Mean±SD.n=3)

GroupVEGFlevelNormal306.82±53.12Lip278.53±42.98Negative280.68±43.47VEGF-siRNA176.42±29.26**
**P<0.01vsnormal group.
5VEGF-siRNA转染后Raji细胞VEGFmRNA表达下调
qRT-PCR的结果显示,VEGF-siRNA 转染后Raji细胞VEGF mRNA表达显著下调,正常对照组Raji细胞VEGF表达水平为7.39±1.32,明显高于VEGF -siRNA处理组的2.11±1.07,差异显著(P<0.05),见表3。

表3 Raji细胞VEGF mRNA的表达水平
*P<0.05vsnormal group.
6VEGF-siRNA转染Raji细胞后对MSC的趋化作用减弱
Transwell细胞培养体系趋化检测结果显示,与单纯培养基组的25.00±4.33相比,正常Raji细胞组MSC的迁移细胞数则显著增多,为143.00±7.20(P<0.01),说明Raji细胞有趋化MSC的能力。而VEGF-siRNA 转染Raji细胞后对MSC的趋化作用则减弱,迁移细胞数为96.00±5.28,与正常Raji细胞组相比差异显著(P<0.05),见图4,说明VEGF参与了Raji细胞对MSC的趋化作用。
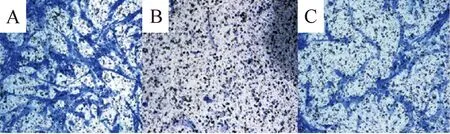
Figure 4. Migration of MSC towards Raji cells in Transwell chambers. A: Raji group; B: medium group; C: Raji-siRNA group.
图4MSC向Raji细胞的迁移
讨 论
有关MSC与恶性肿瘤包括血液系统恶性肿瘤的关系各家报道不一。一些学者认为MSC能够抑制血液恶性肿瘤细胞的生长,Fonseka等[20]研究发现hUC-MSC可通过剂量依赖的方式将K562细胞阻滞在G0/G1期,抑制其生长,且这种抑制作用可能与hUCB-MSC增加IL-6、IL-8、TGF-β1等细胞因子有关。Secchiero等[21]将BM-MSC腹腔内注射入已建立的2个弥漫性淋巴瘤的裸鼠模型体内,发现其显著增加了小鼠的生存率。与之相反,Amé-Thomas等[22]研究报道,来源于骨髓和淋巴器官的人MSC支持B细胞肿瘤细胞的生长。Lwin等[23]报道,骨髓基质细胞可通过上调非霍奇金淋巴瘤细胞NF-κB (RelB/p52)活化相关的抗凋亡蛋白来抑制淋巴瘤细胞的凋亡。
本实验以HUC-MSC和Raji细胞为对象,体外研究显示MSC可通过促进处于G0/G1期Raji细胞向S期的转化,进而促进Raji细胞生长。本实验中,无论是直接接触还是MSC的条件培养基均能增加Raji细胞S期的比例及其增殖活性。这与Malini等的研究结果相反。是否不同来源的MSC及不同肿瘤细胞株造成研究结果的差异,尚待在相同实验条件下用相同实验方法做进一步研究观察。另外,本研究还显示Raji细胞高表达VEGF则MSC向其趋化增强,而抑制VEGF表达则MSC向Raji细胞的趋化显著降低,表明VEGF是促进MSC向Raji细胞趋化的因素之一。VEGF是血管新生正性调控因子,它不仅在许多实体恶性肿瘤中高表达[24],在多种恶性血液病中也高表达[25]。VEGF可促进恶性血液系统肿瘤细胞的增殖和侵袭能力,并增强其抗凋亡能力[26]。
总之,本研究结果显示,在体外Raji细胞具有趋化MSC作用,且MSC可通过促进Raji细胞G0/G1期向S期的转化来促进Raji细胞增殖。在体内Raji细胞与MSC的关系如何,MSC是否依然有向Raji细胞迁移并促进其增殖的作用,MSC对淋巴瘤的潜在临床应用前景如何,这些问题有赖于建立有效的动物模型在体内做进一步的实验观察。
[1] Khakoo AY,Pati S,Anderson SA,et al.Human mesenchymal stem cells exert potent antitumorigenic effects in a model of Kaposi’s sarcoma[J].J Exp Med, 2006,203(5):1235-1247.
[2] Lu YR,Yuan Y,Wang XJ,et al.The growth inhibitory effect of mesenchymal stem cells on tumor cellsinvitroandinvivo[J].Cancer Biol Ther,2008,7(2):245—251.
[3] Sun B,Roh KH,Park JR,et al.Therapeutic potential of mesenchymal stromal cells in a mouse breast cancer metastasis model [J].Cytotherapy,2009,11(3):289-298.
[4] Mudry RE, Fortney JE, York T, et al. Stromal cells regulate survival of B-lineage leukemic cells during chemotherapy [J].Blood,2000,96(5):1926-1932.
[5] Lagneaux L, Delforge A, Bron D, et al. Chronic lymphocytic leukemic B cells but not normal B cells are rescued from apoptosis by contact with normal bone marrow stromal cells [J]. Blood, 1998,91(7):2387-2396.
[6] Sasser AK, Sullivan NJ, Studebaker AW, et al.Interleukin-6 is a potent growth factor for ER-α-positive human breast cancer [J].FASEB J,2007,21(13):3763-3770.
[7] Mi Z, Bhattacharya SD, Kim VM, et al.Osteopontin promotes CCL5-mesenchymal stromal cell-mediated breast cancer metastasis [J]. Carcinogenesis.,2011,32(4):477-487.
[8] Djouad F, Plence P, Bony C, et al. Immunosuppressive effect of mesenchymal stem cells favors tumor growth in allogeneic animals [J]. Blood, 2003,102(10):3837-3844.
[9] Zhu W, Xu W, Jiang R, et al. Mesenchymal stem cells derived from bone marrow favor tumor cell growthinvivo[J]. Exp Mol Pathol,2006, 80(3):267-274.
[10]Mishra PJ, Mishra PJ, Humeniuk R, et al. Carcinoma-associated fibroblast-like differentiation of human mesenchymal stem cells[J]. Cancer Res, 2008,68(11):4331-4339.
[11]Bagley RG, Weber W, Rouleau C, et al. Human mesenchymal stem cells from bone marrow express tumor endothelial and stromal markers [J]. Int J Oncol, 2009,34(3):619-627.
[12]Xu S, Menu E, De Becker A, et al.Bone marrow-derived mesenchymal stromal cells are attracted by multiple myeloma cell-produced chemokine CCL25 and favor myeloma cell growthinvitroandinvivo[J].Stem Cells,2012,30(2):266-279.
[13]Ryu CH, Park SA, Kim SM, et al. Migration of human umbilical cord blood mesenchymal stem cells mediated by stromal cell-derived factor-1/CXCR4 axis via Akt, ERK, and p38 signal transduction pathways [J].Biochem Biophys Res Commun, 2010, 398(1):105-110.
[14]Stoff-Khalili MA, Rivera AA, Mathis JM, et al. Mesenchymal stem cells as a vehicle for targeted delivery of CRAds to lung metastases of breast carcinoma [J]. Breast Cancer Res Treat,2007,105(2):157-167 .
[15]Komarova S, Kawakami Y, Stoff-Khalili MA, et al. Mesenchymal progenitor cells as cellular vehicles for delivery of oncolytic adenoviruses [J]. Mol Cancer Ther, 2006, 5(3):755-766.
[16]Sonabend AM, Ulasov IV, Tyler MA, et al. Mesenchymal stem cells effectively deliver an oncolytic adenovirus to intracranial glioma [J]. Stem Cells, 2008,26(3):831-841.
[17]Flinn IW. Lymphoma therapy: the challenges ahead [J]. Curr Opin Oncol, 2002,14(5):473-474.
[18]许婷婷, 周艳华, 李 军,等. 人脐带间充质干细胞对小鼠自然衰老过程中骨髓脂肪化的影响[J]. 中国病理生理杂志, 2010,26(4):816-818.
[19]Colland F, Formstecher E, Jacq X, et al. Small-molecule inhibitor of USP7/HAUSP ubiquitin protease stabilizes and activates p53 in cells [J].Mol Cancer Ther,2009,8(8):2286-2295.
[20]Fonseka M, Ramasamy R, Tan BC, et al.Human umbilical cord blood-derived mesenchymal stem cells (hUCB-MSC) inhibit the proliferation of K562 (human erythromyeloblastoid leukemic cell line) [J].Cell Biol Int,2012,36(9):793-801.
[21]Secchiero P, Zorzet S, Tripodo C, et al. Human bone marrow mesenchymal stem cells display anti-cancer activity in SCID mice bearing disseminated non-Hodgkin’s lymphoma xenografts [J].PLoS One,2010,5(6):e11140.
[22]Amé-Thomas P, Maby-El Hajjami H, Monvoisin C, et al. Human mesenchymal stem cells isolated from bone marrow and lymphoid organs support tumor B-cell growth: role of stromal cells in follicular lymphoma pathogenesis [J]. Blood,2007,109(2):693-702.
[23]Lwin T, Hazlehurst LA, Li Z, et al.Bone marrow stromal cells prevent apoptosis of lymphoma cells by upregulation of anti-apoptotic proteins associated with activation of NF-κB (RelB/p52) in non-Hodgkin’s lymphoma cells[J]. Leukemia,2007,21(7):1521-1531.
[24]钱朝南,闵华庆. 血管内皮生长因子的研究进展[J]. 中国病理生理杂志,1999,15(9):855-859.
[25]Bellamy WT, Richter L, Frutiger Y, et al . Expression of vascular endothelial growth factor and its receptors in hematopoietic malignancies [J]. Cancer Res, 1999,59(3):728-733.
[26]阮国瑞, 刘艳荣, 陈珊珊,等. 自分泌 VEGF 对人慢性髓性白血病细胞系 K562 的作用[J]. 中国实验血液学杂志, 2001,9(3): 202-206.
HumanumbilicalcordmesenchymalstemcellsmigratetoRajicellsandpromotetheirproliferation
LAI Jing1, LIU Ge-xiu2, ZHU Ai-zhen1, CHEN Sheng-ting1
(1TheFirstClinicalCollege,2InstituteofHematology,SchoolofMedicine,JinanUniversity,Guangzhou510632,China.E-mail:chenshengting@tom.com)
AIM: To investigate the interaction between human Burkitt lymphoma cell line Raji and human umbilical cord mesenchymal stem cells (hUC-MSC).METHODSThe direct and indirect effects of MSC on Raji cells were investigated. The viability of Raji cells was tested by CCK-8 assay, and the cell cycle was determined by flow cytometry. The importance of vascular endothelial growth factor (VEGF) in the migration of MSC to Raji cells was analyzed by blocking VEGF expression in Raji cells with small interfering RNA (siRNA). VEGF level in the supernatant was detected by ELISA, and the mRNA expression of VEGF was measured by quantitative real-time PCR (qRT-PCR).RESULTSBoth MSC and MSC-conditioned medium (MSC-CM) promoted the growth of Raji cells. The viability of Raji cells co-cultured with MSC-CM was 0.99±0.05 at 72 h, and that in control group was 0.71±0.07. Both direct co-culture with MSC and MSC-CM turned the Raji cells from G0/G1phase to S phase. The number of Raji cells co-cultured with MSC-CM in S phase was increased from 16.33±1.37 to 28.50±1.41, and the number in G0/G1phase was decreased from 77.70±1.57 to 54.40±1.57. The expression of VEGF was down-regulated either at mRNA or protein level after transfection with siRNA. The ability of MSC migrated to Raji cells was significantly declined (96.00±5.28vs143.00±7.20).CONCLUSIONRaji cells recruit MSC by secreting VEGF, and MSC promote the proliferation of Raji cells by turning the cells from G0/G1phase to S phase.
Human umbilical cord mesenchymal stem cells; Raji cells; Vascular endothelial growth factors
R363
A
10.3969/j.issn.1000-4718.2013.01.015
1000- 4718(2013)01- 0093- 06
2012- 08- 23
2012- 10- 25
△通讯作者Tel: 020- 38688439; E-mail: chenshengting@tom.com

