全麻/控制性降压手术对海马神经元凋亡的影响*
王改梅, 刘 喆, 沈颖洁, 方剑乔
(浙江中医药大学第三临床医学院,浙江 杭州 310053)
·短篇论著·
全麻/控制性降压手术对海马神经元凋亡的影响*
王改梅, 刘 喆△, 沈颖洁, 方剑乔
(浙江中医药大学第三临床医学院,浙江 杭州 310053)
目的观察全麻/控制性降压手术对海马神经元损伤的影响及其可能的机制。方法选用12只6~8月龄雄性健康比格犬,随机分为全麻组(A组,n=6)和控压组(C组,n=6)。全麻组采用丙泊酚注射及异氟醚吸入麻醉,控压组在麻醉基础上联合硝普钠行控制性降压,达到目的血压(基础平均动脉压的40%)后维持60 min(2组动物均在相应期间行剖腹探查术),术毕使血压回升至基础水平72 h后取脑。采用免疫组织化学法检测海马CA1和CA3区白细胞介素 1β(IL-1β)、肿瘤坏死因子α(TNF-α)以及凋亡相关蛋白(Bcl-2、Bax和活化型caspase-3)的表达;TUNEL法检测海马神经元凋亡情况。结果(1)控压组动物海马CA1和CA3区IL-1β和TNF-α阳性细胞率均较全麻组升高(P<0.01);(2)控压组CA1和CA3区Bcl-2/Bax阳性细胞比值均较全麻组降低(P<0.05);与此相应,控压组海马各区caspase-3阳性细胞率均显著高于全麻组(P<0.01);(3)全麻组与控压组CA1和CA3区存在凋亡细胞,但控压组各区细胞凋亡指数均较全麻组显著升高(P<0.01)。结论全麻/控制性降压下的手术可诱导海马不同区域促炎细胞因子表达,降低Bcl-2/Bax比值,促进caspase-3的表达,进而导致海马神经元的凋亡。这种术后海马神经元损伤可能与全麻/控压手术诱导的海马炎症反应有关。
神经元凋亡; 炎症; 全身麻醉; 控制性降压; 海马
药物控制性降压(controlled hypotension)是目前临床根据手术及病情需要所采取的并广泛应用的一种麻醉方法,目的是减少术中失血和输血,改善术野的环境,缩短手术时间[1]。但单纯药物降压难以维持重要脏器的充分灌注,无法保证其血氧供应而有脏器损伤之虞[2]。脑组织具有代谢率高、缺血缺氧耐受性差等特殊生理及代谢特点,是对缺血缺氧最敏感的器官之一,在控制性降压期间组织灌注压的下降有可能会造成脑血供不足和脑组织缺氧的危险以及升压后的再灌注损伤[2]。本研究用健康比格犬模拟剖腹探查术,观察全麻/控制性降压手术对海马神经元损伤的影响,并探讨海马细胞损伤的可能机制。
材 料 和 方 法
1动物分组与处理
本研究选用12只6~8月龄健康雄性比格犬,体重8~12 kg(购自上海新冈实验动物养殖场)。采用随机法先将实验动物分为2组:单纯全麻组(全麻组,A组)、控制性降压组(控压组,C组)。每组6只。全麻组麻醉前肌注阿托品,静脉注射丙泊酚4 mg/kg进行诱导麻醉,静脉注射肌松药维库溴铵,行气管插管,氧气流量1 L/min, 维持呼吸频率15 min-1,潮气量150~300 mL,继以3%异氟醚吸入维持麻醉;血气监测控制pH值在7.35~7.45范围。控压组以硝普纳静脉输注行控制性降压;维持目的血压为基础平均动脉压(mean arterial pressure,MAP)的40% 60 min,其间(全麻组亦在相应时间内)行剖腹探查术,术毕停止硝普钠输注,调异氟醚浓度至1%,回升血压,恢复自主呼吸后,停止异氟醚吸入,撤除所有监测性插管及输液。
2组织取材
术后72 h 30%水合氯醛腹腔麻醉,将动物经股动脉灌注,取脑置4%多聚甲醛溶液固定,取含海马组织区域行石蜡包埋。
3免疫组织化学(SP法)染色
取组织切片(厚5 μm)常规脱蜡至水。PBS漂洗5 min×3次,0.01 mol/L pH6.0柠檬酸缓冲液抗原修复,高火5 min×3次;0.3%H2O2-80%甲醇溶液室温处理15 min,PBS冲洗5 min×3次;滴加山羊血清封闭,室温1 h,甩去多余液体;滴加Ⅰ抗(Bax 1∶250;Bcl-2 1∶350;活化型caspase-3 1∶200;IL-1β 1∶250;TNF-α 1∶100; 均购自北京博奥森),放入湿盒,37 ℃孵育1 h,移至4 ℃冰箱过夜;次日,置于37 ℃水浴箱复温1 h,PBS冲洗5 min×3次;滴加生物素Ⅱ抗,37 ℃孵育1 h,PBS冲洗5 min×3次;滴加S-A/HRP,37 ℃孵育1 h,PBS冲洗5 min×3次;DAB显色,自来水冲洗,以终止反应;苏木素复染,脱水、透明,封片,光镜观察。选5个视野,计数阳性细胞并计算其阳性比率,取均值。
4TUNEL(Roche)法检测神经元凋亡
石蜡切片常规脱蜡至水,200 mL 0.01 mol/L pH 6.0的柠檬酸缓冲液进行修复,750 W微波修复1 min,PBS漂洗5 min×3次,小牛血清室温封闭30 min;PBS漂洗5 min×3次,加50 μL TdT 酶反应液,加盖玻片37 ℃避光湿润反应60 min;滴加50 μL streptavidin-HRP工作液,加盖玻片湿润避光反应30 min;PBS漂洗5 min×3次,滴加50 μL DAB工作液,室温显色20 s;自来水冲洗,苏木素复染,脱水、透明,封片,光镜观察。选5个视野,计数海马CA1区和CA3区阳性细胞数和细胞总数,计算凋亡指数(apoptotic index,AI),AI(%)=TUNEL阳性细胞数/细胞总数×100%。
5统计学处理
数据以均数±标准差(mean±SD)表示。用SPSS 13.0统计软件分析。数据均进行正态性检验,组间均数比较采用配对样本t检验,以P<0.05为差异有统计学意义。
结 果
1海马CA1和CA3区IL-1β和TNF-α表达情况
海马IL-1β与TNF-α阳性细胞为棕褐色。控压组海马CA1和CA3区IL-1β和TNF-α阳性细胞率均较全麻组显著升高(P<0.01),见图1和表1。
2海马CA1和CA3区Bcl-2和Bax表达情况
海马Bcl-2和Bax阳性细胞为棕褐色。控压组CA1和CA3区Bcl-2/Bax比值均较全麻组降低(P<0.05),见图2和表2。
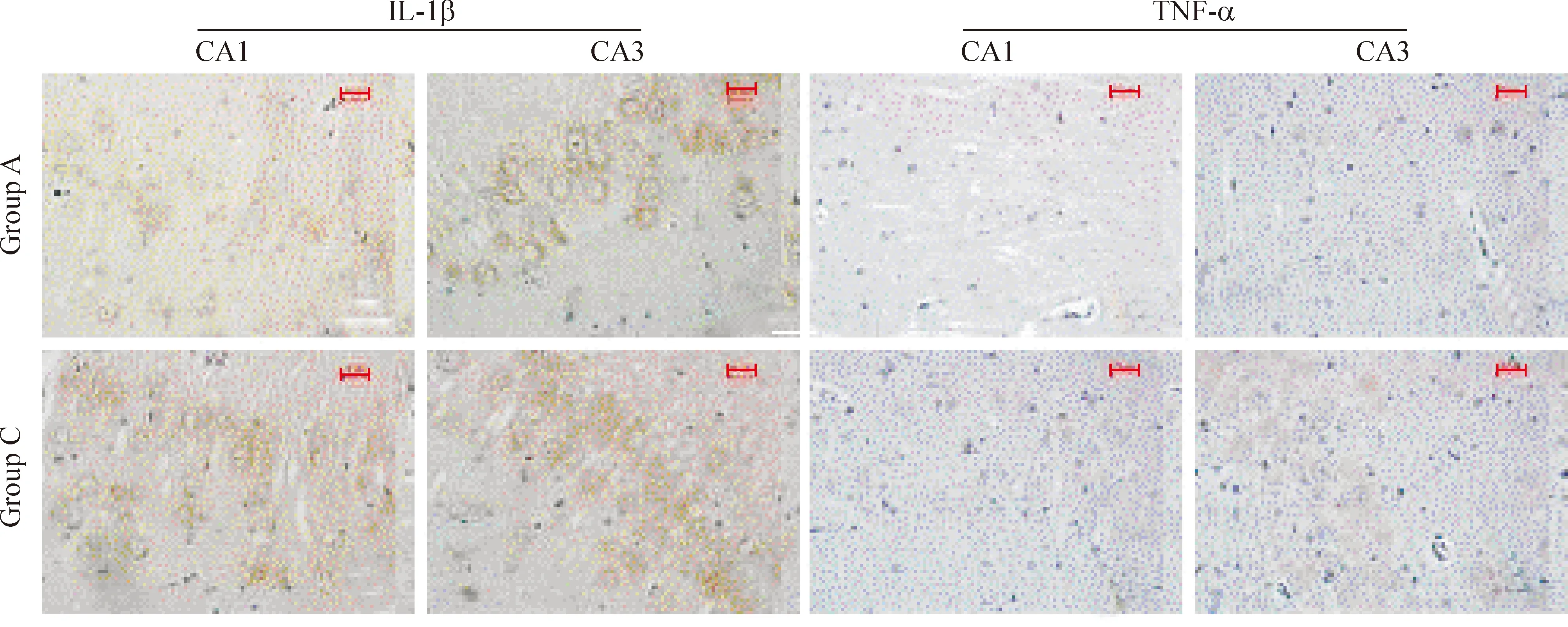
Figure 1. Representative immunohistochemical staining (brown) of IL-1β and TNF-α in hippocampal CA1 and CA3 areas.Group A:general anesthesia group;group C: controlled hypotension group.Bar: 20 μm.
图1海马CA1和CA3区IL-1β与TNF-α免疫组化染色情况
表1海马CA1和CA3区IL-1β和TNF-α阳性细胞率
Table 1. IL-1β and TNF-α positive cell rates in hippocampal CA1 and CA3 areas (%.Mean±SD.n=6)
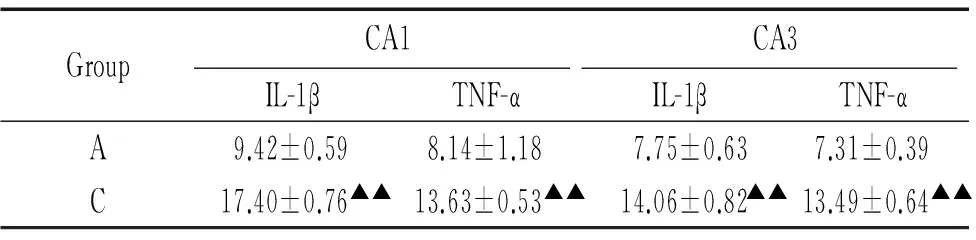
GroupCA1CA3IL-1βTNF-αIL-1βTNF-αA9.42±0.598.14±1.187.75±0.637.31±0.39C17.40±0.76▲▲13.63±0.53▲▲14.06±0.82▲▲13.49±0.64▲▲
Group A:general anesthesia; group C:controlled hypotension.▲▲P<0.01vsgroup A.
3海马CA1区和CA3区活化型caspase-3表达及TUNEL染色情况
海马活化型caspase-3阳性细胞为棕褐色,控压组CA1和CA3区caspase-3阳性细胞率均较全麻组显著升高(P<0.01)。TUNEL阳性表达为细胞核呈棕黄色,CA1区神经元细胞稀疏,阳性细胞散在分布;控压组CA1和CA3区细胞凋亡指数均较全麻组显著升高(P<0.01),见图3和表3。

Figure 2. Representative immunohistochemical staining (brown) of Bax and Bcl-2 in hippocampal CA1 and CA3 areas.Bar: 20 μm.
图2海马CA1和CA3区Bax与Bcl-2免疫组化染色情况
表2海马CA1和CA3区凋亡蛋白Bcl-2/Bax比值
Table 2. Bcl-2/Bax ratio in hippocampal CA1 and CA3 areas (mean±SD.n=6)
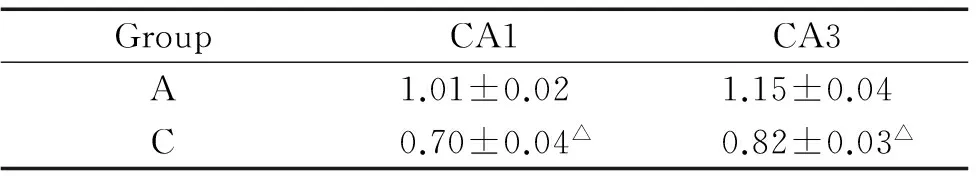
GroupCA1CA3A1.01±0.021.15±0.04C0.70±0.04△0.82±0.03△
△P<0.05vsgroup A.
讨 论
控制性降压是目前广泛应用的临床麻醉方法。患者在麻醉手术期间由于麻醉药物和方法的影响,常可并发心率减慢、血压下降及呼吸抑制,难以保证对重要脏器组织的血流灌注及血氧供应而极易发生组织器官的缺血/缺氧性损伤,加之麻醉药物诱导性降压及手术创口失血更加重了这种风险。在易损器官中,由于大脑结构功能复杂,能量及氧储备低、组织代谢率高,对缺血缺氧十分敏感且耐受性差等特性[3-4],故脑缺血/缺氧成为控制性降压的最大顾虑之一[2]。来自临床和基础实验的研究均证实[5-6],单纯麻醉或手术均可造成中枢神经的损伤并产生术后认知功能障碍、谵妄等并发症。本研究发现麻醉可诱导海马CA1和CA3区神经元发生凋亡,而控制性降压更加重这种损伤,进一步证实了上述认识。
Figure 3. Representative immunohistochemical staining (brown) of cleaved caspase-3 and TUNEL staining of apoptosis in hippocampal CA1 and CA3 areas.Bar: 20 μm.
图3海马CA1和CA3区活化型caspase-3与TUNEL染色情况
表3海马CA1区和CA3区活化型caspase-3阳性细胞率和细胞凋亡指数
Table 3. Cleaved caspase-3 positive cell rate and apoptotic index (AI) in hippocampal CA1 and CA3 areas (%.Mean±SD.n=6)
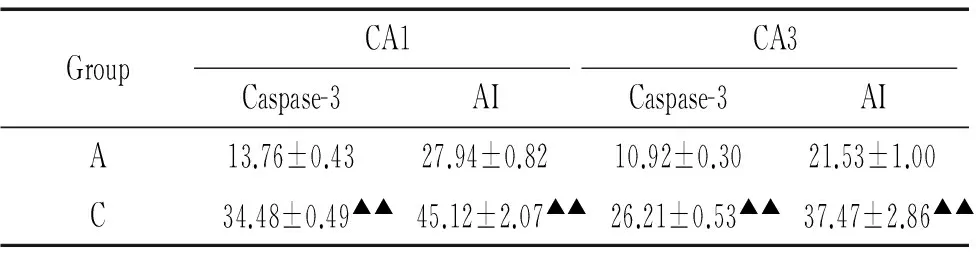
GroupCA1CA3Caspase-3AICaspase-3AIA13.76±0.4327.94±0.8210.92±0.3021.53±1.00C 34.48±0.49▲▲ 45.12±2.07▲▲ 26.21±0.53▲▲ 37.47±2.86▲▲
▲▲P<0.01vsgroup A.
麻醉和控制性降压条件下的手术过程导致的脑缺血/缺氧诱导海马细胞因子表达升高,可能是造成海马神经损伤的诱因。脑缺血等多种伤害性刺激可直接刺激中枢产生过多的促炎细胞因子(正常情况下因其表达极低而难以检测),并在神经损伤初始阶段起着诱导和加剧损伤的关键作用,与神经系统损伤关系最为密切的是IL-1β、TNF-α等促炎细胞因子[7-8]。海马是对缺血/缺氧极为敏感和易损的脑区[3, 9],大量研究证实脑缺血[10]或缺氧/缺血[3]均可诱导相关细胞因子表达的升高而导致海马神经损伤。本研究采用免疫组化染色观察到全麻组动物海马CA1、CA3区均存在IL-1β和TNF-α阳性细胞,而控压组CA1、CA3区阳性细胞数均较全麻组升高(P<0.01)。此外,麻醉剂本身也是诱导其增高的直接原因[11];各类应激是大脑炎症反应的条件[12]并可加重中枢神经系统(central nervous system,CNS)炎症反应[13],诱导海马的易损性[14],围手术期的心理紧张/焦虑、麻醉、手术创伤及疼痛均是强烈或持久的应激原,可导致CNS损伤及术后行为障碍[5]。手术创伤可导致组织局部和循环内促炎细胞因子的异常改变[15],外周感染和炎性反应所刺激的促炎细胞因子均可通过多种途径影响CNS神经元、胶质细胞及血管内皮细胞的活性,诱发中枢炎性反应导致神经损伤[16]。尽管本研究未能进行中枢内外应激激素及循环内促炎细胞因子变化的观测,但不能否认围手术期应激和手术创伤也可能是造成海马炎性损伤的原因。
细胞凋亡是各种伤害性刺激造成CNS神经变性、损伤的主要形式[17]。TUNEL染色是一种被广泛接受的判定细胞凋亡与否的形态学方法,其可直接检测DNA的断裂碎片即所谓的“凋亡小体”和染色质凝集[18]。本研究采用TUNEL染色显示,麻醉组与控压组海马CA1和CA3区均有细胞凋亡出现,且控压组细胞凋亡指数明显高于麻醉组(P<0.01)。Caspase家族拥有14个成员,在中枢损伤的细胞凋亡级联反应中具有重要作用,其中caspase-3是最关键的凋亡执行蛋白酶[19]。本实验观察到,全麻组动物海马CA1和CA3区均有caspase-3阳性细胞表达,控压组相关区域的阳性细胞数均较全麻组升高(P<0.01),表明全麻和控制性降压下手术所致caspase-3表达升高,进而导致神经细胞凋亡。
Bcl-2家族成员多达20余种,其中主要的抗凋亡成员Bcl-2和促凋亡蛋白Bax位于线粒体膜,对线粒体通透性转换孔的开放具有调节作用,调控细胞色素C(cytochrome C,Cyt C)的释放,而释放的Cyt C和凋亡蛋白酶激活因子(apoptotic protease-activating factor,Apaf)结合,引起caspase-9和caspase-3的顺序激活,最终导致细胞凋亡[18-19]。因此,Bcl-2与Bax比例的变化可促进或抑制下游信号caspase-3的表达和活化,从而决定细胞在受到凋亡信号刺激时是否发生凋亡[20]。研究表明,脑缺氧/缺血刺激及促炎细胞因子IL-1β和TNF-α的上调均可导致Bcl-2表达减少而Bax表达上调,直接或间接地导致caspase-3的表达和活性增高[8,17,21];异氟醚等麻醉剂具有神经毒性作用,可导致脑神经凋亡[7],研究证实其与对Bcl-2和Bax的差异性影响导致caspase-3的表达和活性改变有关[11,20]。本实验结果显示,麻醉组动物海马相关区域均可见到Bcl-2和Bax的表达,而控压组相关区域的Bcl-2/Bax比值小于麻醉组(P<0.05);下游caspase-3表达在2组动物海马也呈现相应趋势,并与观测的凋亡结果相符。
综上所述,麻醉、控压性麻醉及手术创伤等因素均可诱发中枢促炎细胞因子表达的增高,诱导海马相关区域Bcl-2/Bax比值失衡,caspase-3表达升高,导致海马神经元的凋亡,推测其与术后神经功能障碍的发生密切相关。本研究结果提示,全麻手术可导致海马神经损伤,而全麻/控压手术以及手术创伤应激等因素可加重这种损伤趋势。
[1] Degoute CS. Controlled hypotension: a guide to drug choice[J]. Drugs, 2007, 67 (7):1053-1076.
[2] Choi WS, Samman N. Risks and benefits of deliberate hypotension in anaesthesia: a systematic review[J]. Int J Oral Maxillofac Surg, 2008, 37(8):687-703.
[3] Busl KM, Greer DM. Hypoxic-ischemic brain injury: pathophysiology, neuropathology and mechanisms[J]. NeuroRehabilitation, 2010,26(1):5-13.
[4] Taoufik E, Probert L. Ischemic neuronal damage[J]. Curr Pharm Des, 2008,14(33): 3565-3573.
[5] Borsook D, George E, Kussman B, et al. Anesthesia and perioperative stress: consequences on neural networks and postoperative behaviors[J]. Prog Neurobiol, 2010, 92(4):601-612.
[6] Hudson AE, Hemmings HC Jr. Are anaesthetics toxic to the brain?[J]. Br J Anaesth, 2011, 107(1): 30-37.
[7] Kadhim HJ, Duchateau J, Sébire G. Cytokines and brain injury: invited review[J]. J Intensive Care Med, 2008, 23(4):236-429.
[8] Wang CX, Shuaib A. Involvement of inflammatory cytokines in central nervous system injury[J]. Prog Neurobiol, 2002, 67(2):161-172.
[9] Back T, Hemmen T, Schüler OG. Lesion evolution in cerebral ischemia[J]. J Neurol, 2004, 251(4): 388-397.
[11]Lin D, Zuo Z. Isoflurane induces hippocampal cell injury and cognitive impairments in adult rats[J]. Neuropharmacology, 2011,61(8):1354-1359.
[12]García-Bueno B, Caso JR, Leza JC. Stress as a neuroinflammatory condition in brain: damaging and protective mechanisms[J]. Neurosci Biobehav Rev, 2008, 32(6):1136-1151.
[13]顾 云, 庄 重. 糖皮质激素对脑内炎症反应的促进作用[J]. 中国病理生理杂志, 2011, 27(10):2030-2034.
[14]Conrad CD. Chronic stress-induced hippocampal vulnerability: the glucocorticoid vulnerability hypothesis[J]. Rev Neurosci, 2008, 19(6):395-411.
[15]Kohl BA, Deutschman CS. The inflammatory response to surgery and trauma[J]. Curr Opin Crit Care, 2006, 12(4):325-332.
[16]Perry VH, Cunningham C, Holmes C. Systemic infections and inflammation affect chronic neurodegeneration[J]. Nat Rev Immunol, 2007,7(2):161-167.
[17]Mattson MP. Apoptosis in neurodegenerative disorders[J]. Nat Rev Mol Cell Biol, 2000, 1(2):120- 129.
[18]Teschendorf P, Padosch SA, Spöhr F, et al. Time course of caspase activation in selectively vulnerable brain areas following global cerebral ischemia due to cardiac arrest in rats[J]. Neurosci Lett, 2008, 448(2):194-199.
[19]Yakovlev AG, Faden AI. Caspase-dependent apoptotic pathways in CNS injury[J]. Mol Neurobiol, 2001, 24(1-3):131-144.
[20]Wei H, Kang B, Wei W, et al. Isoflurane and sevoflurane affect cell survival and BCL-2/BAX ratio differently[J]. Brain Res, 2005,1037(1-2):139-147.
[21]Lynch AM, Lynch MA. The age-related increase in IL-1 type I receptor in rat hippocampus is coupled with an increase in caspase-3 activation[J]. Eur J Neurosci, 2002,15(11):1779-1788.
Effectofsurgicaloperationwithgeneralanesthesia/controlledhypotensiononneuronalapoptosisinhippocampus
WANG Gai-mei, LIU Zhe, SHEN Ying-jie, FANG Jian-qiao
(TheThirdClinicalCollege,ZhejiangChineseMedicalUniversity,Hangzhou310053,China.E-mail:ssrsliu@163.com)
AIM: To observe the influence and the possible mechanism of surgical operation with general anesthesia/controlled hypotension on neuronal injury in hippocampus.METHODSTwelve healthy male Beagle dogs aged 6~8 months were randomly divided into general anesthesia group (group A,n=6) and controlled hypotension group (group C,n=6). The dogs in group A were anesthetized with propofol injection and isoflurane inhalation. The dogs in group C were combined with intravenous infusion of sodium nitroprusside to induce hypotension based on the anesthesia, and the target mean arterial pressure (MAP) was maintained at 40% of the baseline level for 1 h.The animals in both groups underwent exploratory laparotomy in the corresponding period. MAP was controlled to return to baseline level after surgery, and then the brain tissues were taken out 72 h later. The levels of IL-1β, TNF-α, Bcl-2, Bax and cleaved caspase-3 were measured by the method of immunohistochemistry, and neuronal apoptosis was detected by TUNEL in CA1 and CA3 regions of hippocampus.RESULTSThe ratios of IL-1β and TNF-α positive cells in CA1 and CA3 regions of hippocampus were significantly increased in group C than those in group A. The ratio of Bcl-2/Bax in CA1 and CA3 regions of hippocampus was lower in group C than that in group A. In contrast, the ratio of caspase-3 positive cells in group C was significantly higher than that in group A. The apoptotic index of hippocampal neurons in group C was significantly higher than that in group A.CONCLUSIONThe exaggerated expression of proinflammatory cytokines in hippocampus may be induced by surgical operation with general anesthesia/controlled hypotension, leade to reduce the Bcl-2/Bax ratio, and to promote the expression of caspase-3, so as to resulting in neuronal apoptosis in hippocampus. These results suggest that postoperative neuronal damage may be related to hippocampal neuro-inflammation caused by surgical operation with general anesthesia/controlled hypotension.
Neuronal apoptosis; Inflammation; General anesthesia; Controlled hypotension; Hippocampus
R363
A
10.3969/j.issn.1000- 4718.2013.01.025
1000- 4718(2013)01- 0145- 05
2012-06-28
2012-11-14
国家基础研究重点项目(973计划)课题(No.2007CB512506);浙江省“重中之重”学科(针灸推拿学)资助项目(No.浙教高科[2008]255号)
△ 通讯作者Tel:0571-86613516;E-mail: ssrsliu@163.com

