LOX-1在2型糖尿病大鼠肾小管间质中的表达及其意义*
杜月光, 钱俊文, 宋光明, 柴可夫△
(浙江中医药大学 1病理学教研室, 2中医临床基础研究所,浙江 杭州 310053)
LOX-1在2型糖尿病大鼠肾小管间质中的表达及其意义*
杜月光1, 钱俊文2, 宋光明2, 柴可夫2△
(浙江中医药大学1病理学教研室,2中医临床基础研究所,浙江 杭州 310053)
目的探讨血凝素样氧化低密度脂蛋白受体1(LOX-1)在糖尿病肾病(DN)中的作用及其机制。方法SD大鼠随机分为正常对照组和糖尿病模型组。以高脂高糖饮食加低剂量注射链脲佐菌素复制2型糖尿病大鼠模型。动态观察:生化指标和24 h尿白蛋白排泄率(UAER);苏木素伊红(HE)和过碘酸-雪夫反应(PAS)染色观察肾脏病理,免疫组化检测LOX-1和转化生长因子β1(TGF-β1)蛋白表达,荧光定量聚合酶链反应检测LOX-1和TGF-β1mRNA表达,ELISA检测血清单核细胞趋化因子-1(MCP-1)、细胞间黏附分子(ICAM)和肿瘤坏死因子α(TNF-α)的浓度。结果随着造模时间的延长,血清中总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白(LDL)含量和UAER逐渐升高,高密度脂蛋白(HDL)在成模时升高,但随着病变进展含量减少;LOX-1和TGF-β1在肾小管中蛋白表达增加;与正常组比较,模型各组LOX-1和TGF-β1蛋白和mRNA表达逐渐增加;与正常组比较,模型各组血清MCP-1、ICAM和TNF-α水平均增高;LOX-1 mRNA表达与UAER、TNF-α和TGF-β1mRNA表达量之间呈正相关(r值分别为0.509、0.649和0.800)(P<0.05)。结论LOX-1在2型糖尿病肾小管中表达增加,使肾小管损伤,其作用可能通过炎症因子释放和炎症细胞浸润而实现,提示其在DN发生和发展过程中起重要作用。
糖尿病肾病; 血凝素样氧化低密度脂蛋白受体 1; 肾小管-肾间质损伤; 炎症
糖尿病肾病(diabetic nephropathy,DN)是糖尿病常见的微血管并发症,研究发现[1]糖尿病肾损伤早期就出现在肾小管,而且糖尿病患者肾功能的恶化程度与其肾小管间质损伤程度密切相关。但是关于糖尿病时肾小管间质的损伤机制不太明确。临床和实验研究表明,脂质代谢紊乱作为危险因素在糖尿病肾病的发生发展中起重要作用,其中氧化低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)是重要的危险因子[2]。血凝素样氧化低密度脂蛋白受体(lectin-like oxidized low-density lipoprotein receptor-1,LOX-1)是ox-LDL特异性受体,在动脉粥样硬化产生和血管的炎性反应性中发挥重要作用[3-4]。大量研究发现糖尿病两大主要并发症动脉粥样硬化和糖尿病肾病存在许多惊人的相似之处[5]。为此,本实验动态观察2型糖尿病大鼠肾脏LOX-1表达水平,并分析其与炎症反应的相关性,以期能揭示LOX-1在糖尿病肾病发病过程中的作用,为糖尿病肾病的治疗提供依据。
材 料 和 方 法
1材料
1.1动物 健康雄性SD大鼠60只(体重约280~300g),购自上海西普尔-必凯实验动物有限公司,动物生产许可证号为SCXK(沪)2008-0016,于浙江中医药大学动物实验研究中心饲养,实验许可证号为SYXK(浙)2007-0115(清洁级)。
1.2主要试剂与仪器 链脲佐菌素(streptozotocin, STZ)为Sigma产品;Trizol为Invitrogen产品;RT-PCR所需试剂购自宝生物工程有限公司;Oligo d(T)18Primers为Promega产品;SYBR® Premix Ex TaqTMII(D2639A)为宝生物工程有限公司产品;肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)和细胞间黏附分子(intercellular adhesion molecule,ICAM) ELISA kit 购自上海森雄生物有限公司;抗LOX-1多克隆抗体为Abcam产品;抗转化生长因子β1(transforming growth factor β1,TGF-β1)多克隆抗体为Santa Cruz产品,规格为sc-146。iCycler iQ PCR仪(Bio-Rad);ZF-90型暗箱式紫外透射仪(上海顾村电光仪器厂);DYY-6B型稳压稳流电泳仪(北京市六一仪器厂);DNA离心干燥箱(Thermo);Ultrospec3300pro微量核酸测量仪(Amershan);冷冻台式高速离心机(Heraeus);日立全自动生化分析仪(型号05007905)。
2方法
2.12型糖尿病大鼠模型制备与分组 将大鼠适应性喂养1周后,随机选取24只大鼠为正常对照组,实验过程中始终给予普通饲料喂养。其余大鼠禁食16~18 h,将链脲佐菌素溶于0.1 mmol/L柠檬酸缓冲液(pH 4.5),配成1%的溶液,按30 mg/kg单次尾静脉注射,注射当天开始喂予高脂饲料。高脂饲料配方:10%蛋黄,0.5%胆固醇,10%~20%猪油,10%蔗糖,其余为基础饲料。4周后尾静脉取血测定血糖,取尿液测定尿糖,随机血糖大于16.7 mmol/L确定为糖尿病模型。选取24只造模成功大鼠,继续给予充足高脂饲料和饮水。
2.2检测指标及方法 分别于大鼠成模时即0周、第4周和第8周,以3.5%水合氯醛腹腔内注射麻醉后,心脏抽血(血用于检测血糖、血脂)处死大鼠。摘取肾脏,去除包膜,称重,作长轴方向对切。取部分肾脏固定于10%甲醛缓冲液中供病理及免疫组化检测用;另一部分快速液氮冷冻,用于mRNA表达检测。处死前1 d留取24 h尿液用于检测尿蛋白。
2.2.1生化指标检测 应用全自动生化分析仪测定空腹血糖(fasting blood glucose,FBG)、总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白(low-density lipoprotein,LDL)和高密度脂蛋白(high-density lipoprotein,HDL)、血尿素氮(blood urea nitrogen,BUN)、血清肌酐(serum creatinine, SCr)以及24 h尿白蛋白排泄率(24 h urinary albumin excretion rate,UAER)等生化指标。
2.2.2肾脏组织病理观察与分析 肾组织经10%中性甲醛固定,脱水,再石蜡包埋与切片,切片行苏木素-伊红(hematoxylin-eosin,HE)和过碘酸-雪夫反应(periodic acid-Schiff reaction,PAS)染色,光镜下观察肾小管、肾小球结构、基质增生和炎细胞浸润等情况。
2.2.3LOX-1和TGF-β1蛋白表达检测 使用免疫组织化学EnVision二步法:肾组织经10%中性甲醛固定、常规脱水、石蜡包埋、切片;常规脱蜡、水化、煮沸修复抗原;3%过氧化氢封闭内源性过氧化酶;滴加Ⅰ抗(兔抗大鼠TGF-β1多克隆抗体,工作浓度为1∶100;兔抗LOX-1多克隆抗体,工作浓度为1∶10)置湿盒中,4 ℃冰箱内孵育过夜,PBS液冲洗;滴加Envision工作液,室温中30 min,PBS液冲洗;以DAB显色,苏木素复染,脱水、透明、封片。光镜观察,胞浆内或胞膜内出现棕褐色颗粒为阳性。每张切片在高倍视野下随机选取5个不同视野,以Image-Pro Plus 6.0图像分析软件对肾组织免疫组化结果进行分析,用平均吸光度表示阳性物质的相对含量。
2.2.4荧光定量PCR检测LOX-1和TGF-β1mRNA表达 按照Trizol试剂说明书提取肾组织总RNA,测定并计算RNA的纯度和浓度;取RNA在逆转录酶的作用下合成cDNA;用SYBR Green嵌合荧光法进行实时PCR扩增。β-actin上游引物5’-ATGCCATCCTGCGTCTG-3’,下游引物5’-ACTCCTGCTTGCTGATCCACAT-3’,产物长度566 bp;LOX-1上游引物5’-CCTTTCCAATGCTTCCTC-3’,下游引物5’-TGACAATATGTACCCACCAG-3’,产物长度384 bp;TGF-β1上游引物5’-GCAACAACGCAATCTATGA-3’,下游引物5’-CAAGGTAACGCCAGGAAT-3’,产物长度为200 bp。20 μL反应体系中包括2×SYBR® Premix Ex TaqTMII 10 μL,上游引物(10 μmol/L)0.5 μL,下游引物(10 μmol/L)0.5 μL,cDNA 0.5 μL,ddH2O 8.5 μL,反应条件94 ℃预变性5 min,进入循环:94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,30个循环。每份标本设3个复孔,取其循环阈值(Ct)均值,分别计算各组的ΔCt,表示其相对表达量。
2.2.5血清TNF-α、MCP-1及ICAM含量检测 采用ELISA法,具体步骤严格按照试剂盒说明书的要求进行。
3统计学处理
数据以均数±标准差(mean±SD)表示,采用统计软件SPSS 11.0分析,组间计量资料的比较采用单因素方差分析,相关性采用Pearson相关分析,以P<0.05为差异有统计学意义。
结 果
1各组大鼠血糖、血脂的变化
大鼠成模时血糖明显升高,随着时间的延长,血糖稳定在较高水平。血TC、TG和LDL成模时升高,但与正常对照组比较无显著差异,随着时间的延长,升高越来越明显,与正常组比较,TC于8周时显著升高(P<0.01);TG和LDL在4周和8周时明显升高(均P<0.01)。HDL在成模时升高,与正常对照组比较有显著差异,但随着时间的延长又逐渐下降,8周时与成模时比较明显减少(P<0.01),见表1。
表1各组大鼠血糖及血脂的变化
Table 1. Changes of biochemical parameters in each group(mean±SD.n=8)

GroupFBGTG(mmol/L)TC(mmol/L)HDL(mmol/L)LDL(mmol/L)Control4.38±0.520.55±0.141.05±0.090.76±0.140.16±0.040week21.23±2.85*0.71±0.122.08±0.611.72±0.43*0.42±0.154weeks22.98±4.01*1.56±0.45**2.41±0.741.32±0.531.33±0.33**8weeks25.91±3.48*1.73±0.54**4.14±1.24**1.06±0.29△△2.55±0.92**
*P<0.05,**P<0.01vscontrol;△△P<0.01vs0 week.
2各组大鼠肾功能指标及尿微量白蛋白的变化
与正常组比较,模型各组大鼠血尿素氮明显增加(P<0.01)。随着病情的发展,尿素氮增加更明显,与成模时比较,8周时血尿素氮显著增加(P<0.01);但肌酐各组无明显变化。24 h尿白蛋白排泄率成模时与正常对照组比较无显著差异;随着时间的延长,升高越来越明显,8周时与正常组比较及成模时比较均显著升高(P<0.01),与4周时比较差异显著(P<0.05),见表2。
表2各组大鼠肾功能指标及尿蛋白的变化
Table 2. Changes of BUN, SCr and UAER in each group(mean±SD.n=8)

GroupBUN(mmol/L)SCr(μmol/L)UAER(mg/L)Control4.47±0.4250.46±4.230.39±0.150week7.64±086**55.33±6.620.43±0.214weeks8.26±2.24**55.43±5.810.60±0.108weeks9.34±1.99**△△56.14±5.680.97±0.46**△△##
**P<0.01vscontrol;△△P<0.01vs0 week;##P<0.01vs4 weeks.
3对肾脏组织病理形态的影响
光镜下HE染色和PAS染色可以见到正常组大鼠肾小球和肾小管结构正常,肾小球内毛细血管张开,系膜区基质均匀。成模时大鼠肾小球内系膜基质略增多,基底膜稍增厚,使毛细血管腔变小,肾小球体积增大。随着时间的延长,大鼠肾小球内系膜区基质逐渐增多,基底膜增厚,血管腔进一步缩小甚至闭合;肾小球及肾小管间质内炎细胞浸润,肾小管上皮细胞空泡变明显、坏死脱落及萎缩,肾小管间质增生,见图1、2。
4各组大鼠肾脏LOX-1和TGF-β1蛋白表达的变化
免疫组化显示,正常组可见在肾小球及部分小管胞浆内LOX-1有一定量表达,成模时,可见肾小管细胞内表达增多,染色加深,随着时间的延长,表达进一步增多,特别在空泡化的肾小管,包膜表达明显,呈强阳性。TGF-β1在正常组大鼠肾小管有一定程度的表达,模型组表达增多,随着时间的延长,表达进一步增多,见图3、4。与对照组比较,模型各组棕色阳性信号明显增强,见表3。
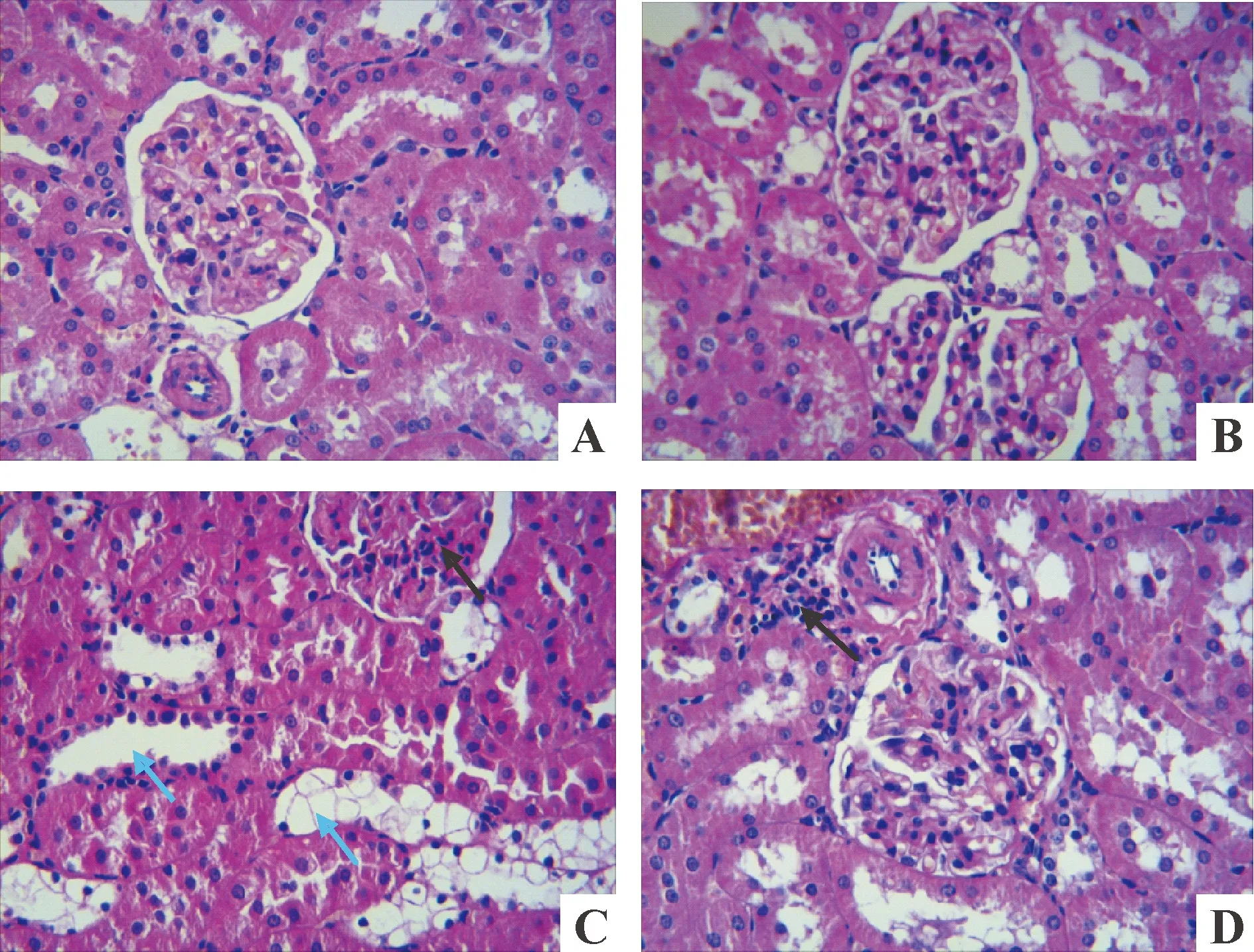
Figure 1. The pathological changes of rat renal tissues (HE staining, ×400). Black arrows indicate inflammatory cell infiltration;blue arrows indicate tubular injury. A:control; B: 0 week; C: 4 weeks; D: 8 weeks.
图1HE染色显示大鼠肾组织病理变化
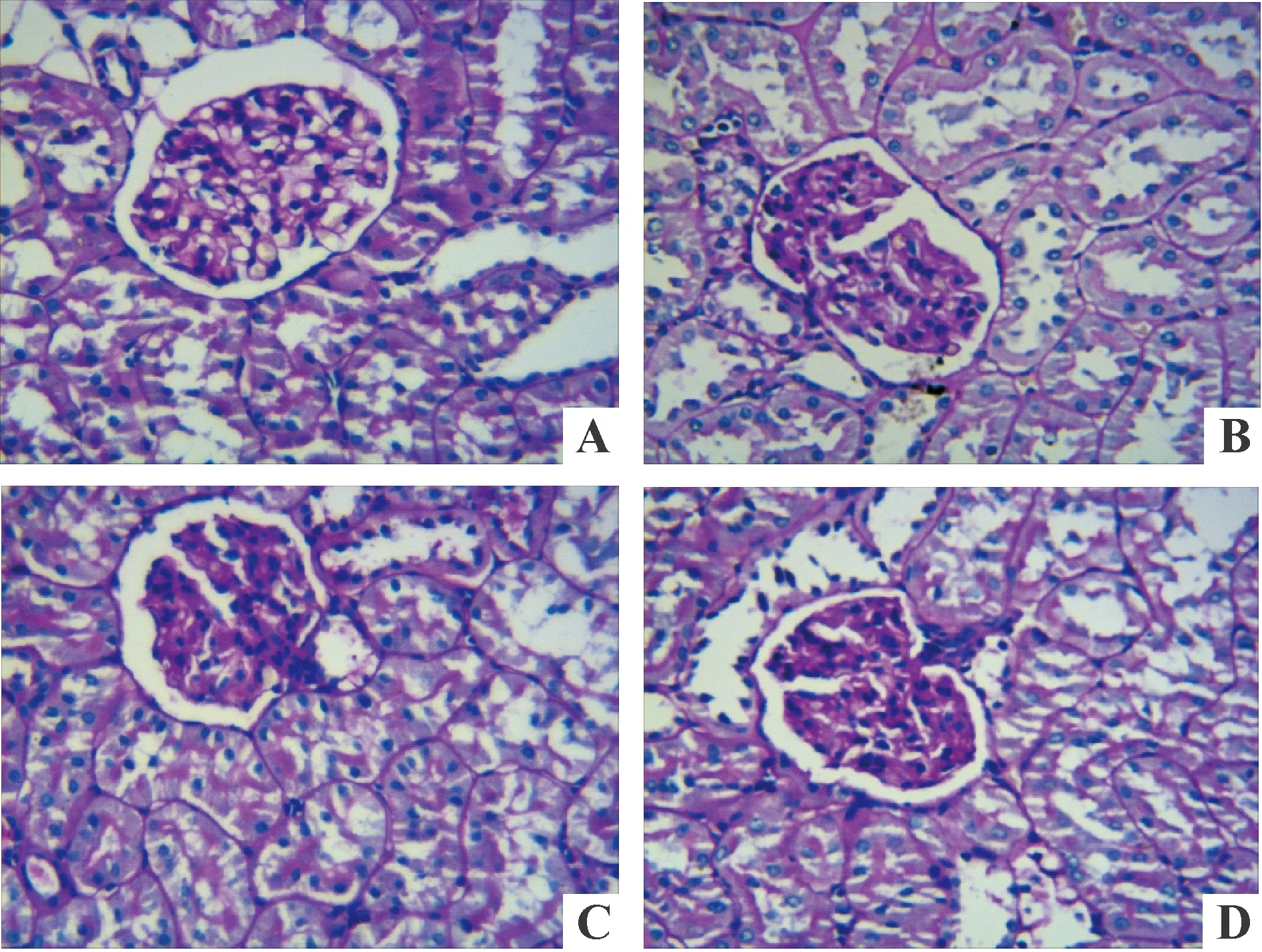
Figure 2. The pathological changes of rat renal tissues (PAS staining, ×400).A:control; B: 0 week;C: 4 weeks;D: 8 weeks.
图2PAS染色显示大鼠肾组织病理变化
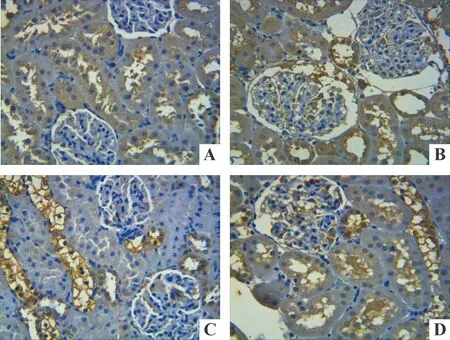
Figure 3. Expression of LOX-1 in rat renal tissues (immunohistochemical staining,×400). A:control; B: 0 week; C: 4 weeks;D: 8 weeks.
图3免疫组织化学染色检测大鼠肾组织LOX-1蛋白的表达

Figure 4. Expression of TGF-β1in rat renal tissues (immunohistochemical staining,×400).A: control; B: 0 week;C: 4 weeks; D: 8 weeks.
图4免疫组织化学染色检测大鼠肾组织TGF-β1蛋白的表达
表3各组大鼠肾脏LOX-1和TGF-β1mRNA和蛋白表达的变化
Table 3. Changes of LOX-1 and TGF-β1mRNA and protein expression in each group(mean±SD.n=8)

GroupmRNA(ΔCt)Protein(IA)LOX-1TGF-β1LOX-1TGF-β1Control22.90±1.5623.04±9.860.022±0.0080.038±0.0150week16.19±3.65*13.12±2.28*0.039±0.015*0.040±0.0174weeks10.61±2.50**9.61±1.02**0.045±0.016**0.056±0.024**8weeks9.55±4.50**6.94±3.56**0.051±0.016**0.065±0.028**△
*P<0.05,**P<0.01vscontrol;△P<0.05vs0 week.
5各组大鼠肾脏LOX-1和TGF-β1mRNA表达的变化
模型各组随着时间的延长,LOX-1 mRNA表达量逐渐增加,与正常组比较,成模时其表达明显升高(P<0.05),4周和8周进一步增加(均P<0.01),8周时与成模时比较差异显著(P<0.05)。TGF-β1mRNA表达量也随着时间的延长逐渐增加,与正常组比较,成模时明显增加(P<0.05),4周和8周时进一步升高(均P<0.01),见表3。
6各组大鼠血清中MCP-1、ICAM和TNF-α的浓度
模型各组与正常组比较,MCP-1含量8周时表达明显增加(P<0.01),与成模时比较也明显增加(P<0.01);模型各组ICAM含量4周时与正常组比较显著升高(P<0.05),8周时与正常组及成模时比较差异显著(P<0.01,P<0.05)。4周时模型各组TNF-α含量与正常组比较差异显著(P<0.05),8周时与正常组比较其表达进一步升高(P<0.01),见表4。
表4各组大鼠血清炎症因子的含量
Table 4. Content of serum inflammatory factors in each group(mean±SD.n=6)

GroupMCP-1(ng/L)ICAM(μg/L)TNF-α(ng/L)Control9.34±1.5520.61±2.5011.77±1.770week9.91±1.2123.46±4.9716.85±3.134weeks10.92±1.8027.01±5.18*17.62±5.77*8weeks12.30±1.95**△△32.31±3.91**△22.49±8.59**
*P<0.05,**P<0.01vscontrol;△P<0.05,△△P<0.01vs0 week.
7LOX-1与UAER、炎症因子及TGF-β1的相关性分析
大鼠肾组织LOX-1 mRNA表达水平与UAER和TNF-α之间呈正相关(r值分别为0.509和0.649),均P<0.05,但与MCP-1和ICAM之间无明显相关;LOX-1 mRNA表达水平与TGF-β1mRNA表达水平呈正相关(r值为0.800),P<0.01。
讨 论
糖尿病肾病是糖尿病的微血管并发症,也是终末期肾病的主要原因,2型糖尿病患者占糖尿病患者的绝大部分。肾小管间质病变是糖尿病肾病的主要特征之一,并且肾功能恶化的程度与肾小管间质的损伤程度密切相关[1]。本研究采用高脂高糖饮食加低剂量链脲佐菌素尾静脉注射诱导复制2型糖尿病大鼠,动态观察肾脏功能及其病理变化。结果显示:在2型DM大鼠成模时,血糖升高,并一直处于较稳定状态;24 h尿白蛋白排泄率成模时增加不明显,但随着时间的延长,增加越来越明显,表明此时已出现一定程度的肾功能障碍,这与贺亮等[6]的研究结果一致。本研究发现,随着造模时间的延长,TC、TG和LDL逐渐升高,而HDL成模时升高,然后降低。本人推测这可能是为了降低血中的TC和TG,HDL先代偿性升高,随后的降低可能是由于病变的发展,自由基产生增加,使脂蛋白酯酶活性降低,但这有待进一步研究。HE和PAS染色显示,成模时大鼠肾小球局部基质轻度增生,基底膜增厚,肾小管上皮轻度空泡化,随着造模时间的延长,病变趋于严重,出现炎细胞局灶性浸润、肾小管发生萎缩和间质发生纤维化等病理变化,因此,本研究证实在早期2型DN中就出现局部肾小管间质的损伤。
临床和实验研究表明,脂质代谢紊乱作为危险因素在糖尿病肾病的发生发展中起重要作用,尤其是ox-LDL[2],但其引起DN的机制不明确。研究提示糖尿病两大主要并发症动脉粥样硬化和DN存在共同的病理生理基础[5]:均有炎症反应、活性氧自由基的产生及促纤维化因子的产生等。LOX-1为ox-LDL的特异受体,大量研究[4]证实高表达的LOX-1可特异性地结合ox-LDL,引起血管内皮细胞的激活、功能紊乱,使黏附分子和炎症因子大量表达,单核巨噬细胞聚集浸润于内皮下,大量吞噬ox-LDL,在动脉粥样硬化病理变化过程中起着关键的作用。因此,本实验观察LOX-1在糖尿病大鼠肾脏中的表达并分析其与肾功能及病变的相关性。结果显示,LOX-1在肾脏中表达增加,且随着肾脏病变的加重有升高趋势,与UAER呈正相关。其中免疫组化结果显示,LOX-1在肾小球与肾小管中可见表达,随着病变的加重,肾小管中的表达增加,特别是在空泡变的肾小管上皮细胞胞膜表达呈强阳性,与Kelly等[7]的研究结果一致:研究发现糖尿病肥胖大鼠LOX-1表达增加,并且与肾功能变化呈正相关。相反用LOX-1抗体治疗可改善肾功能,减轻脂毒性以及由此引起的炎症细胞浸润,肾间质纤维化[8],这提示LOX-1在糖尿病肾小管间质的损伤中起一定的作用。不过关于LOX-1的表达有不同的报道,Yamamoto等[9]原位杂交结果显示LOX-1 mRNA在肾小球和肾小管中均有表达,在糖尿病肾病患者肾小管表达增加,而肾小球表达无明显增加,与本实验结果一致。但Nagase等[10]研究认为肾小球和肾小管的表达均升高。
目前普遍认为糖脂代谢紊乱引起的免疫炎症反应在DN发生发展过程中发挥着重要的作用,而巨噬细胞浸润是肾脏病变中的重要病理特征。致炎因子如TNF-α、MCP-1和ICAM通过介导单核巨噬细胞的黏附、趋化等过程在DN早期病变中起关键作用,并与蛋白尿、肾小管间质损伤及病变进展有关[11]。本实验观察糖尿病肾脏病变显示,在第4周,肾小球、肾小管间质内有巨噬细胞浸润,随着时间的进展,浸润增多。同时结果还显示,随着病变的加重,大鼠血清炎症因子ICAM-1、MCP-1和TNF-α的含量增加,因此,我们的研究也证实了炎症在糖尿病肾病中的作用。
脂毒性被认为是肾小球硬化和肾小管-间质损伤的主要原因之一。研究认为ox-LDL与LOX-1结合,促进脂质蓄积、并启动肾小管上皮细胞向前炎症表型转化,募集白细胞黏附、加剧炎症反应,引起肾小管间质的损伤[6,12]。由于糖尿病状态下,机体内普遍存在的氧化应激导致脂质、脂蛋白等过度氧化,并在肾组织过度蓄积,肾小管上皮细胞通过其表面受体吞饮氧化的脂质和脂蛋白,进而使细胞内脂质蓄积、脂质过负荷,细胞出现功能障碍,引起肾小管间质进一步损伤[13-14]。LOX-1还可作为一个信号分子转导生物信号,调节其自身以及炎症因子和趋化因子的表达[15]。本实验进一步分析了LOX-1与炎症因子的相关性,结果显示LOX-1表达与肾小管间质炎症细胞浸润、肾小管萎缩程度相平行,与TNF-α的含量呈正相关。
综上所述,LOX-l在高脂高糖饮食及STZ诱导的2型糖尿病大鼠肾小管间质中表达明显增加,且伴有炎症因子的释放和炎症细胞的浸润,导致肾小管间质损伤,引起肾功能障碍,但LOX-1上述作用还有待进一步实验证实。
[1] Vallon V.The proximal tubule in the pathophysiology of the diabetic kidney[J].Am J Physiol Regul Integr Comp Physiol,2011,300(5): R1009-R1022.
[2] Ujihara N,Sakka Y,Takeda M,et al. Association between plasma oxidized low-density lipoprotein and diabetic nephropathy[J].Diabetes Res Clin Pract,2002, 58(2):109-114.
[3] 朱惠莲,唐志红,夏 敏,等. LOX-1介导ox-LDL诱导的血管内皮细胞MCP-1的表达[J]. 中国病理生理杂志,2005,21(7):1249-1254.
[4] Twigg MW, Freestone K, Homer-Vanniasinkam S, et al. The LOX-1 scavenger receptor and its implications in the treatment of vascular disease[J].Cardiol Res Pract,2012,2012: 632408.
[5] Avram MM. Similarities between glomerular sclerosis and atherosclerosis in human renal biopsy specimens: a role for lipoprotein glomerulopathy[J].Am J Med,1989, 87(5N): 39N-41N.
[6] 贺 亮,高 松,黄 薇,等. 糖尿病金黄地鼠喂饲高脂食物诱发肾脏损伤[J].中国病理生理杂志,2009, 25(12):2491-2493,2496.
[7] Kelly KJ,Wu P,Patterson CE,et al.LOX-1 and inflammation:a new mechanism for renal injury in obesity and diabetes[J].Am J Physiol Renal Physiol,2008,294(5):F1136-F1145.
[8] Dominguez JH, Mehta JL, Li D,et al.Anti-LOX-1 therapy in rats with diabetes and dyslipidemia: ablation of renal vascular and epithelial manifestations[J]. Am J Physiol Renal Physiol,2008,294(1):F110-F119.
[9] Yamamoto N, Toyoda M, Abe M, et al. Lectin-like oxidized LDL receptor-1 (LOX-1) expression in the tubulointerstitial area likely plays an important role in human diabetic nephropathy[J].Intern Med,2009,48(4):189-194.
[10]Nagase M, Kaname S, Nagase T, et al. Expression of LOX-1, an oxidized low-density lipoprotein receptor, in experimental hypertensive glomerulosclerosis[J].J Am Soc Nephrol,2000,11(10): 1826-1836.
[11]Luis-Rodríguez D,Martínez-Castelao A,Grriz JL,et al. Pathophysiological role and therapeutic implications of inflammation in diabetic nephropathy[J].World J Diabetes,2012,3(1): 7-18.
[12]Kim HJ,Moradi H,Yuan J,et al.Renal mass reduction results in accumulation of lipids and dysregulation of lipid regulatory proteins in the remnant kidney[J].Am J Physiol Renal Physiol,2009,296(6):F1297-F1306.
[13]Dominguez JH, Wu P, Hawes JW, et al. Renal injury: similarities and differences in male and female rats with the metabolic syndrome[J].Kidney Int,2006,69(11):1969-1976.
[14]Dominguez JH, Wu P, Packer CS, et al. Lipotoxic and inflammatory phenotypes in rats with uncontrolled metabolic syndrome and nephropathy[J].Am J Physiol Renal Physiol,2007,293(3): F670-F679.
[15]Xu Y, Ruan S, Xie H, et al. Role for LOX-1 in Ang II induced oxidative functional damages in renal tubular epithelial cells[J].Int J Mol Med,2010,26(5):679-690.
ExpressionofLOX-1intype2diabeticrattubularinterstitialtissues
DU Yue-guang1, QIAN Jun-wen2, SONG Guang-ming2, CHAI Ke-fu2
(1DepartmentofPathology,2NationalTCMClinicalResearchCenter,ZhejiangChineseMedicalUniversity,Hangzhou310053,China.E-mail:ckf666@163.com)
AIM: To explore the effect of lectin-like oxidized low-density lipoprotein receptor 1 (LOX-1) on type 2 diabetic nephropathy in rats.METHODSThe Sprague-Dawley (SD) rats were randomly divided into control group and model group. The animal model was established by intraperitoneal injection of low-dose streptozotocin (STZ, 30 mg/kg) plus feeding with high-fat/high-glucose diets for one month. Biochemical parameters and 24 h urine album excretion rate (UAER) were monitored. The morphological changes of the renal tissue were examined under microscope with hematoxylin-eosin (HE) and periodic acid-Schiff reaction (PAS) staining. The protein levels of LOX-1 and transforming growth factor β1(TGF-β1) in the renal tissues were determined by the method of immunohistochemistry. The mRNA expression of LOX-1 and TGF-β1was detected by real-time polymerase chain reaction. The serum levels of monocyte chemotactic protein-1 (MCP-1), intercellular adhesion molecule (ICAM) and tumor necrosis factor α(TNF-α) were measured by enzyme-linked immunosorbent assay (ELISA). The correlation between LOX-1 and UAER, inflammatory factors and TGF-β1was analyzed.RESULTSCompared with normal group, total cholesterol (TC), triglyceride (TG), low-density lipoprotein (LDL) and UAER in model groups markedly increased, high-density lipoprotein (HDL) only increased at 0 week, then decreased at 4 and 8 weeks. The expression of LOX-1 and TGF-β1at mRNA and protein levels was increased, as well as the concentration of serum inflammatory factors such as MCP-1, ICAM and TNF-α. The obvious relations between LOX-l mRNA with UAER, TNF-α and TGF-β1were observed (r=0.509, 0.649 and 0.800, respectively,P<0.05).CONCLUSIONLOX-1 is significantly increased in type 2 diabetic rat tubular interstitial tissues and aggravates the dysfunction of renal tubules by releasing inflammatory factors and promoting inflammatory cell infiltration.
Diabetic nephropathies; Lectin-like oxidized low-density lipoprotein receptor 1; Tubular-interstitial injury; Inflammation
R363
A
10.3969/j.issn.1000-4718.2013.01.008
1000- 4718(2013)01- 0050- 06
2012- 07- 16
2012- 10- 30
浙江省教育厅项目(No. 200907543)
△通讯作者Tel: 0571-86613323; E-mail: ckf666@163.com

