急性心肌梗死大鼠缺血心肌中差异microRNA的表达谱分析*
王海华, 姜玉新, 高 欣, 闵志雪, 林 浩, 崔凤娟
(皖南医学院 1生理学教研室, 2医学一系,安徽 芜湖 241002)
急性心肌梗死大鼠缺血心肌中差异microRNA的表达谱分析*
王海华1△▲, 姜玉新1▲, 高 欣2, 闵志雪1, 林 浩2, 崔凤娟1
(皖南医学院1生理学教研室,2医学一系,安徽 芜湖 241002)
目的筛选急性心肌梗死(AMI)大鼠缺血心肌中差异表达的microRNAs(miRNAs),预测其靶基因并分析其可能的生物学功能。方法结扎冠状动脉左前降支建立雄性Wistar大鼠AMI模型,同时检测其心电图和颈总动脉血压变化,并用TTC法测定心肌梗死面积;假手术(sham)组除不结扎冠状动脉左前降支外,其它实验程序与AMI组相同。心肌缺血4 h后取梗死区心肌组织,提取总RNA进行microRNA芯片杂交检测,并用real-time PCR进行验证;生物信息学方法预测差异miRNAs的靶点并分析其生物学功能。结果心电图、血压检测及病理切片证实AMI模型制备成功。Microarray检测结果表明,与sham组相比,获得11个与急性心肌梗死相关的miRNAs,其中6个miRNAs上调表达,5个miRNAs下调表达;已知3个miRNAs(rno-miR-181c、rno-miR-146b和rno-miR-208)参与了心血管功能的调节,8个miRNAs(rno-miR-672*、rno-miR-743b、rno-miR-128、rno-miR-138-1*、rno-miR-336、rno-miR-138-2*、rno-miR-325-3p和rno-miR-3572)是否与心血管功能有关尚不清楚,可能是心肌梗死相关的新的生物标志物。预测的miRNA靶基因中的一部分亦与心血管功能相关。结论本研究获得的与AMI相关的差异miRNAs,可能是急性心肌梗死新的生物标志物和潜在的治疗靶点。
急性心肌梗死; 微小RNA; 表达谱; 生物信息学
冠心病、心肌缺血和心肌梗死,尤其是急性心肌梗死(acute myocardial infarction, AMI)是临床的常见病和多发病,其发病率及致死率逐年升高。MicroRNAs (miRNAs)是一类高度保守的内源性非编码单链小分子RNA,长度约为19~25个核苷酸,对蛋白表达起转录后调控作用,且其表达具有一定的组织特异性[1]。已有研究表明,miRNAs参与了心肌肥厚、心肌缺血、心律失常等多种病理生理过程[2-8],是一类重要的内源性调节因子。miRNAs在AMI的发生发展过程中其表达呈现出时序性。如miR-1和miR-206在心梗后1周、2周和4周的含量持续上升,心梗4周时miR-1上调20倍和miR-206上调15倍[5]。van Rooij等[9]亦观察到此现象,在大鼠心梗后3 d和14 d梗死心肌边缘区(border zone)和远离区(remote zone)检测到了不同数量的miRNAs的表达。这说明miRNAs在心肌梗死的发病过程具有多样性与复杂性。但miRNAs在心肌缺血中的功能与机制研究尚处于起步阶段,尤其是有关心肌缺血早期miRNAs改变的报道较少。本研究拟复制大鼠AMI模型,筛选梗死心肌差异表达的miRNAs,并通过生物信息学预测其靶基因,探讨其与AMI的发生发展的关系,为防治心肌缺血性损伤提供新的实验依据和可能的治疗靶点。
材 料 和 方 法
1动物及分组
雄性清洁级Wistar大鼠[(200±20) g] 6只,由南京青龙山动物繁殖场提供,实验动物合格证号为SCXK(苏)2007-0001,随机分为2组(n=3):AMI组和假手术(sham)组。AMI大鼠25%氨基甲酸乙酯(4 mL/kg,ip)麻醉后,仰卧固定于鼠台上,记录心电图,通过插入气管插管,连接动物呼吸机维持正常通气(潮气量3 mL/kg,呼吸比1.5∶1,呼吸频率70min-1)。胸骨左侧顺第3~4肋肋间隙方向切开皮肤,逐层分离皮下组织、肌肉,开胸器于3~4肋间撑开进胸,暴露心脏,用6-0无损伤缝线在左心耳下缘1~2 mm处连同少量心肌组织缝扎左冠状动脉前降支。稳定10 min确定无出血后,逐层关胸。心电图检测可见ST段呈弓背向上型明显抬高,血压明显下降。2, 3, 5-氯化三苯基四氮唑(2, 3, 5-triphenyltetrazolium chloride, TTC)染色法对冠状动脉左前降支结扎4 h的大鼠心肌进行梗死面积测定,通过对比分析证实AMI模型成功。心肌缺血4 h后取梗死区心肌组织于液氮保存。Sham组除不结扎冠状动脉左前降支外,其它处理与AMI组相同。
2缺血区心肌组织总RNA的提取
将约100 mg缺血区心肌组织用液氮研磨成粉末,加入1 mL TRIzol®(Invitrogen)混合,按TRIzol和miRNeasy Mini Kit(Qiagen)说明书进行总RNA提取,提取的RNA用ND-1000分光光度计(Nanodrop Technologies)检测其质量和含量,用琼脂糖凝胶电泳检测RNA的完整性,两者均合格后方可进行后续实验。
3芯片杂交
3.1探针标记 RNA用miRCURYTMHy3TM/Hy5TMPower Labeling Kit(Exiqon)按说明书进行标记。用Hy3TM荧光标记液进行3’末端标记1 μg/样本,并用T4 RNA连接酶按下列步骤进行连接:2.0 μL RNA溶液(0.5 g/L)和1.0 μL CIP缓冲液及CIP(Exiqon)混合后37 ℃孵育30 min,95 ℃终止反应5 min;然后加入3.0 μL标记缓冲液,1.5 μL Hy3TM荧光标记液(Exiqon),2.0 μL DMSO,2.0 μL标记酶,混匀后16 ℃孵育1 h,65 ℃终止反应15 min。
3.2miRNA芯片杂交 杂交用芯片为miRCURYTMLNA Array 18.0(Exiqon,包括miRBase 18.0注释的覆盖所有人、大鼠和小鼠的miRNAs及与这些物种相关的病毒miRNAs,共3 100个探针),杂交按照说明书进行。具体操作如下:取25 μL Hy3TM标记的样本与25 μL杂交缓冲液混合,95℃变性2 min,冰上放置2 min,然后在12-Bay Hybridization System(NimbleGen)上进行芯片杂交,56 ℃杂交16~20 h,用Wash Buffer Kit(Exiqon)洗涤芯片3次,400 r/min离心5 min甩干。用Axon GenePix 4000B Microarray Scanner(Axon Instruments)进行图像扫描。为保证结果的可重复性和可靠性,每组均用3张芯片进行3次独立实验。
3.3芯片结果的real-time PCR验证
3.3.1引物设计 随机挑取4个差异表达的miRNAs,用Primer 5.0进行特异性引物设计。同时以U6为内参照,见表1。引物由生工生物工程(上海)股份有限公司合成。

表1 Real-time PCR使用的引物
3.3.2Real-time PCR 反应体系为10 μL:5 μL 2×PCR master mix(Exiqon),0.5 μL PCR特异引物F(10 μmol/L),0.5 μL PCR特异引物R(10 μmol/L),2 μL H2O,加入2 μL cDNA后混匀。PCR反应条件为:95 ℃ 10 min;95 ℃ 10 s;60 ℃ 60 s(收集荧光),40个循环。为建立PCR产物的熔解曲线,扩增反应结束后,按 95 ℃ 10 s、60 ℃ 60 s、95 ℃ 15 s,并从60 ℃缓慢加热到99 ℃(仪器自动进行-Ramp Rate为2%)。各样品的目的miRNAs和U6分别进行real-time PCR反应。PCR反应在ABI PRISM7900 System(Applied Biosystems)进行。
3.4miRNA靶基因的预测和功能分析
3.4.1miRNA靶基因的预测 使用miRanda(http://microrna.org/microrna/home.do)、miRBase(http://www.ebi.ac.uk/enright-srv/microcosm/htdocs/targets/v5/)和miRDB(http://mirdb.org/miRDB/)常用数据库对差异表达的miRNAs进行靶基因预测。为了减少假阳性,同一miRNA的靶基因至少在2个以上的数据库同时出现,方可进行后续分析。
3.4.2miRNA靶基因的功能分类 根据Gene Ontology(http://www.geneontology.org)的分类原则对miRNA靶基因进行分类,同时分析了每一大类中的主要亚类(前10个亚类)。
4数据分析
扫描的图片用GenePix Pro 6.0软件(Axon)进行数据提取,并进行数据标准化处理。差异表达的miRNAs用volcano plot filtering鉴定,用MeV 4.6(TIGR)进行系统聚类。实时定量PCR数据采用2-ΔΔCt法进行分析。芯片杂交及数据分析均由上海康成生物工程有限公司完成。数据以均数±标准差(mean±SD)表示,组内比较用配对t检验,多组均数
比较用单因素方差分析(One-way ANOVA),两两比较用SNK法,以P<0.05为差异有统计学意义。
结 果
1各组大鼠心电图及心肌梗死面积的示意图
与sham组相比,AMI组大鼠II导联心电图ST段抬高,出现宽大的QRS波,T波倒置,同时其血压明显下降,见图1。通过TTC法对冠状动脉左前降支结扎4 h的大鼠心肌进行梗死面积测定,可明显见到缺血未梗死区(红色区)和缺血梗死区(白色区),见图2,通过对比分析证实AMI模型成功。
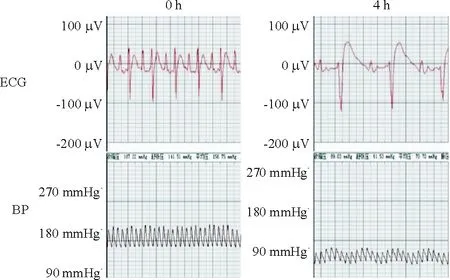
Figure 1. Representative changes of electrocardiogram and blood pressure in rats during acute myocardial infarction.
图1急性心梗模型大鼠的心电图和血压变化
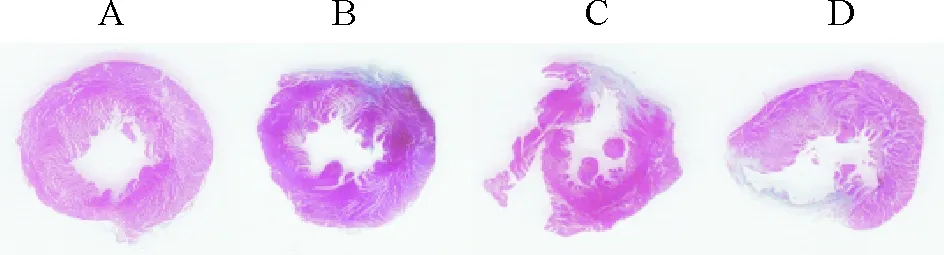
Figure 2. Observation of ischemic myocardium (TTC staining). A: sham; B~D: ischemic regions of myocardium.
图2大鼠心肌梗死区示意图
2差异表达的miRNAs筛选
与sham组相比,筛选出11个与急性心肌梗死相关的差异表达miRNAs(上调>1.3倍或下调<0.76倍),见表2。其中6个miRNAs表达上调,分别是rno-miR-672*、rno-miR-743b、rno-miR-128、rno-miR-138-1*、rno-miR-336和rno-miR-138-2*。5个miRNAs表达下调,分别是rno-miR-181c、rno-miR-146b、rno-miR-325-3p、rno-miR-208和rno-miR-3572。在火山图中可见上调表达的6个miRNAs位于图中右侧,而下调表达的5个miRNAs则位于左侧,见图3A。系统聚类图中可见差异表达的miRNAs的变化情况,见图3B。
表2急性心肌梗死相关的差异表达的miRNAs
Table 2. Differentially expressed miRNAs in ischemic myocardium of rats after acute myocardial infarction
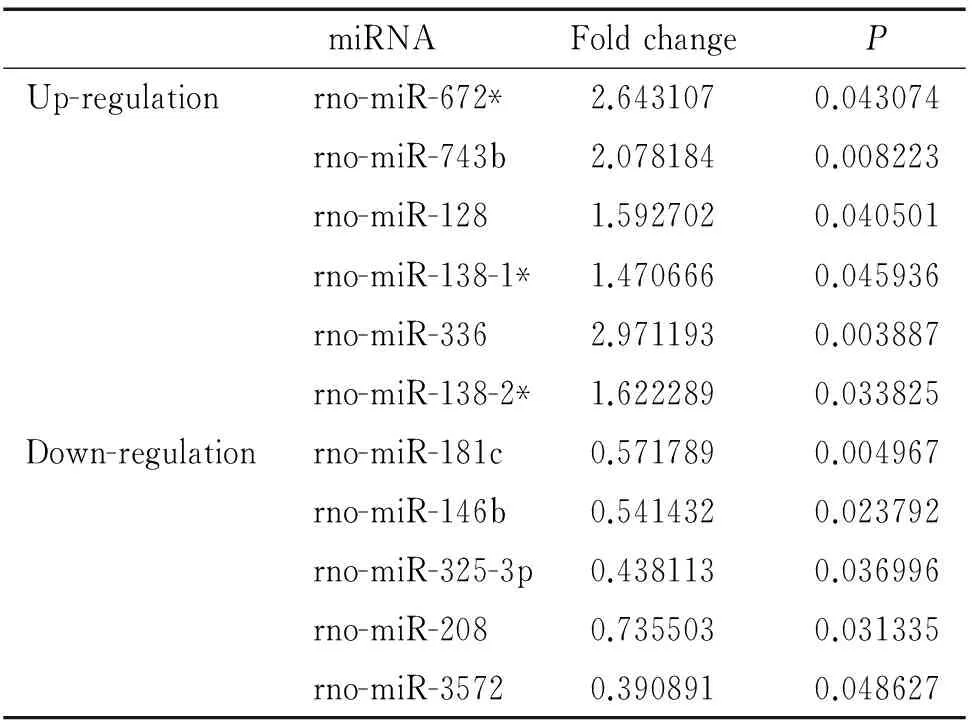
miRNAFoldchangePUp-regulationrno-miR-672*2.6431070.043074rno-miR-743b2.0781840.008223rno-miR-1281.5927020.040501rno-miR-138-1*1.4706660.045936rno-miR-3362.9711930.003887rno-miR-138-2*1.6222890.033825Down-regulationrno-miR-181c0.5717890.004967rno-miR-146b0.5414320.023792rno-miR-325-3p0.4381130.036996rno-miR-2080.7355030.031335rno-miR-35720.3908910.048627
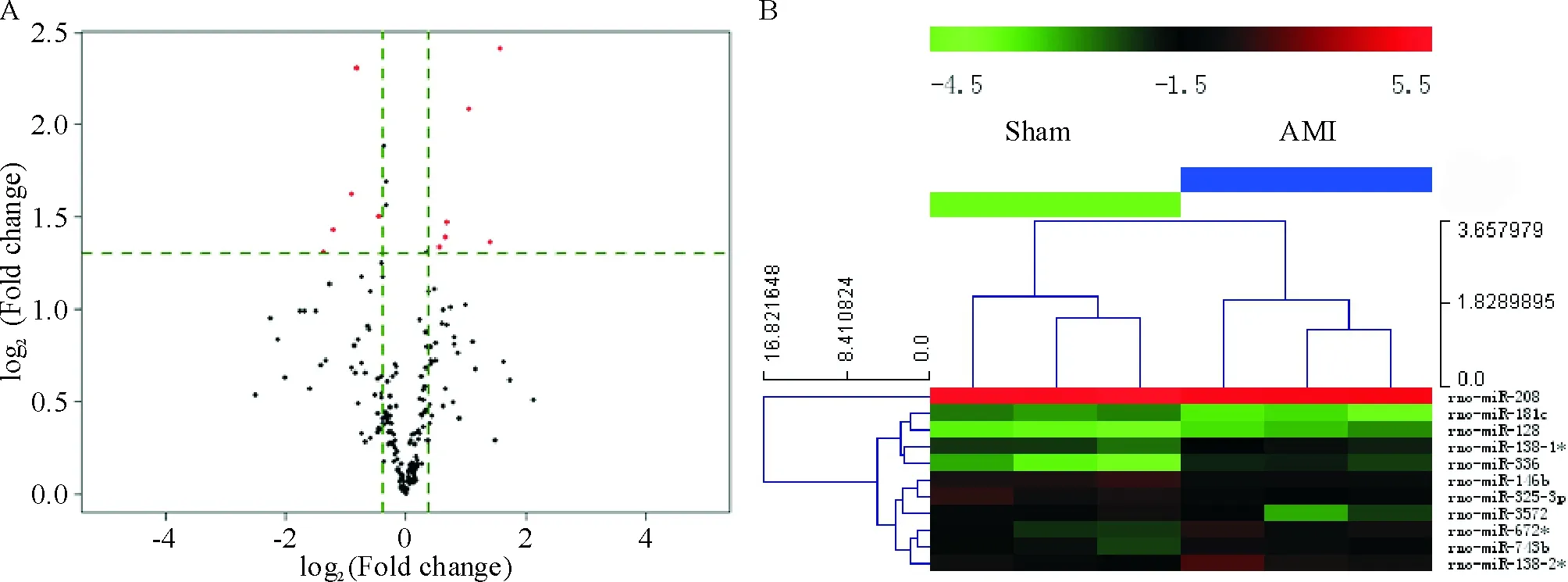
Figure 3. Volcano plot (A) and hierarchical clustering (B) of differentially expressed miRNAs.
图3差异表达的miRNAs的火山图和系统聚类分析
3Real-timePCR检测
随机选取4个miRNAs(rno-miR-743b、rno-miR-336、rno-miR-146b和rno-miR-181c)进行real time-PCR 验证,同时以U6为内参照,对数据进行归一化处理,并与miRNA芯片数据进行比较发现,两者的结果相一致,见图4,说明miRNA芯片结果的可靠性。
4miRNAs的功能分析
11个差异表达的miRNAs中,已报道的与心血管系统功能有关的有3个,分别是rno-miR-181c、rno-miR-146b 和rno-miR-208,见表3。其它的miRNAs在心血管中的功能尚不清楚。
5miRNAs靶基因的预测
通过miRanda、miRBase和miRDB 3个预测大鼠miRNA靶点的数据库对11个差异miRNAs的靶点进行预测,这些靶基因在3个数据库中分布的数量及重叠情况见图5。由图可见,在3个数据库中均出现的共有61个,它们的具体靶点见表4。其它靶基因仅出现在1个或2个数据库中(结果未显示)。从表4中可见,仅4种miRNAs的靶基因在3个数据库中均出现,这些miRNAs分别是rno-miR-181c、rno-miR-208、rno-miR-336和rno-miR-743b。
对所有靶基因进行GO分类后,对生物过程(biological process, BP)、细胞组分(cellular component, CC)和分子功能(molecular function, MF)的前10亚类进行了初步分析,结果表明在BP大类中,参与细胞过程(cellular process)的靶基因最多,为543个;其次是代谢过程(metabolic process,411个)、主要代谢过程(primary metabolic process,369个)和细胞代谢过程(cellular metabolic process,350个),见图6A;在CC大类中,胞内组分(intracellular)的靶基因最多,为520个,其次分别是胞内部分(intracellular part,513个)、细胞器(organelle,439个)和胞内细胞器(intracellular organelle,437个),见图6B;而在MF大类中,这些靶基因主要参与了结合(binding,582个)、蛋白结合(protein binding,460个)、催化活性(catalytic activity,282个)和水解酶活性(hydrolase activity,113个)等功能,见图6C。这些靶基因的分布展示了在急性心肌梗死发生过程中的基因表达变化。
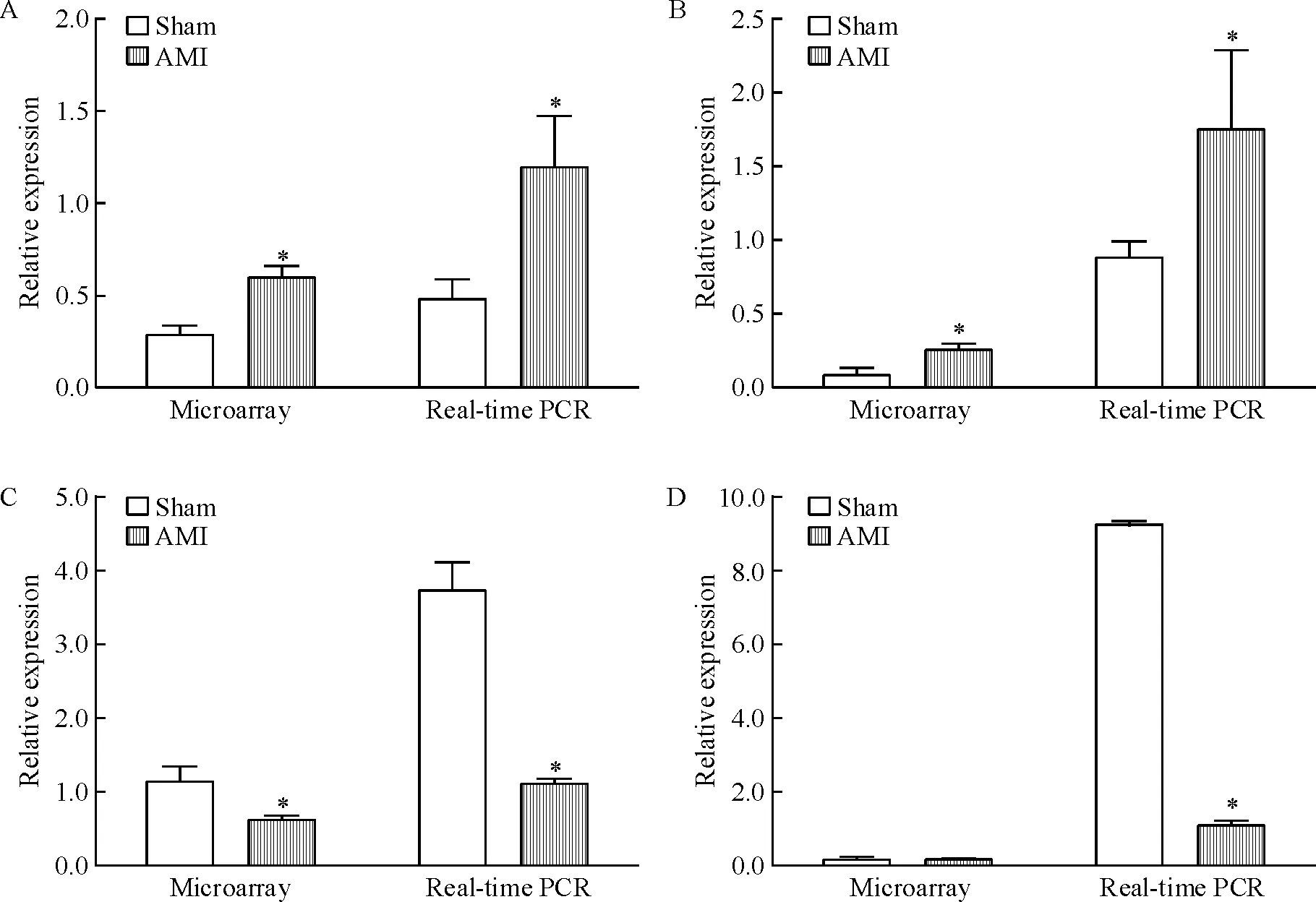
Figure 4. Confirmation of differentially expressed miRNAs in rat ischemic myocardium by real-time PCR.A:rno-miR-743b;B:rno-miR-336;C:rno-miR-146b;D:rno-miR-181c. Meam±SD.n=3.*P<0.05vssham group.
图4差异表达的miRNAs的real-timePCR验证
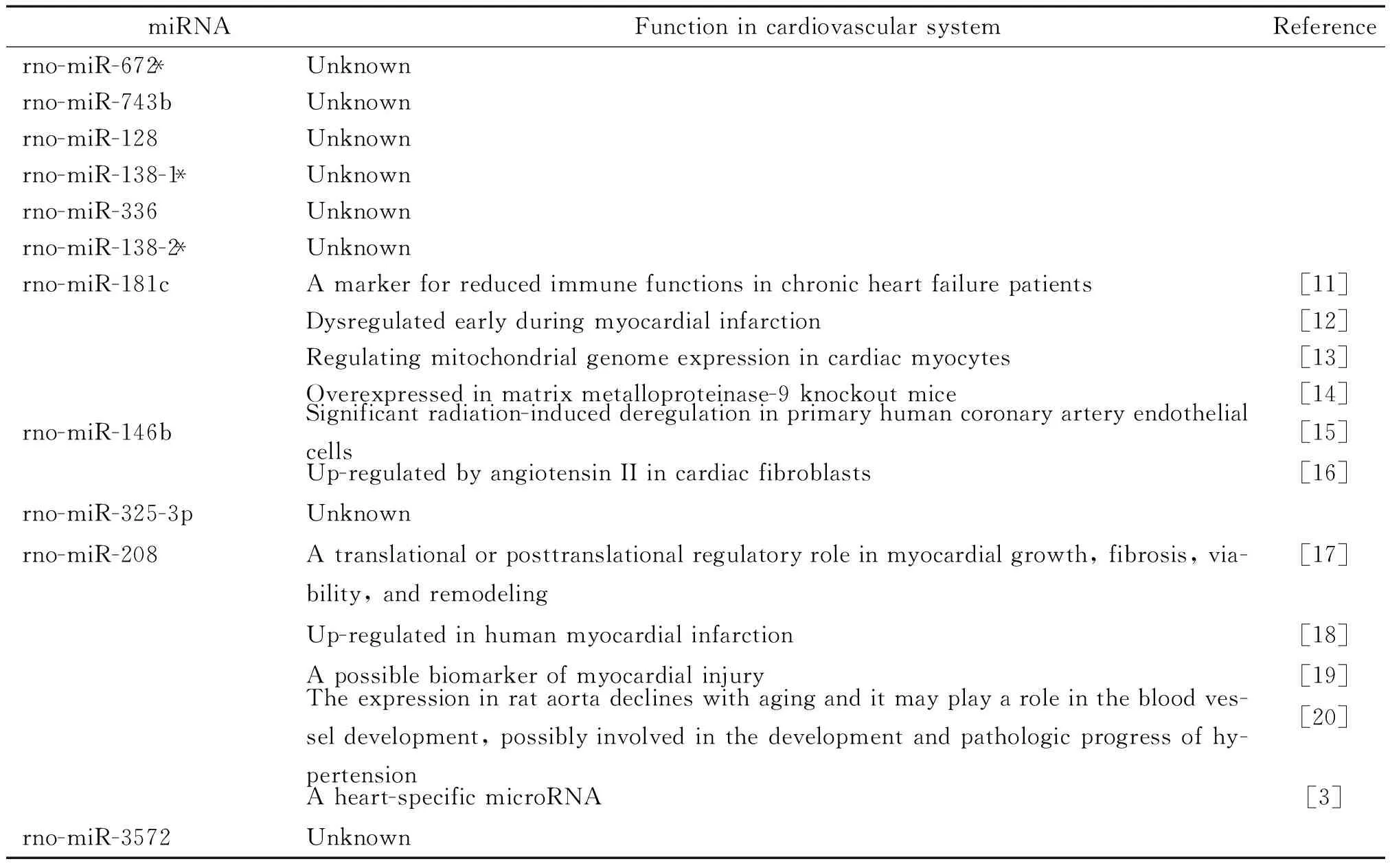
表3 差异表达的miRNAs在心血管系统中的功能分析
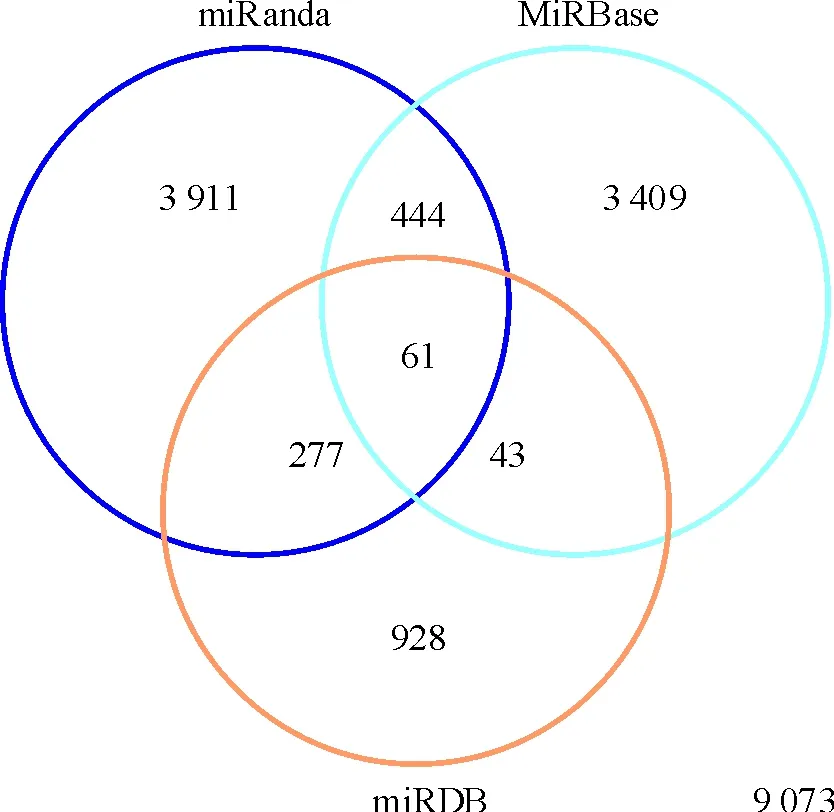
Figure 5. Distribution of the target genes of differentially expressed miRNAs in ischemic myocardium from AMI rats in three databases, including miRanda, miRBase and miRDB.
图5miRNA靶点在miRanda、miRBase和miRDB3个数据库中的分布
表4在miRanda、miRBase和miRDB3个数据库中均出现的miRNA靶点列表
Table 4. Target genes of differentially expressed miRNAs from AMI rats listed in all three databases, including miRanda, miRBase and miRDB
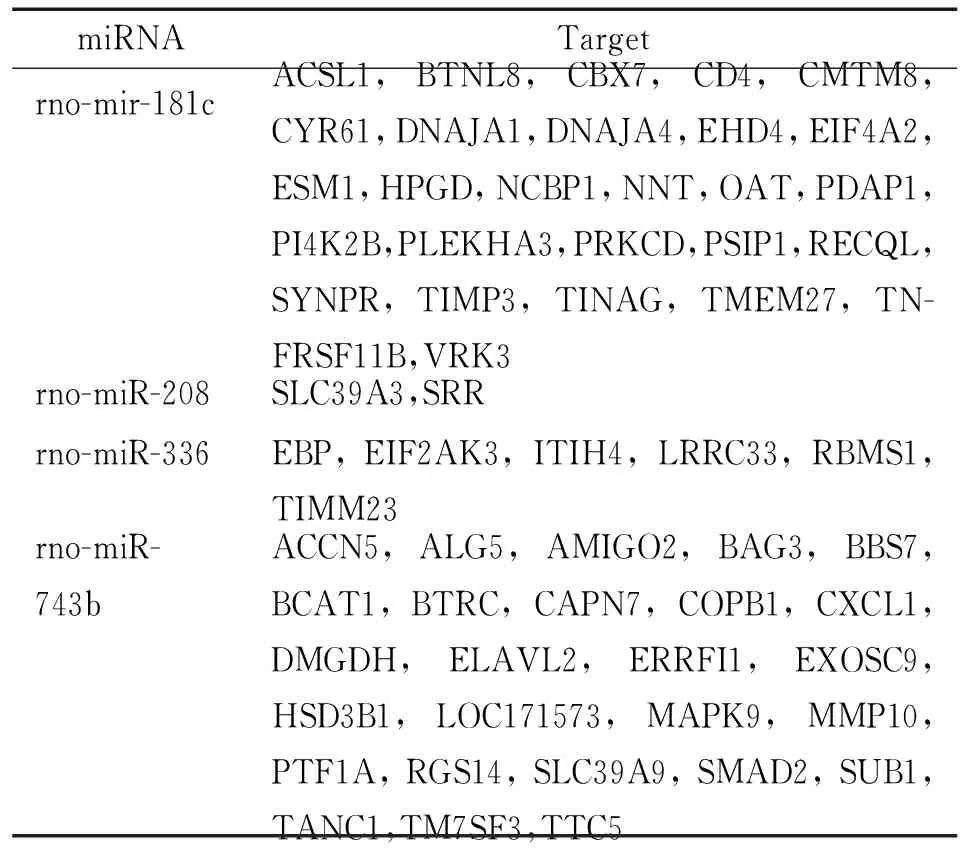
miRNATargetrno-mir-181cACSL1,BTNL8,CBX7,CD4,CMTM8,CYR61,DNAJA1,DNAJA4,EHD4,EIF4A2,ESM1,HPGD,NCBP1,NNT,OAT,PDAP1,PI4K2B,PLEKHA3,PRKCD,PSIP1,RECQL,SYNPR,TIMP3,TINAG,TMEM27,TN-FRSF11B,VRK3rno-miR-208SLC39A3,SRRrno-miR-336EBP,EIF2AK3,ITIH4,LRRC33,RBMS1,TIMM23rno-miR-743bACCN5,ALG5,AMIGO2,BAG3,BBS7,BCAT1,BTRC,CAPN7,COPB1,CXCL1,DMGDH,ELAVL2,ERRFI1,EXOSC9,HSD3B1,LOC171573,MAPK9,MMP10,PTF1A,RGS14,SLC39A9,SMAD2,SUB1,TANC1,TM7SF3,TTC5
讨 论
急性心肌梗死是临床的常见病和多发病,其发病率逐年升高。miRNAs参与急性心肌梗死的病理生理过程[5-6,10],并受到高度关注。miRNAs在急性心肌梗死的发生发展过程中其表达呈现时序性。van Rooij等[9]用miRNA芯片分析了在冠状动脉左前降支结扎所致大鼠心肌梗死模型中梗死心肌边缘区和远离区的miRNAs表达,发现在心梗后第3天,边缘区有17个miRNAs上调,远离区有12个miRNAs上调;而心梗后第14天则分别变为69个和40个上调。本研究成功制备了AMI大鼠模型,并观察了心梗后4 h的miRNAs表达谱,共获得11个差异表达的miRNAs。其中有3个miRNAs(rno-miR-181c、rno-miR-146b和rno-miR-208)参与了心血管功能的调节。如miR-208是心梗特有的miRNA,可作为心肌损伤的分子标志物[19],在心梗病人中表达上调[18]。而我们发现rno-miR-208在心梗后4 h表达下调,该结果说明了miRNA在心梗的发生发展过程中呈现动态变化。
miRNAs是一类对蛋白表达具有转录后调控作用的内源性非编码单链小分子RNA,分析心肌梗死相关的差异表达miRNAs对了解其功能非常重要。我们将获得的11个差异miRNAs对miRanda、miRBase和miRDB 3个数据库进行搜索后,获得了共9 037个miRNA靶基因,通过对部分靶基因进行功能搜索后发现,它们中有一些参与了心血管功能的调节,如rno-miR-743b 的靶基因之一CXCL1在白细胞介素1刺激的心脏成纤维细胞中高表达[21],而心脏成纤维细胞在缺血心肌修复中具有重要的作用[22-23]。而本研究获得的几个miRNAs及其靶基因(数据未显示)与心血管功能尤其是在AMI的相关性均未见报道,如rno-miR-672*、rno-miR-128、rno-miR-138-1*、rno-miR-336、rno-miR-138-2*、rno-miR-325-3p和rno-miR-3572,它们可能是AMI发生发展的早期的新的分子标志物,且其功能有待进一步研究。同时对所有靶基因进行了GO分类,这些靶基因主要参与了细胞过程、代谢过程和生物调节等生物过程,主要由胞内组分、胞内细胞器和膜结合组分等细胞组分构成,而其功能涉及到蛋白结合、催化和水解酶活性等,这从总体上反映了AMI过程中miRNAs及其调控的基因网络的变化。
总之,本研究通过对AMI大鼠的缺血早期的心肌进行miRNA芯片筛选,获得了11个差异表达miRNAs,除了已报道的参与了心血管功能的部分miRNAs外,我们还发现了几个新的与AMI有关的miRNAs。但这些miRNAs的靶点是什么,它们在心肌缺血状态下是如何影响靶蛋白的表达,继而影响缺血心肌的结构和功能,我们将在细胞分子水平进一步阐明它们在心肌缺血中的作用及机制,为防治和减轻心肌缺血性损伤提供更多的实验依据。
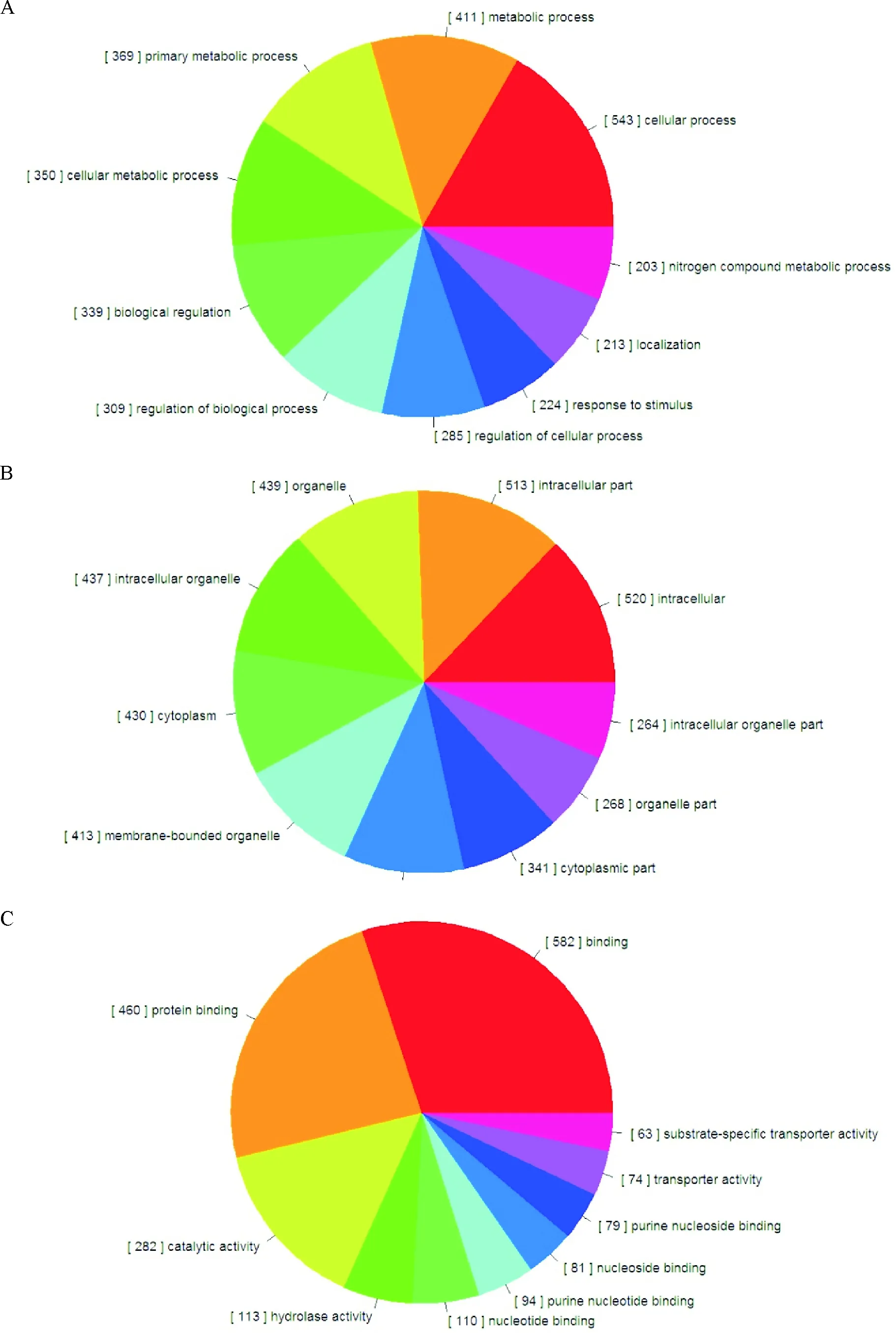
Figure 6. Distribution of the target genes of differentially expressed miRNAs in ischemic myocardium from AMI rats using Gene Ontology method. A:biological process;B:cellular component;C:molecular function.
图6miRNA靶基因的GO分类
[1] Lagos-Quintana M, Rauhut R, Yalcin A, et al. Identification of tissue-specific microRNAs from mouse [J]. Curr Biol, 2002, 12(9): 735-739.
[2] van Rooij E, Sutherland LB, Liu N, et al. A signature pattern of stress-responsive microRNAs that can evoke cardiac hypertrophy and heart failure [J]. Proc Natl Acad Sci U S A, 2006, 103(48): 18255-18260.
[3] van Rooij E, Sutherland LB, Qi X, et al. Control of stress-dependent cardiac growth and gene expression by a microRNA [J]. Science, 2007, 316(5824): 575-579.
[4] Zhao Y, Ransom JF, Li A, et al. Dysregulation of cardiogenesis, cardiac conduction, and cell cycle in mice lacking miRNA-1-2 [J]. Cell, 2007, 129(2): 303-317.
[5] Shan ZX, Lin QX, Fu YH, et al. Upregulated expression of miR-1/miR-206 in a rat model of myocardial infarction [J]. Biochem Biophys Res Commun, 2009, 381(4): 597-601.
[6] Shi B, Guo Y, Wang J, et al. Altered expression of microRNAs in the myocardium of rats with acute myocardial infarction [J]. BMC Cardiovasc Disord, 2010, 10: 11.
[7] 魏 聪,胡 兵,申 锷. MicroRNAs 在心脏发育和疾病中的作用[J].中国病理生理杂志,2011,27(3): 611-615.
[8] 唐 艳,王梦洪. microRNA-21 转染的心肌细胞移植对低温条件下心力衰竭大鼠的影响[J].中国病理生理杂志,2013,29(1): 1-8.
[9] van Rooij E, Sutherland LB, Thatcher JE, et al. Dysregulation of microRNAs after myocardial infarction reveals a role of miR-29 in cardiac fibrosis [J]. Proc Natl Acad Sci U S A, 2008, 105(35): 13027-13032.
[10] 王 珏,黄伟聪,郑亮承,等. MicroRNA-24 对心肌梗死后心肌细胞凋亡的调控作用[J].中国病理生理杂志,2013,29(4): 590-596.
[11] Seeger T, Haffez F, Fischer A, et al. Immunosenescence-associated microRNAs in age and heart failure [J]. Eur J Heart Fail, 2013,15(4): 385-393.
[12] Vogel B, Keller A, Frese KS, et al. Refining diagnostic microRNA signatures by Whole-miRNome kinetic analysis in acute myocardial infarction [J]. Clin Chem, 2013, 59(2): 410-418.
[13] Das S, Ferlito M, Kent OA, et al. Nuclear miRNA regulates the mitochondrial genome in the heart [J]. Circ Res, 2012, 110(12): 1596-1603.
[14] Mishra PK, Metreveli N, Tyagi SC. MMP-9 gene ablation and TIMP-4 mitigate PAR-1-mediated cardiomyocyte dysfunction: a plausible role of dicer and miRNA [J]. Cell Biochem Biophys, 2010, 57(2-3): 67-76.
[15] Barjaktarovic Z, Anastasov N, Azimzadeh O, et al. Integrative proteomic and microRNA analysis of primary human coronary artery endothelial cells exposed to low-dose gamma radiation [J]. Radiat Environ Biophys, 2013, 52(1): 87-98.
[16] Jiang X, Ning Q, Wang J. Angiotensin II induced differentially expressed microRNAs in adult rat cardiac fibroblasts [J]. J Physiol Sci, 2013, 63(1): 31-38.
[17] Zile MR, Mehurg SM, Arroyo JE, et al. Relationship between the temporal profile of plasma microRNA and left ventricular remodeling in patients after myocardial infarction [J]. Circ Cardiovasc Genet, 2011, 4(6): 614-619.
[18] Bostjancic E, Zidar N, Stajer D, et al. MicroRNAs miR-1, miR-133a, miR-133b and miR-208 are dysregulated in human myocardial infarction [J]. Cardiology, 2010, 115(3): 163-169.
[19] Ji X, Takahashi R, Hiura Y, et al. Plasma miR-208 as a biomarker of myocardial injury [J]. Clin Chem, 2009, 55(11): 1944-1949.
[20] Xu CC, Han WQ, Xiao B, et al. Differential expression of microRNAs in the aorta of spontaneously hypertensive rats [J]. Sheng Li Xue Bao, 2008, 60(4): 553-560.
[21] Turner NA, Das A, O’Regan DJ, et al. Human cardiac fibroblasts express ICAM-1, E-selectin and CXC chemokines in response to proinflammatory cytokine stimulation [J]. Int J Biochem Cell Biol, 2011, 43(10): 1450- 1458.
[22] Porter KE, Turner NA. Cardiac fibroblasts: at the heart of myocardial remodeling [J]. Pharmacol Ther, 2009, 123(2): 255-278.
[23] Turner NA. Therapeutic regulation of cardiac fibroblast function: targeting stress-activated protein kinase pathways [J]. Future Cardiol, 2011, 7(5): 673-691.
MicroRNAprofileanalysisofischemicmyocardialtissuesfromratswithacutemyocardialinfarction
WANG Hai-hua1, JIANG Yu-xin1, GAO Xin2, MIN Zhi-xue1, LIN Hao2, CUI Feng-juan1
(1DepartmentofPhysiology,2theFirstDepartmentofClinicalMedicine,WannanMedicalCollege,Wuhu241002,China.E-mail:wanghaihua9972@sina.com)
AIM: To identify differentially expressed microRNAs (miRNAs) in ischemic myocardial tissues from the rats with acute myocardial infarction (AMI) by miRNA array technique, and to predict their targets and analyze their functions using bioinformatics.METHODSThe rat models of AMI (n=3) were prepared by ligaturing the left anterior descending coronary artery (LAD) of Wistar rats. Electrocardiogram and blood pressure were detected during the operation, and the myocardial infarct size was measured by 2, 3, 5-triphenyltetrazolium chloride (TTC) staining. Ischemic myocardial tissues were isolated from the infarct area 4 h after ischemia. The same procedure in sham group (n=3) was performed except for ligaturing LAD. Total RNA was extracted from ischemic and normal myocardial tissues. miRNA was isolated from total RNA, labeled with Cy3 and hybridized on miRNA array. Real-time PCR was applied to verify the reliability of miRNA array results. The targets of differentially expressed miRNAs were predicted and their functions were analyzed by bioinformatics.RESULTSRat model of AMI was successfully prepared and verified by electrocardiogram detection, blood pressure measurement and pathological observation. Compared with sham group, microarray screening showed that total 11 AMI-related miRNAs were selected, including 6 up-regulated and 5 down-regulated. Three of them (rno-miR-181c, rno-miR-146b and rno-miR-208) were related to the cardiovascular functions, while the functions of the others (rno-miR-672*, rno-miR-743b, rno-miR-128, rno-miR-138-1*, rno-miR-336, rno-miR-138-2*, rno-miR-325-3p and rno-miR-3572) were unknown and might be novel AMI-related biomarkers. Parts of the miRNA targets were also related to the cardiovascular functions.CONCLUSIONDifferentially expressed miRNAs in AMI rats may serve as novel biomarkers for diagnosis of AMI and potential targets for treatment of AMI.
Acute myocardial infarction; MicroRNA; Expression profiles; Bioinformatics
R363
A
1000- 4718(2013)09- 1546- 08
2013- 05- 09
2013- 07- 12
国家自然科学基金资助项目(No.81172790);安徽省自然科学研究重点项目(No.KJ2013A251);皖南医学院重点科研项目培育基金资助项目(No.WK2012Z01)
△通讯作者 Tel: 0553-3932473; E-mail: wanghaihua9972@sina.com
▲并列第1作者
10.3969/j.issn.1000- 4718.2013.09.002

