苯并咪唑类PI3Kδ 抑制剂的3D-QSAR 研究
王 婷
(佳木斯市妇幼保健院,黑龙江佳木斯 154002)
PI3K 信号转导通路是许多生命活动中关键的信号分子,调节细胞的分裂、分化、凋亡等活动,可诱发卵巢癌、乳腺癌[1]、恶性胶质瘤[2]等多种癌症。如果对PI3K 进行抑制,去磷酸而使其降解,可以阻断Akt 及其下游效应分子的有效活化[3],从而抑制癌细胞的生长。因此,以PI3K为靶点进行的抗肿瘤药物研究近来备受关注。苯并咪唑类化合物尤其是ZSTK474 化合物对PI3Kδ 具有很强的抑制作用[4],是新型的PI3K 竞争性ATP抑制剂,在小鼠的体内实验中ZSTK474 显示出很强的抗肿瘤活性,毒性程度中等,可以口服[5]。目前,虽然已合成一些苯并咪唑类化合物,但是由于不清楚其构效关系,合成具有盲目性,实验量大,且抑制效果不显著。迄今为止,达到临床应用阶段的抑制剂还很少。通过三维定量构效关系(3D-QSAR)方法研究药物的三维定量构效关系,可以筛选能够提高配体化合物生物活性的取代基及取代位点,有目的地寻找最佳配体化合物结构,增加与受体结合的几率,提高药物研发的效率。
1 方法
1.1 模板选取与分子叠合
采用Sybyl8.1分子模拟软件包中比较分子力场分析法(CoMFA)的模块,根据文献[4]选取ZSTK474 等一系列对PI3Kδ 有活性作用的化合物共22个结构,分成两组训练集和预测集。以化合物ZSTK474 的结构作为模板分子,运用Tripos 力场对其晶体结构数据进行优化,优化时采用Powell 方法优化1000 轮,并采用Gasteiger-Hückel 法进行电荷计算。以+1 价sp3杂化的碳原子作为探针对分子力场进行计算,步长为0.2nm,其余参数均为缺省值。优化后的分子构象作为活性构象,其它化合物在模板分子的基础之上进行取代基变换再优化,并且也采用分子力学方法,选用Tripos 力场优化,得到各个分子的稳定构象。叠合时选取苯并咪唑环结构作为公共骨架(图1),将所有化合物的公共部分均与模板分子的基本骨架相重叠(图2)。

图1 公共骨架结构
1.2 CoMFA 模型的建立
叠合后采用偏最小二乘法进行分析(PLS)。将叠合好的分子结构放置于一个三维的网格中,采用Tripos标准力场,力场类型为立体场和静电场。分子力场计算以+1 价sp3杂化的碳原子作为探针,步长为0.2 nm,其余参数均为缺省值。交叉验证采用leave-one-out(LOO)模式,得到相应的最佳组成分数n和交叉验证系数q2。一般认为,交叉验证系数q2值大于0.5时,模型具有可信的预测能力。接着通过已获得的最优组分数通过非交叉验证进行回归计算,建立相应的CoMFA 模型,并采用stdev* coeff 的方法来显示三维等值线图。

图2 (a)模板分子(化合物ZSTK474)和(b)苯并咪唑类化合物分子叠合图
2 实验结果
2.1 CoMFA 模型
统计学参数如下:q2=0.702,最佳组分数n=4。建立CoMFA 模型的结构及活性值见表1。传统相关系数r2=0.981,F=104.661,标准偏差SD=0.211。立体场(S)和静电场(E)的贡献分别是0.393和0.607。

表1 ZSTK474 系列化合物分子结构及其PI3Kδ 抑制活性值
2.2 CoMFA 模型的三维等值线图
比较分子场分析(CoMFA)模型中包括立体场和静电场,主要用来分析化合物中立体空间和正负电荷对取代基团所产生的影响。CoMFA 模型立体场和静电场(以化合物ZSTK474为参考分子)的三维等值线图,如图3。绿色和黄色彩块代表立体场特征,绿色模块表示在该区域增大取代基的体积有助于增加化合物的生物活性,而黄色模块则说明在该区域加入小体积的基团将有助于提高化合物的生物活性。蓝色和红色彩块代表化合物的静电场特征,蓝色模块表明增加正电性基团有助于提高化合物的生物活性,而红色模块则代表增加负电性基团有助于化合物生物活性的提高。

图3 (a)立体场的三维等值线图(化合物ZSTK474)和(b)静电场的三维等值线图(化合物ZSTK474)
2.3 QSAR 模型的验证
使用训练集所建立的CoMFA 模型,对训练集和预测集中的分子结构进行活性预测,从而验证已经建立模型的稳定性和预测能力。其中,17个训练集化合物和5个预测集化合物的预测数据值及其实验结果值均列于表2。图4 列出了化合物活性的预测值和实验值的相关图,所有数据都分布在直线的两侧,相关系数值是0.981,大于0.900,这说明所构建的模型具有较好的相关性。结果证明此模型具有较好的预测能力,则设计新型药物结构时,能够用来预测和苯并咪唑类分子结构相似的化合物的生物活性。
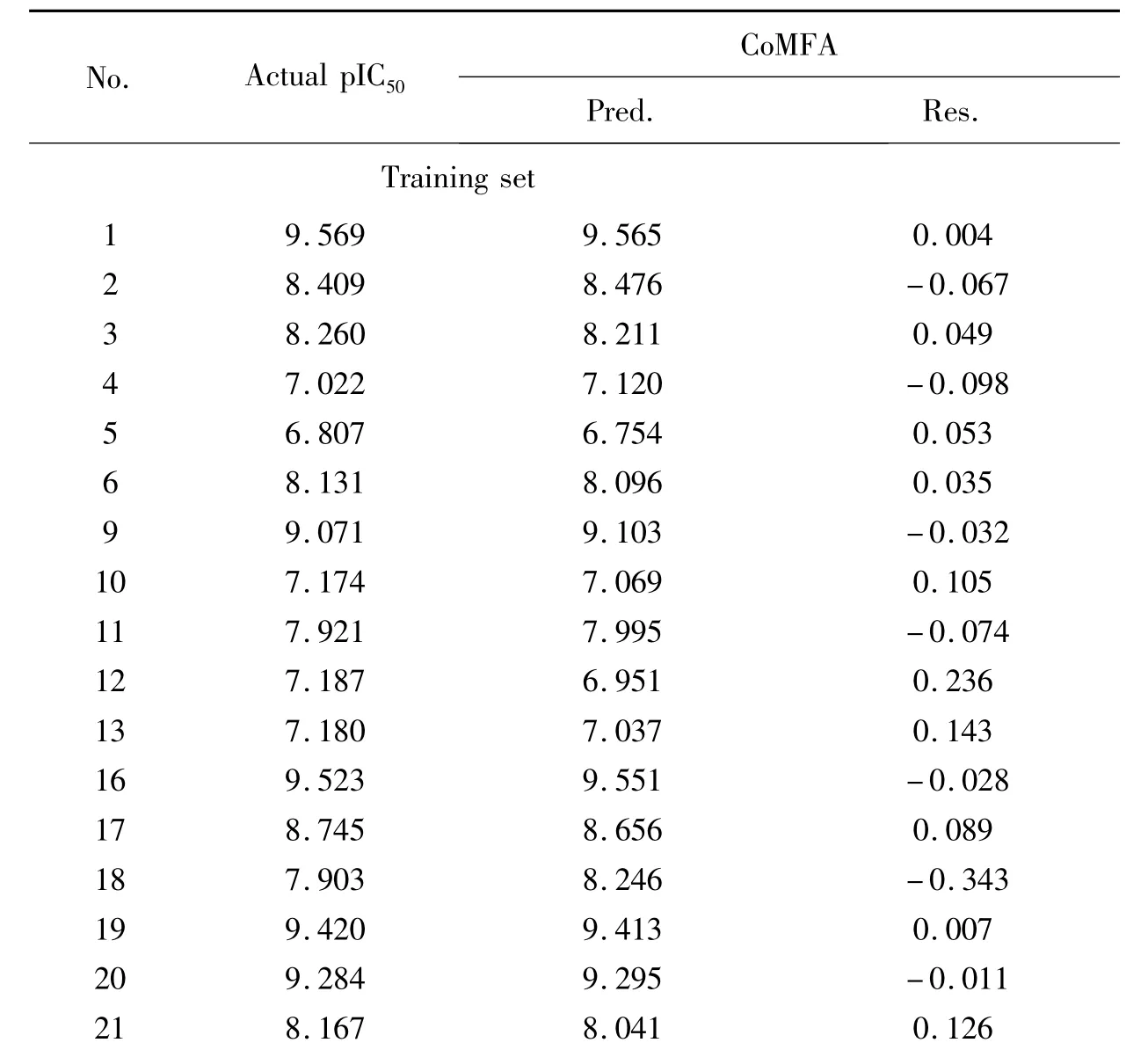
表2 CoMFA 模型中化合物活性的实验值、预测值及其差值
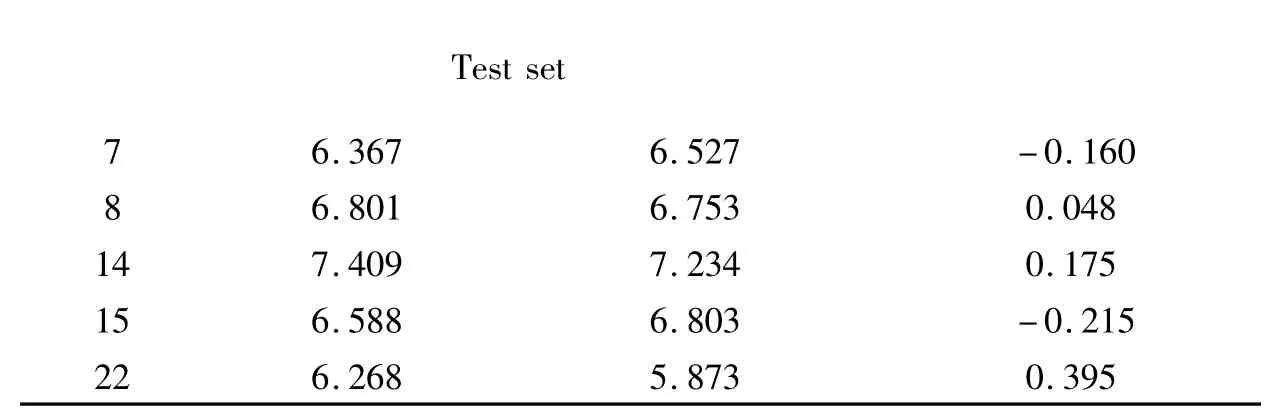
Residual=pIC50(Act.)-pIC50(pred.)
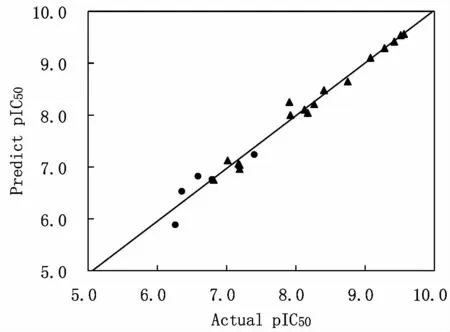
4 CoMFA 模型中活性的预测值与实际值对比曲线
3 讨论
苯并咪唑类PI3Kδ 抑制剂的3D-QSAR 研究表明,CoMFA 模型的交叉验证相关系数为0.702,大于0.5,模型具有较好的预测能力;非交叉验证回归得到的PLS 结果,拟合的相关系数为0.981,大于0.900,模型具有较好的相关性。可将苯并咪唑母环的4 位修饰成小体积、正电性基团;在6 位由大体积、负电性的基团进行取代,以提高抑制剂的生物活性。以上关于结构修饰的2个条件可单独存在,亦可同时满足。本文的研究结果对此类抑制剂的研制和开发具有重要的指导意义。
[1]Douglas A L,Faina B,Cindy J Y,et al.Frequent mutation of the PIK3CA gene in ovarian and breast cancer[J].Clin Cancer Res.2005,11(8):2875-2878.
[2]Knobbe C B,Kieslich A T,Reifenberger G.Genetic alteration and expression of the phosphoinositol-3-kinase/Akt pathway genes PIK3CA and PIKE in human glioblastomas[J].Neuropathol Appl Neurobiol,2005,31(5):486-490.
[3]Sharrard R M,Norman J M.Regulation of protein kinase B activity by PTEN and SHIP2 in human prostate-derived cell lines[J].Cell Signal,2007,19(1):129-138.
[4]Gordon W.Rewcastle,Swarna A.Gamage,Jack U.Flanagan,et al.Synthesis and Biological Evaluation of Novel Analogues of the Pan Class ⅠPhosphatidylinositol 3-Kinase(PI3K)Inhibitor 2-(Difluoromethyl)-1-[4,6-di(4-morpholinyl)-1,3,5-triazin-2-yl]-1H-benzimidazole (ZSTK474)[J].Journal of Medicinal Chemistry,2011,54:7105-7126.
[5]Yaguchi S,Fukui Y,Koshimizu I,et al.Antitumor activity of ZSTK474,a new phosphatidylinositol 3-kinase inhibitor[J].J Natl Cancer Inst,2006,98(8):545-556.

