EMS 诱发菊花突变类型及重要性状的分子鉴定
蔡海燕,温立柱,郑成淑*,李莹莹,2,孙 霞,孙宪芝
(1.山东农业大学园艺科学与工程学院,山东 泰安 271018;2.菏泽学院园林工程学系,山东 菏泽 274015)
菊花(Chrysanthemum morifolium)是我国传统名花,也是世界四大切花之一,其产量和销量均位于世界花卉前列[1]。然而,由于菊花基因背景复杂,染色体倍数变化较大(2~8 倍),而栽培品种的染色体倍数大多在4 倍以上,传统的杂交育种和转基因育种均受到一定的限制[2,3]。
EMS 是一种有效的化学诱变剂,使用其诱变可以产生丰富的突变体,无需遗传转化,即可快速获得一些不同性状的新的优良种质资源,而且其作用是诱发点突变,不易对染色体造成畸变,稳定性好,因而被广泛的用于构建突变类型。目前利用EMS 诱变剂已在小麦[4]、油菜[5]、拟南芥[6]、水稻[7]等多种植物中成功构建了各种突变类型,并已用于新品种培育和功能基因组学的研究中。
菊花属异花授粉植物,杂交后代结实率和出芽率均较低,很难出现较理想的杂交变异或自然变异。利用EMS 诱变菊花可短期内产生大量的变异类型,但相关研究迄今鲜见报道。因此,本试验利用EMS 诱变剂处理菊花茎尖,以其M1代无性系的突变体株系为材料,对其突变类型进行鉴定分析,结果将对培育优良观赏性状的菊花新品种和菊花功能基因组学研究具有重要意义。
1 材料与方法
1.1 试验材料
供试材料为长势均匀一致、健壮、高约15 cm 的菊品种‘神马’。
1.2 试验方法
试验于2011年开始进行。用0%(对照)、0.05%、0.1%、0.2%、0.4%和0.6%甲基磺酸乙酯(EMS)处理菊花茎尖。EMS 滴于植株茎尖的棉团上。待棉团将干时重复操作。6 h 后,移去棉团,用10% NaS2O3溶液涂抹茎尖终止诱变反应,再用流水冲洗。在茎尖内侧用红色油性笔留下标记。待植株从标记的部位向上长约8 cm 时,取插穗(约8 cm),进行扦插,生根后移栽。对照单独定植于一个畦上。对照与处理统一浇水、施肥、打药。从EMS 处理后每天观察植株各部位的变化,随时记录和拍照各种变异类型。
1.3 DNA 提取及ISSR 分析
取早花的花蕾及黄绿色的花蕾作为提取DNA 的材料。采用试剂盒(天根生物科技有限公司生产)法提取DNA。
引物选用前人文献中筛选出的;PCR 扩增的反应体系为20μL,扩增程序为:94℃预变性5 min;94℃变性45 s,55℃复性40 s,72℃延伸70 s,45个循环;72℃延伸7 min,4℃保存。扩增反应结束后,取5μL扩增产物在2.0%琼脂糖凝胶上电泳,溴化乙锭染色,照相。
1.4 测量与计算方法
株高测量:待植株营养生长停止后进行株高测量。
花期测定:花蕾期(花蕾直径约0.2 cm)、初开期(花朵开始露白)和盛开期(花朵半开)。
突变率计算:表型突变率=(总变异株数/EMS 处理后成活的总株数)×100%;叶片突变率=(总叶片变异株数/EMS 处理后成活的总株数)×100%;花瓣突变率=(总花瓣变异株数/EMS 处理后成活的总株数)×100%;以此类推。
2 结果与分析
2.1 株高变化
对照的菊花株高为108.21 cm(图1-CK)。EMS 诱变的菊花株高突变体中平均株高为18.81 cm,其中,株高最高的达58.3 cm,最低为8.0 cm(图1-1-3)。株高低于10 cm 的有92株,高于20 cm 的有160株。大多数突变体株高在12~16 cm 之间。
2.2 叶片变化
在叶片突变体中共观察到64株发生了变异,叶片突变频率为1.45%,包括叶片形态突变体和叶片颜色突变体,其中变化最大的叶片由原来的单叶变为复叶(图2-4)。未见全株叶片都发生突变的植株。
2.2.1 叶片形态变化 (1)叶的整体形态变化:对照叶形为近卵形(图2-CK),而突变体中发现了披针形叶(图2-4、6),近圆形叶(图2-7、8、12),非对称叶片,叶片一侧部分缺失(图2-9);(2)叶缘变化:对照的叶缘多锯齿(图2-CK),突变体中发现了全缘形(图2-5、7、8、10、12),牙齿状(图2-1),波浪状(图2-2、4)的叶缘;(3)叶裂变化:对照的叶裂形态属深裂形,有两对对称的深裂沟。突变体中出现了叶片只有一对深裂沟(图2-3、11),叶片呈浅裂形(图2-9),叶片无明显的裂沟或者全无裂沟(图2-1、2、7、10);(4)叶尖变化:对照叶片的叶尖为渐尖形。在突变体中发现了锐尖(图2-1、2、3、12),钝尖(图2-5、8),截形或呈一直线(图2-7),凹形(图2-10)的叶尖;(5)叶基变化:对照叶片的叶基为心形,而突变体中的叶基则呈耳垂形(图2-3)、楔形(图2-7、8)、偏斜(图2-5)和圆形等(图2-10)。叶基的形状主要有8 种,而突变体中新出现的叶基有4 种;(6)叶脉变化:对照叶片的叶脉清晰明显,主脉大致成一直线位于整个叶片的中间。突变体中发现了主脉偏于叶片的一侧,其中一种叶脉不明显(图2-8),另一种叶脉的主脉呈弧形(图2-6)。
2.2.2 叶片颜色变化 发现叶片颜色突变体共12株,突变频率为0.27%。表现为叶片基部发黄,并沿主脉向叶片边缘黄色逐渐变淡,最后消失(图2-10);叶片边缘泛黄,向内黄色逐渐变淡,主脉及各侧脉颜色发绿(图2-11);黄斑不均匀的散布于整个叶片表面(图2-12)。

图1 菊花‘神马’株高的突变体形状Fig.1 Phenotype of plant height mutants

图2 菊花‘神马’叶片突变体形状Fig.2 Phenotype of the leaf mutants of chrysanthemum‘Jinba’of chrysanthemum‘Jinba’
2.3 花期变化
‘神马’属典型的短日照植物,在每天连续黑暗大于13 h 的条件下才能形成花蕾进而开花。山东地区‘神马’的花期一般在10月下旬。本试验中出现了159株花期提早的突变体,突变频率为3.59%。1株突变体在6月5日,即定植后的第34 d 就形成小花蕾(表1)。7月6日,有1株突变体花蕾已露白,进入初开期。最早进入盛开期的1株突变体的日期为7月18日,但从7月18日至8月1日期间只有23株花朵完全正常开放。此结果说明EMS 诱变的菊花突变体不必经过短日照,在长日照下也可进行花芽分化,并正常开花。
其余未正常开放的原因是:有些花蕾发育过程中凋萎;有些花朵初开期中外轮花瓣就开始枯萎,以致花不能正常开放。这可能是由于EMS 引起了菊花细胞染色体畸变,对植株造成一定的生理损伤,以致不能正常开花。
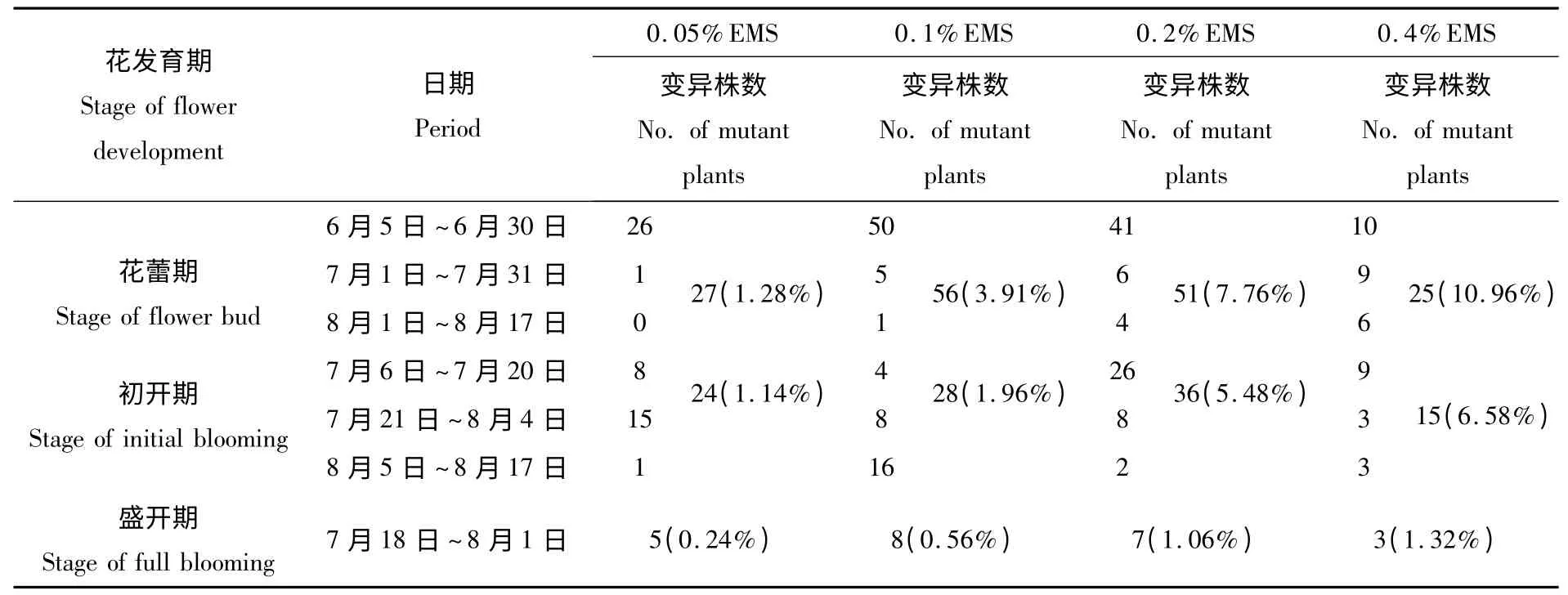
表1 EMS 诱变菊花‘神马’花提早发育情况Table 1 Early flower development of chrysanthemum ‘Jinba’induced with EMS
2.4 花器官变化
菊花的花属于头状花序,包括花苞、舌状花、筒状花、雄蕊和雌蕊等部分。该突变体中共发现233株花器官突变体,突变频率为5.27%。
2.4.1 花蕾变化 花蕾突变体包括花蕾形状突变、花蕾颜色突变和花蕾败育。
(1)花蕾形状变化 共发现12株,突变频率为0.27%。与对照花蕾形状(图3-A-CK)相比,突变中出现了:花蕾分为上、下2 层,整体呈扁圆形(图3-A-1)和圆柱形(图3-A-2);花蕾倒圆锥形(图3-A-3);花蕾呈圆球形(图3-A-4)。
(2)花蕾颜色变化 共发现8株花蕾颜色变化,突变频率为0.18%。一种变异类型为花蕾呈紫色(图3-A-5),另一种变异类型为花蕾呈黄绿色(图3-A-6)。
(3)花蕾败育 共发现16株花蕾败育,突变频率为0.36%。花蕾形成不久枯萎,内部舌状花和管状花褐化,雌蕊和雄蕊消失(图3-A-7-8)。
2.4.2 头状花序变化 包括以下几种。
(1)花苞变化 共发现16个植株的花苞发生了突变,突变频率为0.36%。与对照相比(图4-B-CK),花苞突变分别表现为:外轮花苞片叶片化(图4-B-1);两轮相邻的花苞片之间彼此分离,形成较大的空腔(图4-B-2);外轮花苞片上密被白色丝状物(图4-B-3);花苞上覆有白色透明黏液物(图4-B-4)。
(2)花序变化 共发现185株花序突变,突变频率约为4.18%。与对照相比(图4-C-CK),花序突变有以下不同表现:花序盘中出现花苞片,且其着生位置不确定,数量多少不等(图4-C-1-5);花序盘中花苞片发育不良或缺失,花序呈部分外露(图4-C-6-8)或全露(图4-C-9);花序部分缺失(图4-C-10);舌状花与管状花缺失(图4-C-11-12)。

图3 EMS 诱变菊花‘神马’花蕾突变体Fig.3 The flower bud mutants of chrysanthemum'Jinba'induced by EMS

图4 EMS 诱发菊花花苞及花序突变体类型Fig.4 Phenotype of the involucres and inflorescences mutants of chrysanthemum 'Jinba'induced by EMS
(3)舌状花变化 共发现舌状花突变体92个(57株),突变频率为2.08%。与对照(图5-CK)相比,出现了以下3 种变化类型:①舌状花形状变化 包括以下几种类型:舌状花体积变小(图5-a-1);舌状花变宽,有的有花柄(图5-a-2~5);舌状花的基部有较小的花瓣(图5-b-2~4)。另外,有的舌状花基部出现萼片(图5-b-1)。②舌状花筒状 一种是整个舌状花都合生成筒状(图5-c-1),另一种是舌状花的中下部合生成筒状,上部开裂(图5-c-2~5)。③舌状花中的雌蕊败育 舌状花内雌蕊败育,但出现一个叶芽(图5-d-1)或完整的花盘(图5-d-2)或正常形态花蕾(图5-d-3),并且叶芽能继续发育长出多个小叶(图5-d-4)。
2.5 分子鉴定
引物引物(CAC)3GC 对早花突变体的ISSR-PCR 扩增结果显示,处理植株的DNA 扩增条带与对照相比存在差异性条带(图6)。与对照不同,突变体无500 bp和2000 bp 位点的条带。初步推断这些突变体植株的早花特性可能是由菊花基因组中开花相关基因发生了突变引起。这说明早花特性不是环境因素造成,而是由于基因突变所致。
引物(CA)6GT 对黄绿色部位提取的DNA 扩增结果显示,突变体比对照多了一条约300 bp 大小的条带(图7)。表明突变体与对照的基因存在差别,此突变也是基因型突变。
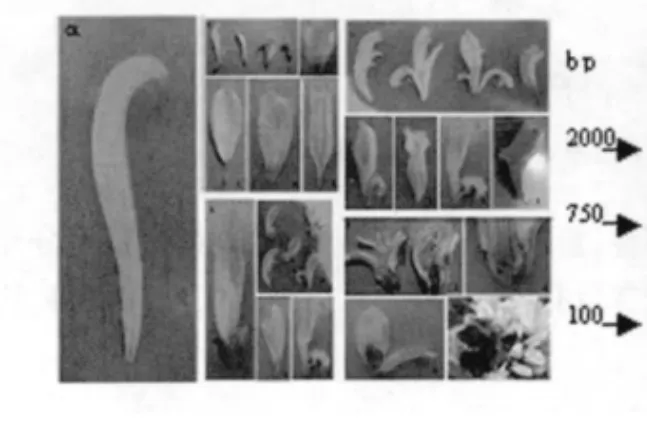
图5 菊花‘神马’舌状花突变体Fig.5 The lingulate flower mutants of chrysanthemum 'Jinba'
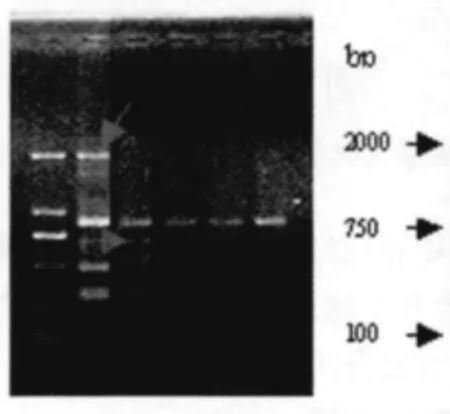
图6 对早花突变体的扩增结果Fig.6 Amplification rusults of early flowering mutant
图7 黄绿色花蕾突变体的扩增结果Fig.7 Amplification rusults of chartreuse bud mutant
3 讨论
本试验用EMS 处理‘神马’,共成活4423株。对成活的M1株系进行株高、叶片、花期、花苞、花蕾、花瓣等重要观赏性状进行调查和统计发现,共有279株发生了不同程度的变化,其表型变化频率达到6.31%。这说明在同一遗传背景下EMS 诱导菊花变异类型丰富多样。且成功获得了花期提早突变体植株,分子鉴定结果也表明其基因发生了变异。这为将来菊花开花基因调控机制研究和相关功能基因的克隆和分析提供了良好的基础材料。
EMS 诱发基因点突变。可对某一特定性状改良,例如,提高烟草叶片的产量[8],提高草菇的耐寒性[9]。虽然EMS 诱变产生的不良突变较多,但从本试验所获得的突变体中也获得了一些优良的菊花突变体性状,如上述的黄绿色花蕾、提前开花等性状的突变体,并且控制这些优良性状的基因源于人工诱变,与来自自然变异的基因或等位基因不同,是一种新的优异基因,在其后代若通过特异性、一致性和稳定性鉴定,有可能作为新的品种进行商品化生产。随着研究的深入,控制这些优良性状的基因将会不断被发现,并为菊花分子育种提供理想的材料。
[1]王文利,王秀峰,郑成淑,等.A23187和EGTA 对光周期诱导菊花成花及其过程中叶片Ca2+分布和碳水化合物的影响[J].应用生态学报,2010,21(3):675-682
[2]Dowrick GJ.The chromosomes of chrysanthemum.I:the species[J].Heredity,1952,6,365-375
[3]李 畅,陈发棣,赵宏波,等.切花菊14个品种的核形态学研究[J].园艺学报,2007,34(5):1235-1242
[4]赵天祥,孔秀英,周荣华,等.EMS 诱变六倍体小麦偃展4110 的形态突变体鉴定与分析[J].中国农业科学,2009,42(3):755-764
[5]孙加焱,涂进东,范叔味,等.甘蓝型油菜理化诱变和突变体库的构建[J].遗传,2007,29(4):475-482
[6]McCallum CM,Comai L,Greene EA,et al.Targeted screening for induced mutations[J].Nature Biotechnology,2000,18(4):455-457
[7]Hu LF,Tan HX,Liang WQ,et al.The Post-meiotic Deficicent Anther1 (PDA1)gene is required for post-meiotic anther development in rice[J].Journal of Genet Genomics,2010,37:37-46
[8]Reddy TV,Dwivedi S,Sharma NK.Development of TILLING by sequencing platform towards enhanced leaf yield in tobacco[J].Industrial -Crops Products,2012,40:324-335
[9]Liu Z,Zhang K,Lin JF,et al.Breeding cold tolerance strain by chemical mutagenesis in Volvariella volvacea[J].Scientia Horticulturae,2011,130(1):18-24

