电化学发光免疫传感器检测相思子毒素研究*
刘 冰,童朝阳,郝兰群,穆晞惠,刘 威,黄启斌
(防化研究院国民核生化灾害防护国家重点实验室,北京 102205)
0 引言
电化学发光(electrochemiluminescence,ECL)是一种电化学反应引起化学发光的现象,具有操作简便、灵敏度高、背景信号低、易于控制等特点。免疫磁性微球分离技术通过免疫反应与磁性微球的分离作用能从复杂的生物样品中特异性捕获并分离被检抗原或抗体。近年来,磁免疫分离和电化学发光分析方法不断发展,二者结合的磁免疫电化学发光分析方法已被用于检测一些抗原、抗体和半抗原[1~4],尤其是临床医学检验上。
相思子毒素(abrin)来源于豆科植物相思子种子,是一种Ⅱ型核糖体失活蛋白,其结构、作用机理与蓖麻毒素(ricin)类似,毒性超过ricin,属剧毒生物毒素,可以作为潜在的生物战剂被恐怖分子使用,近几年已引起广泛关注,建立快速、灵敏的检测方法极为必要。已经建立的酶联免疫吸附测定(ELISA)[5~8]、平板上的 ECL[7]、分子生物学(定量PCR、免疫PCR)[9]等方法灵敏度高,但耗时较长;胶体金免疫层析[10~12]、压电免疫传感器[13]等速度较快 但灵敏度稍低。
本研究将磁免疫分离技术、生物素—亲和素系统(BAS)的放大作用、多抗的强富集能力以及三联吡啶钌[Ru(bpy]标记单抗的高度特异性结合起来,建立了一种操作简便、响应快速、灵敏度高的磁免疫电化学发光传感检测方法,为临床诊断、环境监测、食品卫生检验及生物反恐等应用领域提供技术基础和参考依据。
1 实验
1.1 试剂与仪器
磁免疫电化学发光传感检测平台(本实验室与西安瑞迈分析仪器有限责任公司联合研制);MPI—E型电化学发光检测仪(西安瑞迈分析仪器有限责任公司);BIOMATE 3S紫外可见分光光度计(赛默飞世尔科技);HS—3垂直混合器(宁波新芝生物科技股份有限责任公司);磁分离架(Promega公司)。
1.2 实验方法
1.2.1 发光探针制备
按照文献[14,15]方法稍有改动,将1 mg abrin单抗溶于 582 μL 碳酸盐缓冲液(0.05 mol/L,pH=9.6),加入380 μL Ru(bpy-ester(8.76 × 10-4mol/L),再加入 38 μL二甲基亚砜(DMSO),37℃避光振荡孵育12 h。超滤除去未结合的 Ru(bpy-ester,用磷酸盐缓冲液(PBS,0.01 mol/L,pH=7.4)重悬至 1 mL,备用。
1.2.2 捕获探针制备
1)abrin多抗生物素化
用1 mL DMSO溶解活化生物素1 mg,向1 mL abrin多抗溶液(1 g/L)中加入120 μL活化生物素溶液(即含活化生物素120 μg);在室温下持续搅拌,保温 2~4 h;加入9.6 μL 1 mol/L NH4Cl(每 25 μg 活化生物素加 1 μL),在室温下搅拌10 min;4℃充分透析,以除去游离的生物素,以PBS重悬至1 mL。
2)磁微球捕获探针构建
将生物素化的abrin多抗20 μL加入1 mL(1 g/L)亲和素包被的磁微球中,室温振荡孵育1 h,置于磁分离架上用PBST(含1.5%Tween—20的 PBS)清洗2次,PBS清洗 2次除去未结合的abrin多抗,余下结合了abrin多抗的磁微球,加PBS重悬至1 mL,4℃保存备用。
1.2.3 ECL 检测
将abrin多抗包被的磁微球50μL和50μL样品混合后室温振荡孵育15 min,用 PBS磁分离清洗2次,再加入Ru(bpy-ester标记的abrin单抗50 μL(20 mg/L)共同振荡孵育15min,PBS磁分离清洗以除去未结合的标记探针,用发光检测液重悬后加入检测池,磁微球在磁铁作用下沉积在工作电极表面,在1.4 V恒电位下,标记在abrin单抗上的Ru(bpy就和发光检测液中的三丙胺(TPA)反应,产生光子,光信号由光电倍增管检测。实验原理如图1所示。
图1 相思子毒素电化学发光检测原理Fig 1 Principle of ECL detection on abrin
1.2.4 传感器电极表面再生
ECL检测反应完成后,将磁铁位置移至电极远端,先用去离子水冲洗检测池,流动注入CleanCell清洗液,反复运行电化学阶跃脉冲,再用去离子水反复冲洗,直至注入Pro-Cell发光检测液后,ECL响应值恢复至基线水平。
2 结果与讨论
2.1 发光探针性质
2.1.1 发光探针紫外—可见光谱
如图2所示,abrin单抗标记后紫外—可见光谱发生改变,a为abrin单抗光谱图,在280 nm处有一个特征吸收峰,是蛋白特征峰;b为标记物Ru(bpy)-NHS ester的图谱,联吡啶钌在220~600 nm之间有3个特征吸收峰,其中,可见光457 nm处的吸收对应于金属Ru(II)到bpy配体dπ→π*电荷跃迁,紫外区287 nm处的吸收是以配体为中心的π→π*跃迁,紫外区的另一个吸收峰在245 nm处,也是金属Ru(II)到 bpy配体的 dπ→π* 电荷跃迁[10];c标记abrin单抗的光谱图,位于286 nm和457 nm处均为联吡啶钌的特征吸收,这表明Ru(bpy)-NHS ester已经标记到abrin单抗上。

图2 标记探针的紫外—可见(UV-Vis)光谱Fig 2 UV-Vis spectrum of labeled probe
2.1.2 发光探针电化学发光性质
在发光检测液中,利用循环伏安法对标记探针进行扫描,结果如图3所示。可见Ru(bpy)标记到abrin单抗上后,仍然有较强的电化学发光信号,峰电位保持不变,仍在1.4 V附近,保持了Ru(bpy的电化学发光特性,标记abrin单抗可以用作电化学发光探针。
2.2 传感器的响应特性
2.2.1 线性与检出限
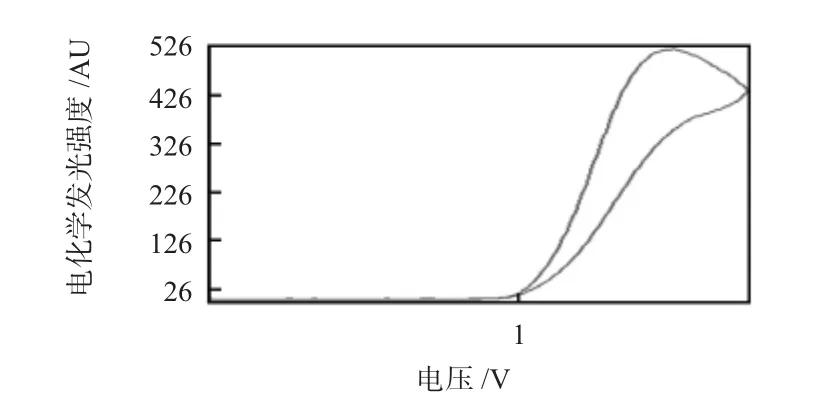
图3 标记探针的电化学发光性质Fig 3 ECL characteristics of labeled probe
图4为ECL强度(3次重复平均值,扣除基线值)随abrin浓度变化的关系曲线,可见随着abrin浓度升高,ECL值逐渐上升;在abrin浓度达1 000 μg/L时不再上升,基本达到饱和。在0.1~1000 μg/L范围内电化学发光强度(Y)的对数与abrin浓度(X)的对数呈线性关系,拟合方程为lgY=0.763 lgX+0.562(R=0.9903,N=7,P<0.0001)。因此,传感器对抗原检测的线性范围是0.1~1000 μg/L,当abrin浓度低于0.1 μg/L时,电化学发光强度基本处于基线水平(6~7),因此,检测下限为0.1 μg/L。这较之前建立的压电免疫传感器法检测abrin[13]在灵敏度上提高500倍,与Garber E A等人[7]建立的固相平板上的ECL水平(不同样本中0.1~0.5μg/L不等)相当。由于本方法采用的磁性微球悬浮反应体系,使异相反应成类似均相反应,大大加快了反应速度,加上磁性微球的分离富集作用以及便于清洗,与平板上ECL相比,明显缩短了检测时间。

图4 ECL强度与abrin浓度的关系Fig 4 Relationship between ECL intensity and concentration of abrin
2.2.2 特异性
传感器对空白样品缓冲液(PBS),100 μg/L的牛血清白蛋白(BSA)、100 μg/L的葡萄球菌肠毒素 B(SEB)与100 μg/L的蓖麻毒素(ricin)的ECL响应值都在基线水平(6~7),对非目标蛋白均不响应,说明该传感器对abrin检测有很强的特异性。磁微球固定化多抗作为捕获探针与标记单抗作为发光探针对abrin的夹心式双重特异性识别,以及磁微球的分离富集作用,保证了传感检测的高度特异性。
2.2.3 检测重现性
在线性范围内,对浓度为100 μg/L的abrin重复5次平行测定,ECL值为89±8,相对偏差为9%,传感器不仅灵敏度高而且重现性较好。
3 结论
本文以磁性微球固定相思子毒素多抗制备捕获探针,以三联吡啶钌标记相思子毒素单抗作为发光探针,建立了相思子毒素的磁免疫电化学发光传感检测方法。实验结果表明:利用此方法检测相思子毒素,响应快速、特异性强、灵敏度高(检出限为 0.1 μg/L)、线性范围宽(0.1~ 1 000 μg/L)。可以此为基础,发展生物毒素和其它蛋白的现场检测方法,用于临床诊断、环境监测、食品卫生检验及生物防护等应用领域。
[1] Pyati R,Richter M M.ECL—electrochemical luminescence[J].Annu Rep Prog Chem,Sect C,2007,103:12 -78.
[2] Yan G H,Xing D,Tan S C,et al.Rapid and sensitive immunomagnetic-electrochemiluminescent detection of p53 antibodies in human serum[J].J Immunol Methonds,2004,288:47 -54.
[3] Li M Y,Sun Y M,Chen L,et al.Ultrasensitive eletrogenerated chemiluminescence immunoassay by magnetic nanobead amplification[J].Electroanalysis,2010,22:333 -337.
[4] Zhan W,Bard A J.Electrogenerated chemiluminescence.83.Immunoassay of human C-reactive protein by using Ru(bpy)2+3-encapsulated liposomes as labels[J].Anal Chem,2007,79:459-463.
[5] 穆晞惠,童朝阳,郝兰群,等.双抗体夹心ELISA法检测相思子毒素[J].细胞与分子免疫学杂志,2007,23(8):763-764.
[6] 穆晞惠,郝兰群,童朝阳,等.双抗体夹心生物素-亲和素ELISA法检测相思子毒素[J].免疫学杂志,2007,23(5):571-574.
[7] Garber E A,Walker J L,O'Brien T W.Detection of abrin in food using enzyme-linked immunosorbent assay and electrochemiluminescence technologies[J].Journal of Food Protection,2008,71(9):1868-1874.
[8] Zhou Y,Tian X L,Li Y S,et al.Development of a monoclonal antibody-based sandwich-type enzyme-linked immunosorbent assay(ELISA)for detection of abrin in food samples[J].Food Chemistry,2012,135(4):2661 -2665.
[9] Melchior W B,Tolleson W H.A functional quantitative polymerase chain reaction assay for ricin,Shiga toxin,and related ribosome-inactivating proteins[J].Analytical Biochemistry,2010,396(2):204-211.
[10] Gao S,Nie C,Wang J H,et al.colloidal gold-based immunochromatographic test strip for rapid detection of abrin in food samples[J].Journal of Food Protection,2012,75(1):112 -117.
[11] Yang W,Li XB,Liu GW,et al.A colloidal gold probe-based silver enhancement immunochromatographic assay for the rapid detection of abrin-a [J].Biosensors & Bioelectronics,2011,26(8):3710-3713.
[12] Weber M,Schulz H.Immunological detection of ricin and castor seeds in beverages,food and consumer products[J].Toxichem Krimtech,2011,78(Special Issue):276 -277.
[13]穆晞惠,周志强,童朝阳,等.基于生物素—亲和素系统的压电免疫传感器检测相思子毒素研究[J].分析化学,2009,37(10):1492-1502.
[14] Miao W,Bard A J.Electrogenerated chemiluminescence.72.determination of immobilized DNA and C-reactive protein on Au(111)electrodes using tris(2,2'—bipyridyl)ruthenium(II)labels[J].Anal Chem,2003,75(21):5825 -5834.
[15] Terpetschnig E,Szmacinski H,Malak H,et al.Metal-ligand complexes as a new class of long-lived fluorophores for protein hydrodynamics[J].Biophys J,1995,68(1):342 -350.

