糖尿病大鼠脾气亏虚、痰瘀互阻证的尿液代谢组学分析
潘 秋,赵慧辉,陈建新,董 芳,王 伟△
(1.安徽省中医院内分泌科,合肥 230031;2.北京中医药大学研究生院,北京 100029;3.首都师范大学分析测试中心,北京 100037)
采用高脂饲料叠加腹腔注射链脲佐菌素(Streptozotocin,STZ)复制的糖尿病大鼠模型在糖尿病研究中应用广泛,根据全面、动态地表征采集和检测实验室指标。我们在前期研究中发现,该模型具有中医证候属性,属“脾气亏虚、痰瘀互阻”证范畴[1]。临床文献研究结果亦证实,上述证候在临床实际中出现频率较高[2],因此此种造模方法复制的糖尿病模型符合中医药研究的特征。笔者认为,从微观角度深入阐释此模型证候的生物学特征具有现实意义,一是可以将证候量化、客观化、具体化,一是可以阐明复杂中医药干预手段的多靶点效应。
表征采集和一般实验指标检测尚不能全面揭示糖尿病大鼠模型的证候特征,新兴的系统生物学与中医学有着异曲同工之妙,因此笔者拟采用系统生物学之代谢组学技术从微观角度动态地揭示大鼠模型证候的内在特征,通过气相色谱-质谱联用(Gas Chromatography-Mass Spectrometry,GC-MS)等技术建立起动态的大鼠尿液的“代谢指纹图谱”,通过数据分析最终找出特征性的代谢产物群,确定“中医证候相关代谢谱”。
1 材料与方法
1.1 动物
健康雄性8周龄SD大鼠40只,体质量220±10g,由北京维通利华实验动物中心提供(许可证号为SCXK(京)2002-0003),饲养于北京中医药大学清洁级动物室,室温18℃ ~25℃,相对湿度50% ~60%,大鼠适应性饲养1周。
1.2 饲料
普通饲料及高脂饲料购于中国科学院动物所。高脂饲料配方(按质量比):20%猪油,10%蔗糖,23%酪蛋白,0.3%蛋氨酸,28%淀粉,10%糊精,7.5%纤维素,0.3%胆碱,0.1%多维预混料,0.8%多矿预混料[3]。
1.3 试剂
STZ(批号S0130),北京邦定泰克生物技术有限公司;乙腈(A996-4),Fisher Scientific;吡啶(110-86-1),MREDA TECHNOLOGY INC;三氯甲烷(67-66-3),MREDA TECHNOLOGY INC;17碳脂肪酸(H3500-5G)、TMCS(386529-100mL)、N-甲基-N-三甲硅基三氟乙酰胺(394866 10×1mL),均购自美国Sigma试剂公司。
1.4 仪器
one touch随手测血糖仪及血糖试纸(批号200701,美国强生公司);美国 Finnigan Trace 2000/Trace DSQ气相色谱—质谱联用仪,配有RTx-5毛细管柱、Xcalibur工作站、NIST谱库;氮气吹干机。
1.5 方法
1.5.1 造模方法 模型组高脂饮食喂养6周后,腹腔注射STZ 35mg/kg,对照组普通饮食喂养6周后,腹腔注射同等剂量 0.1M柠檬酸-柠檬酸钠缓冲液,注射STZ 4周后两组大鼠尾静脉采血检测血糖,凡血糖值符合空腹血糖≥11.1mmol/L者纳入代谢组学实验[4]。
1.5.2 血糖、空腹胰岛素、血脂测定 实验6周末测定OGTT30min血糖、胰岛素及甘油三酯、胆固醇(交由东直门医院检验科测定),出现血糖恢复的大鼠则予以剔除。
1.5.3 尿样留取 成模后第3周末和第6周末分别利用代谢笼留取模型组、对照组大鼠的24h尿液,每组随机选取8只,每只大鼠留取尿液1mL,分别保存于不同的试管中,检测前保存于-80℃冰箱。
1.5.4 GC-MS样本预处理 每只大鼠取600μL尿液,加入 10μL内标(17碳脂肪酸 6mg/mL),加入 400μL乙腈,涡旋混合 1min,冰浴超声10min,18000r/min,4℃离心5min。取上清液置于干净试管中,氮气吹干。加入50μL甲氧胺吡啶溶液(15mg/mL)混匀,30℃肟化 2h。加衍生化试剂(MST-FA∶TMCS=100∶1,v/v)50μL,混匀静置。1h后移取上清液到微量进样管,供GC-MS分析[5]。
1.5.5 GC-MS分析条件 气相条件:分流比,1∶1,进样量 0.5μL。进样口温度:280℃;接口温度:250℃;升温程序:80℃;保持2min,以每分钟 10℃升至140℃,以每分钟4℃升至240℃,再以每分钟10℃升至280℃,保持3min。离子源温度:200℃.载气:高纯度氦气。质谱条件:载气流速,1.0mL/min;电离方式 EI;电子能量 70eV.扫描范围:50 ~800m/z[5]。
1.5.6 总离子流图分析 物质鉴定采用质谱自带软件;GC-MS总离子流图中各峰的保留时间挑选共有峰,获取各峰与内标峰的峰面积数据,用相对峰面积(与内标峰的比值)表示代谢物的含量。
1.5.7 统计学方法 采用SAS 8.1统计软件处理,计量资料正态分布数据以均数±标准差(珋x±s)表示,非正态分布数据以中位数表示;同一时间点两组间比较采用t检验或秩和检验;模式识别采用主成分分析(Principal component analysis,PCA),应用 SIMCA-P+ 软件(V12.0.1,Umetrics,Sweden)。
2 结果
2.1 血糖、空腹胰岛素、血脂测定(表1)
2.2 总离子流图
第3周和第6周模型组和对照组总离子流图分别见图1~图4。
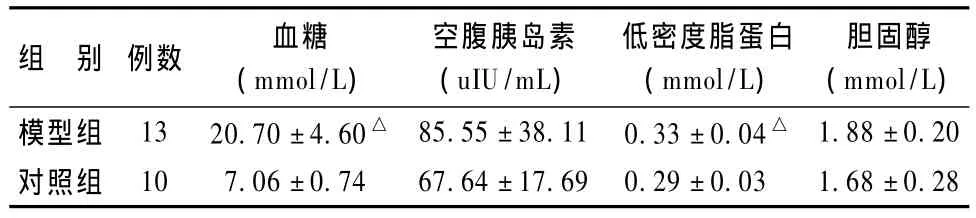
表1 2组大鼠血糖、空腹胰岛素、血脂比较(珋x±s)
图1 第3周模型组总离子流图
图2 第3周对照组总离子流图
图3 第6周模型组总离子流图
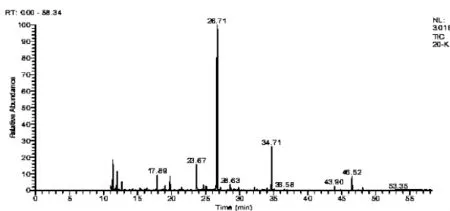
图4 第6周对照组总离子流图
2.3 代谢物鉴定
表2显示,共有峰挑选后发现尿液中共有内源性代谢物7种。利用NIST质谱数据库对共有的内源性代谢物作鉴定,按通常匹配度大于80%的鉴定结果作为可信度较大的物质。按保留时间分别为丙氨酸、戊二酸、L-抗坏血酸、D-葡萄糖酸、棕榈酸、十八烷酸、单甘油。
2.4 GC-MS图谱模式识别分析
2.4.1 模型组前后比较 模型组第3周和第6周PCA得分图和载荷图结果表明,2组基本可以沿t1轴分开(除外第1时间点的一个样本),PCA前2个主成分累积得分为67.2%,叠加后续2个主成分,共计4个主成分累积得分85.7%,可覆盖大部分代谢物信息。在前2个主成分得分图中可见各样品分布于得分图的2个区域,第3周样本分布于左方,第6周的样本分布于右方(结果见图5、图6)。

表2 GC-MS尿液代谢物鉴定
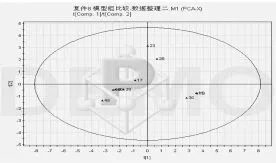
图5 模型组前后比较CA得分图

图6 模型组前后比较PCA载荷图

图9 第6周模型组、对照组PCA得分图

图10 第6周模型组、对照组PCA载荷图
2.4.2 同一时间点模型组、对照组互相比较(1)第3周模型组、对照组比较 模型组、对照组PCA得分图和载荷图结果表明,2组基本可以沿t2轴分开,PCA前2个主成分累积得分为67.4%,叠加第3个主成分,共计3个主成分累积得分84.2%,可覆盖大部分代谢物信息。在前2个主成分得分图中,可见各样品分布于得分图的2个区域,对照组的样本分布于上方,模型组的样本分布于下方(结果见图7、图8)。
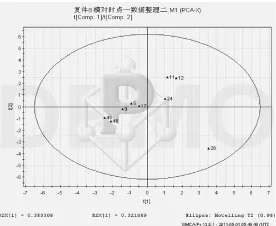
图7 第3周模型组、对照组PCA得分图
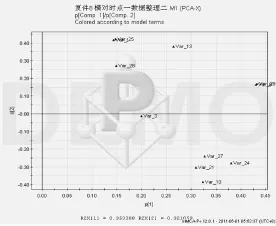
图8 第3周模型组、对照组PCA载荷图
(2)第6周模型组、对照组比较 模型组、对照组PCA得分图和载荷图结果表明,2组基本可以沿t1轴分开,PCA前2个主成分累积得分为53.3%,叠加后续三个主成分,共计五个主成分累积得分85.8%,可覆盖大部分代谢物信息。在前2个主成分得分图中可见各样品分布于得分图的两个区域,对照组的样本分布于左方,模型组的样本分布于右方(结果见图9、图10)。
2.5 代谢物组内及组间比较结果
2.5.1 组内比较 (1)第3周:根据主成分分析结果,各组比较差异无统计学意义;(2)第6周:与对照组比较,模型组 L-抗坏血酸、D-葡萄糖酸、丙氨酸、戊二酸、十八烷酸含量增加(P<0.05或 P<0.01)。
2.5.2 组间比较 表2显示,与第3周比较,第6周模型组L-抗坏血酸(29min)、D-葡萄糖酸、十八烷酸和戊二酸含量增加(P<0.05或P<0.01)。
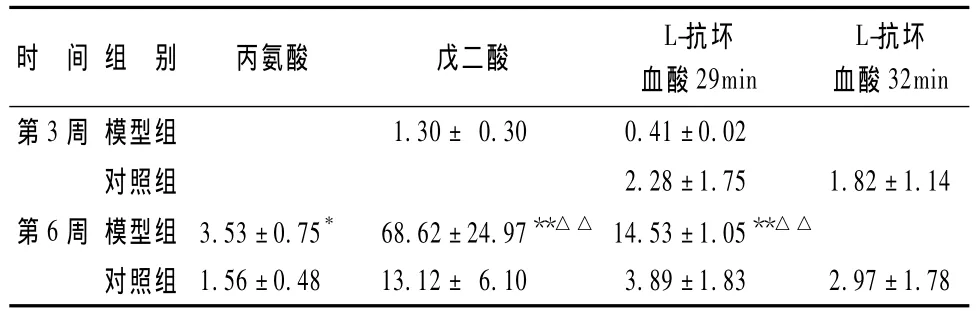
表2 大鼠尿液代谢物组内及组间比较

表2 (续)大鼠尿液代谢物组内及组间比较
3 讨论
3.1 尿液代谢物浓度的变化
从氧化应激水平及血脂代谢异常等方面,初步解释病证结合糖尿病大鼠模型脾气亏虚、痰湿瘀滞证的证候相关生物学特征。
以往的实验研究证明,大鼠模型前3周证候属性以脾气亏虚证为主,后3周证候属性以痰湿瘀滞证为主[1]。尿液代谢物鉴定结果显示,与第3周比较,第6周模型组大鼠尿液中 L-抗坏血酸、D-葡萄糖酸、十八烷酸和戊二酸含量均明显增加。L-抗坏血酸含量增高可能是大鼠模型发生糖尿病后,体内氧化水平激增,机体通过自身调节而出现的代偿性抗氧化反应;十八烷酸是硬脂酸,属于高级饱和脂肪酸,存在于部分植物性油脂和动物性油脂中,饱和脂肪酸的增加可能会引起血液中胆固醇含量上升,并促使机体对胰岛素等激素产生抵抗,导致血糖升高等代谢紊乱情况出现。查阅KEGG检索丙氨酸与相关疾病的关系发现,丙氨酸异常多见于代谢异常性疾病,这将为今后实验提供新的研究靶点。综合上述几种代谢物的组合规律及其含量的变化,可以初步阐释糖尿病大鼠中医证候的相关代谢物特征,即涉及氧化应激和血脂代谢异常等方面。
3.2 气质联用技术
气质联用技术可能对部分物质不能有效地分离和分析,今后可采用其他代谢组学技术进行补充和验证。
气质联用技术主要应用在植物代谢组学研究中,分析时需对样品进行衍生化处理来增加样品的稳定性和挥发性,以利于用GC-MS中的气相色谱仪进行分离。因此,GC-MS限于分析挥发性的物质,无法分析膜脂等热不稳定性的物质和分子量较大的代谢产物。笔者以糖尿病病证结合大鼠的尿液为样本,根据不同组别的不同代谢产物含量的变化对大鼠的证候做出了初步的阐释。如果结合其他代谢组学技术,可能会发现更多有意义的代谢物,以便更深入地阐释糖尿病病证结合大鼠证候特征的科学内涵。由于国内关于代谢组学的研究起步较晚,而涉及糖尿病中医学范畴的文献研究也比较少,可借鉴的研究结果为数不多。笔者以此模型为切入点,今后将拓展至其他造模方法复制的糖尿病大鼠模型,以逐步探索不同病证结合动物模型的代谢物特征,以期为分析中药干预的多靶点效应提供切实依据。
受到大鼠样本量的限制和大鼠模型的个体差异,各组大鼠尿液代谢物在种类和含量上出现了一定程度的偏差。笔者认为,在今后的实验中可以从两方面进行改进:首先是增加实验动物的样本量,二是提高实验动物的造模程度,以有利于发现差异明显的代谢物群。作为最终代谢物,大鼠的尿液可能在疾病程度较轻的阶段不出现明显的变化,笔者认为可以结合血液检测方法,开展血液代谢组学研究,可能会发现与糖、脂、蛋白代谢紊乱明显相关的生物标志物。同时今后的研究也可以借助系统生物学的其他技术方法,如蛋白组学和基因组学,深入开展2型糖尿病大鼠病证结合生物学基础研究,期望通过不同组学技术交叉印证证候的相关生物学机制,并借助复杂统计学方法,将系统生物学结果和一般实验指标、宏观表征融合成有机的整体,探索出一条由宏观到微观的有效实验方法,探寻宏观指标和微观指标之间的关联性,努力找到可以代替微观指标的宏观指标,以此有望加快证候研究的步伐。
[1] 潘秋,赵慧辉,陈建新,等.2型糖尿病大鼠表征及其证候特征研究[J].中华中医药杂志,2011,4(26):683-685.
[2] 尹德海,梁晓春,朴元林,等.2型糖尿病患者中医证型分析及其与糖尿病慢性并发症关系的探讨[J].中国中西医结合杂志,2009,29(6):506-510.
[3] M.J.Reed,K.Meszaros,L.J.Entes,et al.A new rat model of type 2 diabetes:thefat-fed,streptozotocin-treated rat[J].Metabolism,2000,49:1390-1394.
[4] 冯建华,姜国胜,徐云生,等.化痰活血法改善2型糖尿病模型大鼠胰岛素抵抗的作用机制研究[J].中华中医药杂志,2009,24(8):1014-1020.
[5] 简维雄,袁肇凯,黄献平,等.冠心病心血瘀阻证尿液代谢组学的检测分析[J].中医杂志,2010,51(8):729-732.

