水合二氧化钛吸附与除铁影响因素
胡亏全,朱怀锐,刘 琼,艾秋红,伍向阳
(1.湖北驰顺化工有限公司,湖北 黄石 435200;2.湘潭大学化工学院,湖南 湘潭 411100)
0 引 言
钛白粉是世界上性能优异的一种白色无机颜料,应用非常广泛.我国主要采用硫酸法生产,用硫酸分解粉碎过的钛铁矿,以铁粉为还原剂制得钛、二价铁及其它伴生属的硫酸盐混合溶液.通过结晶分离其中大部分铁,在正钛酸胶体为晶核的诱导下,将浓钛液水解生成水合二氧化钛[1].水合二氧化钛中铁含量的高低严重影响钛白粉的质量,微量的铁会形成活性靶点,影响二氧化钛作为颜料的性能[2-3].由于亚铁离子会被氧化成三价铁离子,而三价铁离子极易水解而形成沉淀,很难通过水洗除去,所以钛白粉生产工艺中需要对三价铁离子进行还原,再进行二次水洗.水合二氧化钛中亚铁离子的去除,采用水洗涤除去,前期洗涤效率很高,随着水洗的进行,水合二氧化钛中铁的浓度下降,传质推动力下降,水洗的效率越来越低,为了提高钛白粉的质量,大幅度减少洗涤过程水的消耗,有必要深入研究水合二氧化钛对亚铁离子的吸附平衡与吸附动力学,文献[4-5]报道了水合二氧化钛与放射性离子CS+、Sr+等离子的交换吸附性能,而有关水合二氧化钛与亚铁离子的交换吸附性能的报道较少.本文研究了水合二氧化钛与亚铁离子的吸附作用机理,考察了吸附平衡时间、亚铁离子浓度、pH值和温度等对水合二氧化钛吸附亚铁离子的影响,在此基础上,考察了洗水的含酸量和温度对水合二氧化钛洗涤效果的影响,对于工业过程降低洗涤过程水的消耗,提高钛白粉产品质量具有指导作用.
1 实验部分
1.1 原料与试剂
水合二氧化钛由中盐株洲化工集团公司提供,七水硫酸亚铁,硫酸亚铁铵,浓硫酸,盐酸羟胺,1,10-菲咯啉等均为分析纯.
1.2 分析方法
1.2.1 清液中铁含量测定 将偏钛酸浆抽滤后,取清液,利用Fe2+在pH为2~9的条件下加入邻二氮菲生成极稳定的橙红色配合物,用分光光度计进行比色分析,测定其中的铁含量,在显色前,用盐酸羟胺把样品中的三价铁离子还原为二价铁离子.
1.2.2 煅烧品中铁含量测定 取偏钛酸少许,于马弗炉中350℃保温1.5h,得固体样品.将样品研磨成粉末,称取试样0.2g(准确至0.000 2g)置于100mL烧杯中,加硫酸-硫酸铵混合液8 mL,加热至二氧化钛全部溶解成澄清液,冷却后加蒸馏水10mL,在pH为2~3的条件下,用盐酸羟胺将三价铁还原成二价铁,然后以邻菲罗啉为显色剂,用分光光度计进行比色分析,测定其中的铁含量,大量的钛不必分离,可用酒石酸钾结合掩蔽,其它离子如:铝、钙、镁、锰等含量在500mg/L以下不会发生干扰.
1.3 实验方法
采用静态方法考察吸附时间、吸附温度、吸附酸度、亚铁离子初始浓度等因素对水合二氧化钛吸附亚铁离子的影响.
水合二氧化钛吸附量按下式计算:
Q= (C0-C1)*V/M
式中:Q为水合二氧化钛对亚铁离子的吸附量 (mg/g);V为水合二氧化钛浆液中溶液的体积(L);C0为水合二氧化钛浆液中亚铁离子的初始浓度 (mg/L);C1为水合二氧化钛浆液中亚铁离子的平衡吸附浓度(mg/L);M为水合二氧化钛的干重(g).
水合二氧化钛的抽滤采用真空抽滤法.取一定量的水合二氧化钛浆料,用砂型漏斗抽滤后,再分别用2.5mL洗水对每克水合二氧化钛于不同温度下对滤饼进行洗涤,洗涤后对滤饼进行分析,测定其中的铁含量,考察洗水酸浓度与洗水温度对洗涤的影响.
2 结果与讨论
2.1 吸附时间对水合二氧化钛吸附亚铁离子的影响
水合二氧化钛对亚铁离子的吸附随时间的变化如图1所示.
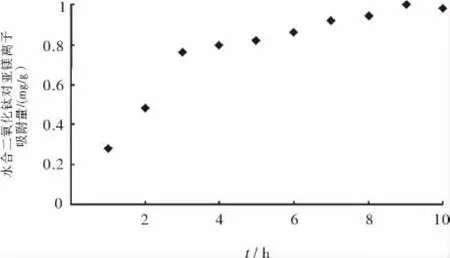
图1 时间对水合二氧化钛对亚铁离子的吸附的影响Fig.1 Effect of t on the adsorbtion of ferrousion on hydrated titanium
由图1可知,随着吸附时间的延长,水合二氧化钛对亚铁离子的吸附量逐渐增大,当吸附时间达到9h后,吸附量随时间变化不大,达到吸附平衡.因此,水合二氧化钛对亚铁离子的吸附平衡时间为9h.
将图1中吸附速率数据代入一级动力学Lagergren 方程[2-3]:

式中:F=q/qe,其中q为该时刻水合二氧化钛对亚铁离子的吸附值,qe为平衡吸附量 ;k为吸附速率常数;t为时间.
以 -ln(1-F)对t作图,通过对该曲线进行线性拟合,可以得到图2,直线斜率即为k值.由图2可知,在30℃ 下水合二氧化钛吸附亚铁离子的吸附速率常数为0.42.R2=0.995,说明水合二氧化钛吸附亚铁离子的吸附反应动力学符合一级动力学Lagergren方程.
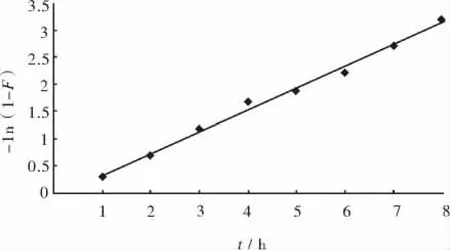
图2 -1n(1-F)对时间的动力学 Lagergren方程图Fig.2 Linear fit of the kinetic Lagergren equation
2.2 亚铁离子浓度对水合二氧化钛吸附的影响
亚铁离子的初始浓度对水合二氧化钛吸附的影响见图3.从图3可知,水合二氧化钛的平衡吸附量随着Fe2+浓度的增加而增加,当Fe2+的质量浓度达到300mg/L以后,再继续增加其浓度,水合二氧化钛的平衡吸附量增加不大,吸附曲线近似L型曲线,有最大平衡吸附量.主要是因为当Fe2+初始浓度较低时,水合二氧化钛可以提供足够的吸附位点用于吸附反应,吸附量逐渐增加.但是当Fe2+质量浓度较高时,活性位点相对不足,吸附达到饱和,吸附量不再增加,吸附曲线也最终趋于平缓,提高亚铁离子浓度能增加水合二氧化钛的平衡吸附量.
对图3中的数据,以lg(Qe)为纵坐标(Qe为平衡吸附量),lg(Ce)为横坐标(Ce为平衡浓度)作图,并对该曲线进行线性回归,得到图4.
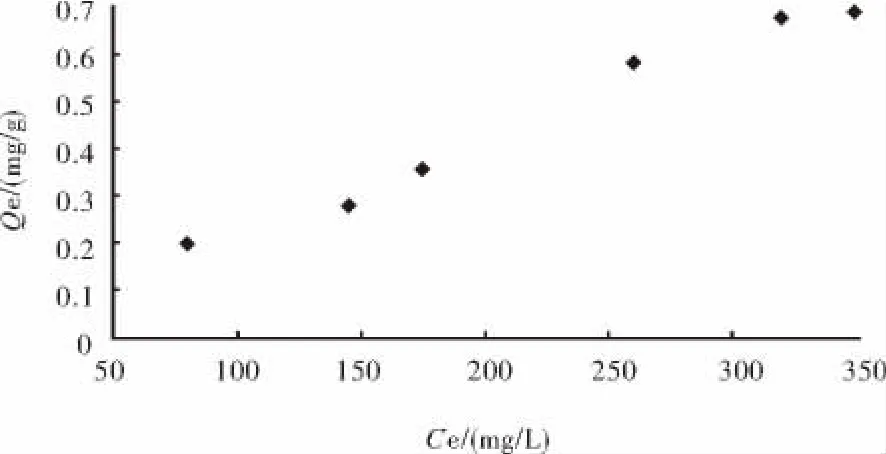
图3 Qe吸附量对Ce质量浓度的变化Fig.3 The variation of Qe adsorption to the concentration of Ce
R2=0.98,说明该吸附等温线能较好的符合Freundlich吸附公式:
lgQe=lgK+1/nlgCe
其中,常数lgK、1/n分别为吸附等温线截距和斜率.

图4 lgQe对lgCe的吸附曲线Fig.4 The adsorption curve for lgQe to lgCe
通过回归方程,得到吸附等温式:
lgQe=1.181gCe-2.80
一般认为,吸附等温线斜率1/n在0.1~0.5间时,说明吸附质不易被所用的吸附剂吸附;1/n在0.5~1之间时,说明吸附质易被吸附剂吸附;1/n大于1时,为优惠吸附[6].本实验中1/n 为1.18,说明水合二氧化钛很容易吸附亚铁离子.可见,在水合二氧化钛的后期洗涤中,很难将亚铁离子全部除去.
2.3 硫酸质量浓度对水合二氧化钛吸附的影响
图5反映了不同硫酸质量浓度对水合二氧化钛吸附亚铁离子的影响.从图5可以发现,随着硫酸质量浓度的增大平衡吸附量减小.主要原因有以下两点:一是因为在水溶液中,TiO2表面羟基化作用,表面羟基在不同酸碱条件下发生不同的离解作用,即:在酸性溶液中:Ti-OH+H+=Ti++H2O;在碱性溶液中:Ti-OH+OH-=TiO-+H2O.硫酸浓度较高时,TiO2表面正电荷增多,不利于对Fe2+的吸附,随溶液硫酸浓度的下降,TiO2表面正电荷密度减小,负电荷密度增大,有利于对Fe2+的吸附.二是因为当pH较低时,H+大量存在于溶液中,与Fe2+竞争水合二氧化钛表面的吸附位点,所以平衡吸附量比较低,随着pH升高,溶液中H+逐渐减少,与Fe2+的竞争能力降低,Fe2+获得水合二氧化钛表面的吸附位点的几率增加,平衡吸附量也随之增大.
2.4 温度对水合二氧化钛吸附的影响
图6是温度对水合二氧化钛吸附亚铁离子的影响.由图6可知,水合二氧化钛对Fe2+的平衡吸附量随着温度的升高而降低,说明水合二氧化钛对Fe2+的吸附过程为放热过程,高温不利于Fe2+的吸附.
2.5 洗水含酸对抽滤洗涤除铁的影响
图7是洗水含酸量对亚铁离子去除率的影响.由图7可知,随着洗水含酸量的增加,铁的去除率有一定的增加,主要是因为随着洗水含酸量的增加,首先抑制了铁盐离子的水解,使铁盐离子一直保持溶解状态,容易通过水洗的方法去除;其次抑制了水合二氧化钛对亚铁离子的吸附,水洗时能尽可能多的去除亚铁离子.
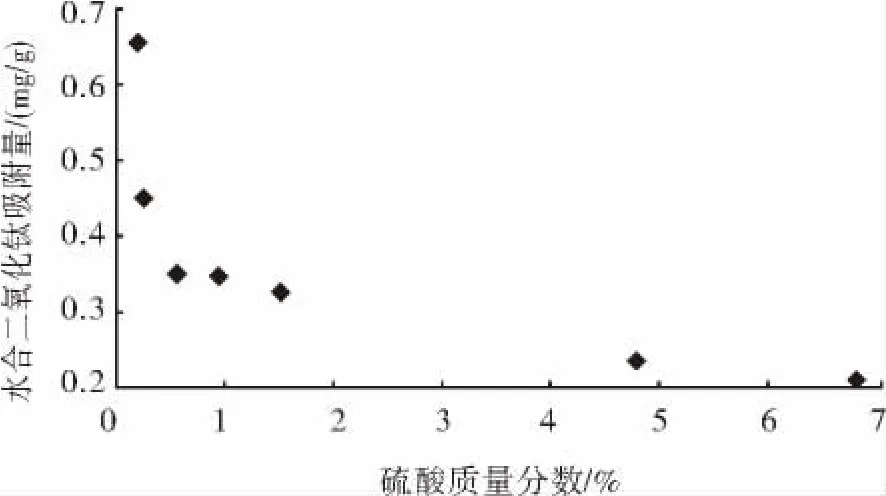
图5 硫酸质量浓度对水合二氧化钛吸附影响Fig.5 The effect of Sulfuric acid mass concentration on the absorption of the hydrated titanium dioxide
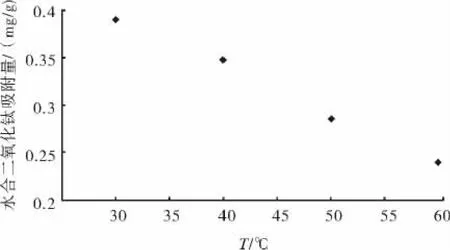
图6 温度对水合二氧化钛吸附的影响Fig.6 Effect of T to the adsorptions of the hydrated titanium dioxide
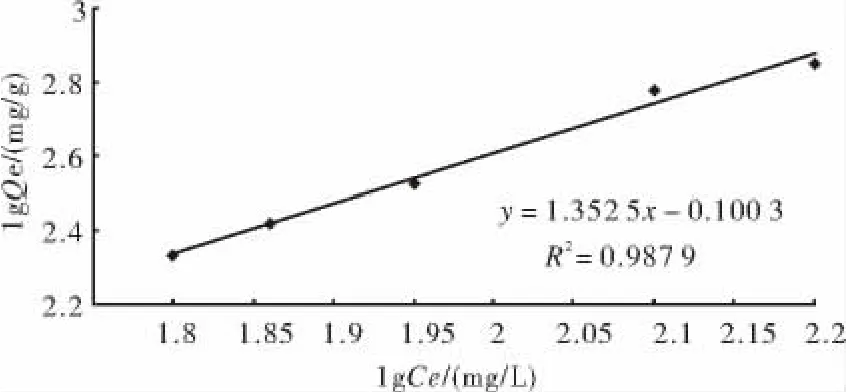
图7 洗水含酸质量浓度对亚铁离子除去率的影响Fig.7 Effect of acidity mass concentration on ferrous ion removal rate
2.6 洗水温度对抽滤洗涤除铁的影响
洗水温度对抽滤洗涤除铁的影响见图8.由图8可知,随着洗水温度的升高,铁的去除率逐渐增大.这是因为,一方面随着温度的升高,水合二氧化钛吸附亚铁离子的能力下降;另一方面随着温度的升高,硫酸亚铁等杂质的溶解度增大,20℃时硫酸亚铁的溶解度只有22g/L,60℃时溶解度很大,能达到50g/L,同时随着温度的升高,水的粘度降低,所以提高洗水的温度能加快水洗效率,降低水合二氧化钛中的铁含量.

图8 洗水温度对抽滤洗涤除铁的影响Fig.8 Effect of T on ferrous ion removal rate
3 结 语
a.水合二氧化钛吸附亚铁离子的平衡吸附时间为9h,亚铁离子初始浓度最佳为300mg/L.
b.硫酸质量分数对吸附有显著影响,在硫酸质量分数<7%的范围内,随着硫酸质量浓度的升高,水合二氧化钛对亚铁离子的平衡吸附量下降,硫酸质量浓度过低亚铁离子会水解;水合二氧化钛吸附亚铁离子的过程为放热过程,升高温度不利于亚铁离子的吸附;硫酸质量浓度的增加和温度的升高均不利于水合二氧化钛对亚铁离子的吸附.
c.吸附动力学符合一级动力学Lagergren方程,吸附等温方程符合Freundlich方程.
d.洗涤过程中洗水的硫酸质量浓度提高和洗水的温度升高均利于亚铁离子的去除,有利于水合二氧化钛的洗涤.
[1]张益都.硫酸法钛白粉生产技术创新[M].北京:北京化学工业出版社,2010.ZHANG Yi-du.Production technology of Titanium dioxide have a Innovation by sulfuric acid method[M].Beijing:Beijing Chemical Industry Press,2010.(in Chinese).
[2]Rao M M,ramesh A,Rao G P C,et al.Removal of copper and cadmium from the aqueous solutions by activated carbon derived from Ceiba pentandra hulls[J].Journal of Hazardous Materials,2006,129:123-129.
[3]Onganer Y,Temur C.Adsorption dynamics of Fe(III)from aqueous solution onto activated carbon[J].J Colloid Intergsce Sci,1998,205:241-244.
[4]彭丽霞,王建晨,文明芬,等.球形复合无机离子交换剂水合氧化钛-硅钛酸钠的制备及性能研究[J].离子交换与吸附,2005,21(6):487-492.PENG Li-xia,WANG Jian-chen,WEN Ming-fen,et al.Study on the preparation and properties of spherical composite ion exchanger HTO-NaTS[J].Ion Exchange and Adsorption ,2005,21(6):487-492(in Chinese).
[5]藏春梅,张改莲,孙兆祥.水合二氧化钛-磷钼酸铵微球复合无机离子交换剂的合成[J].离子交换与吸附,2000,16(5):406-412.ZANG Chun-mei,ZHANG Gai-lian.SUN Zhaoxiang.Structure and properties of hydrated titanium dioxide-ammonium molbdophosphate spherical comples inorganic ion exchanger [J].Ion Exchange and Adsorption,2000,16(5):406-412.(in Chinese).
[6]程昌敬,刘东,张嫦 .羧甲基化壳聚糖修饰磁性硅粒子去除 Cr(Ⅵ)离子[J].化工进展,2012,31(1):227-232.CHENG Chang-jing,LIU Dong ,ZHANG Chang.Adsorptive removal of Cr(Ⅵ)ions by carboxymethylated-chitosan modified magnetic silica particles[J].Progress of Chemical,2012,31(1):227-232.(in Chinese).

