卵巢肿瘤二维及三维超声形态学误诊原因分析
郭琳娜,黄 帆
(天津市中心妇产科医院超声科,天津 300100)
卵巢癌是女性常见的妇科肿瘤之一,是引起妇女死亡的主要原因。虽然早期发现的存活率目前已上升至90%[1],但将近3/4的女性发现时已经是晚期,且5年存活率仅为30%,预后差[2]。卵巢癌组织类型复杂,鉴别非常困难,因此有效鉴别卵巢肿物良恶性尤为重要。几十年来,超声技术飞速发展,相继出现经腹、经阴道二维超声,彩色及频谱多普勒,彩色多普勒能量图和三维超声,用于卵巢肿瘤的诊断并预测其良恶性,其诊断准确率逐步提高[3]。本研究将三维超声成像技术与传统二维超声比较探讨三维超声的优势,评价三维超声在卵巢肿瘤诊断中的临床应用价值。
1 资料与方法
1.1 研究对象
选择2012年10月—2013年3月在我院妇科住院治疗的卵巢肿瘤患者62例,根据手术及术后病理诊断结果,将其分为良性组37例(包括畸胎瘤13例,浆液性囊腺瘤9例,黏液性囊腺瘤10例,勃勒纳氏瘤2例,纤维瘤3例),患者年龄19~78 岁,平均(46.1±2.4)岁;恶性组 25 例(包括子宫内膜样癌3例,浆液性囊腺癌9例,黏液性囊腺癌5例,颗粒细胞瘤2例,间质细胞肉瘤1例,卵黄囊瘤1例,库肯勃格瘤4例),患者年龄 15~71岁,平均(50.2±3.0)岁,术前均未接受化疗或放疗。
1.2 仪器与方法
应用美国GE公司生产的Voluson 730 Expert四维超声诊断仪,探头为经腹凸阵三维容积探头,频率 2.0~5.0 MHz。患者适度充盈膀胱,取仰卧位,用二维超声检查记录卵巢肿瘤的位置、大小、形态、内部回声及结构(分隔、乳头等)、有无腹水、腹腔种植、大网膜增厚及肝脏转移灶等情况,做出初步诊断。在获取最佳二维灰阶、彩色血流图、能量图后,启动三维程序,调整好立体数据框大小,将感兴趣区置于取样框内,探头固定于体表不动,嘱患者屏住呼吸确保图像质量,对感兴趣区进行原位扇形扫查,分别获得清晰的三维灰阶(用于分析立体的组织结构)、三维彩色多普勒血流图像(用于分析立体的血管构型)、三维能量多普勒图像(用于分析细小低速的血流)。每个病变取样2~3次,每次取样时间5~10 s,计算机自动进行三维重建,选取最佳图像存盘留档。取样结束后,应用壁龛模式、表面模式,透明模式(最大、最小模式、X线模式)和混合模式等对肿瘤进行立体重建,适当利用Migcut剪切功能观察病变的内部回声及结构、表面形态、血管分布及与周围组织的关系。一些后处理操作还包括调整阈值、Gamma曲线、Gray及Color的调配,控制高低临界,调整表面、光滑及纹理模式的比例,获得优质的三维图像。结合二维超声对卵巢肿瘤做出诊断,并与二维超声图像对比,确定是否三维超声成像要优于单纯二维超声。所有病例均于术前1周内行超声检查。
1.3 统计学处理
分别计算二维超声及三维超声鉴别诊断卵巢良恶性肿瘤的准确率和误诊率。
2 结果
2.1 二维超声诊断卵巢肿瘤的准确率和误诊率
多数情况下可以通过卵巢肿瘤的二维超声图像特点包括基本形态、囊实性、内部结构、后方回声、血流信号以及是否合并腹水等确定其病理性质。本研究中单纯利用二维灰阶超声正确诊断卵巢肿瘤48例,准确率为77.4%,误诊病例共14例,其中8例分别因形态不规则、包膜欠清、内回声复杂、实性区多、乳头状突起稍多、基底部宽、分隔囊壁厚>3 mm、厚薄不均毛糙、伴有腹水、盆壁不光滑等原因被误诊为恶性肿物,6例分别因形态尚规则、边界清、实性均匀回声、内未见明显乳头样突起、分隔囊壁薄而规则、不伴腹水、未探及明显血流等原因被误认为良性肿瘤,误诊率为22.6%。
2.2 三维超声诊断卵巢肿瘤的准确率和误诊率
多种三维超声重建成像技术的互相结合使62个卵巢肿瘤病灶的显示更加逼真,清晰直观,立体感强,空间位置关系明确,能清楚地显示二维超声无法显示的肿瘤内部细微结构:包括分隔的薄厚、是否规则及光滑度(图1),微小乳头状突起的形态、大小、数目(图2),病变基底的宽窄及有无蒂、三维血管分布及低速血流的显示(图3)等,为二维超声提供更丰富的诊断信息。本研究三维超声正确诊断卵巢肿瘤58例,准确率达93.5%,其中将6例单纯利用二维超声误诊为恶性肿瘤及4例误诊为良性肿瘤共10例误诊病例得以正确诊断,误诊病例共4例,误诊率为6.5%。本组三维超声检查的卵巢乳头状囊腺瘤中最小乳头为2 mm×2.5 mm(图4)。
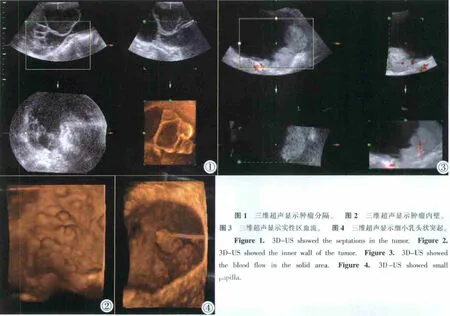
3 讨论
传统的二维超声仍是初步鉴别诊断卵巢肿物良恶性的基础,但是由于良恶性卵巢肿瘤的形态特点有交叉,极易混淆,性质完全不同的卵巢肿瘤可产生相似的声像图,而性质相同的病理改变又可表现为不同的图像,往往不易鉴别,研究指出其误诊率为20%[4],与本研究相符,因此需要其他技术来辅助诊断。
彩色多普勒通过血管分布的特点包括位置、方向、多少、粗细、形态以及是否为低阻力指数来进一步评价卵巢肿瘤的性质,但是由于其成像原理受探测角度的影响较大,易产生混叠现象,且其对低流量低流速的血流不能完整显示,因此不能充分显示血管分布,阻力指数等参数常不易获得[5]。本研究中3例误诊病例就因彩色多普勒显示血流不丰富而导致误诊。
二维超声对于较小的卵巢恶性肿瘤(直径≤2 cm)及肿瘤内壁上较小的乳头状突起(直径≤3 mm)容易漏诊。三维重建的表面成像技术能直观立体显示肿物包膜厚度、内壁光滑度、有无蒂、分隔、乳头大小数目及细小颗粒,尤其对囊性肿物内小乳头状突起(<3 mm)等细微结构的观察,较二维超声提供了更为丰富的信息,有利于卵巢肿物的早期诊断和良恶性鉴别。
本研究中5例因二维超声观察囊肿内有乳头状突起而误诊为恶性肿瘤,利用三维表面成像模式观察囊肿内壁乳头状突起尚平滑,分隔薄而规则,从而避免了误诊。3例因二维超声显示肿物内未发现明显乳头状突起误诊为良性的恶性卵巢上皮性肿瘤,通过三维表面模式观察内壁乳头样突出虽小但丰富,形态不规则从而避免了误诊。
1例畸胎瘤误诊病例通过表面模式观察到小的实性团与囊壁存在缝隙,有一个细小的蒂,而非由囊壁突向囊腔,结合透明模式可观察到实性区内有散在强回声斑从而避免误诊为浆液性囊腺癌。1例恶性包块二维超声显示实性区均匀,与子宫关系密切,通过表面模式观察包块与子宫不相连、无蒂,且通过透明模式的最小回声模式观察未发现由子宫发出滋养血管供应肿块,故避免将恶性肿瘤误诊为子宫肌瘤。
能量多普勒由于其显示的血流不受探测角度的影响,对低速、微小和迂曲的血管亦能完整连续显示,较彩色多普勒有更高的血流检出率,与三维技术结合,则显示为有立体效果的血管树,从而形象直观地显示肿瘤内血管分布、走行、分支情况,达到无创“三维血管造影”的效果[6]。三维能量多普勒对小乳头状突起及分隔内的小血管的显示更加敏感,有利于早期发现卵巢癌[7]。同时利用Magicut“电子切割刀”技术剪掉图像中影响视线的组织,通过平移和旋转从多切面多角度着重对感兴趣区进行更加细致的观察。大多数的学者一致认为[8-9],无血管分布或规则分布的肿物提示良性,复杂分布的肿物提示恶性,通过旋转功能观察血管树走行的复杂性,比二维超声在鉴别卵巢肿物良恶性上更加具有优越性。
本研究误诊病例中,3例误诊为良性的肿瘤因结合三维能量多普勒观察到乳头内及实性区有丰富的血流信号故正确诊断为恶性肿物。1例纤维瘤病例因实性肿物伴大量腹水误诊为恶性,利用三维表面模式观察盆壁尚光滑,三维能量多普勒示肿块内血流不丰富从而避免误诊。仍有4例三维超声与二维超声表现无明显差异故无法将其识别。
三维超声采样时间短,数据易于存储,三维超声立体成像用计算机控制,最大程度地避免了人为因素的干扰,可重复性高[10],待患者离开后可以进行三维图像重建,图像逼真、直观,进一步评价卵巢肿瘤的性质。但是三维成像主要依赖于二维图像提供的灰阶信息,二维图像的质量直接影响三维成像效果,三维超声在鉴别肿物性质时,仍应以二维超声及彩色多普勒为基础,不能单独使用,三维超声可以作为二维超声的补充,但不能代替二维超声。有学者认为大多数的卵巢肿瘤仍可用二维超声扫查,只有实性或囊实性肿物应该使用三维超声[11]。
总之,由二维成像向三维成像发展是医学发展的总趋势。多种三维超声成像新技术的相互结合-复合三维超声成像技术的出现从形态学及血管分布方面均能提供较二维超声更为丰富的三维空间信息,与传统的二维超声相比存在更大的优势,进一步提高了诊断卵巢肿瘤的准确率。三维超声可能将成为未来妇科肿瘤学研究和附件恶性肿瘤临床实践评估的一种重要方式。
[1]Mastsuo K,Ahn EH,Prather CP,et al.Patient-reported symptoms and survival in ovarian cancer[J].Int J Gynecol Cancer,2011,21(9):1555-1565.
[2]Chi DS,Eisenhauer EL,Zivanovic O,et al.Improved progression-free and overall survival in advanced ovarian cancer as a result of a change in surgical paradigm[J].Gynecol Oncol,2009,114(1):26-31.
[3]Pinschke M,Gnann D,Smekal I,et al.Asymptomatic adnexal masses:accuracy of characterization with ultrasound scoring systems,color Doppler sonography,3D-ultrasound,and MR imaging[J].Ultrasound Obstet Gynecol,2009,34(1):139.
[4]Gostout BS,Pachman DR,Lechner R.Recognizing and treating ovarian cancer[J].Minn Med,2012,95(3):40-42.
[5]Valent S,Olah O,Sara L,et al.Ultrasonography in the diagnosis of ovarian and endometrial carcinoma[J].Orv Hetil,2011,152(47):1887-1893.
[6]Sladkevicius P,Jokubkiene L,Valentin L.Contribution of morphological assessment of the vessel tree by three-dimensional ultrasound to a correct diagnosis of malignancy in ovarian masses[J].Ultrasound Obstet Gynecol,2007,30(6):874-882.
[7]Kupesic S,Plavsic BM.Early ovarian cancer:3-D power Doppler[J].Abdom Imaging,2006,31(5):613-619.
[8]Mansour GM,El-Lamie IK,El-Sayed HM,et al.Adnexal mass vascularity assessed by 3-dimensional power Doppler:does it add to the risk of malignancy index in prediction of ovarian malignancy:four hundred—case study[J].Int J Gynecol Cancer,2009,19(5):867-872.
[9]Chase DM,Crade M,Basu T,et al.Preoperative diagnosis of ovarian malignancy:preliminary results of the use of 3-dimensional vascular ultrasound[J].Int J Gynecol Cancer,2009,19(3):354-360.
[10]Alcazar JL,Prka M.Evaluation of two different methods for vascular sampling by three-dimensional power Doppler angiography in solid and cystic-solid adnexal masses[J].Ultrasound Obstet Gynecol,2009,33(3):349-354.
[11]Alcázar JL,Rodriguez D,Royo P,et al.Intraobserver and interobserver reproducibility of 3-dimensional power Doppler vascular indices in assessment of solid and cystic-solid adnexal masses[J].Ultrasound Med,2008,27(1):1-6.

