呋喃唑酮代谢物人工抗原的合成及抗体的制备
贾慧勤,丁焕中* ,刘晓云,李小红,张炳旭,鲁晓雄
(1.华南农业大学兽医学院,广州 510642;2.广州万孚生物技术股份有限公司,广州 510641)
呋喃唑酮是人工合成具有5-硝基呋喃基本结构的广谱抗菌药物(结构见图1),代谢迅速,主要用于肠炎和菌痢的治疗[1]。此药抗菌谱广,较少产生耐药性,在养殖业中广泛应用。呋喃唑酮原药及其主要代谢物3-氨基-2-噁唑烷酮具有致畸致突变作用[2-3]。因此含有呋喃唑酮残留的产品被人食用后,会对人体造成严重危害。目前欧盟、美国、韩国、日本、韩国、中国等将呋喃唑酮列为食品动物禁用药物。
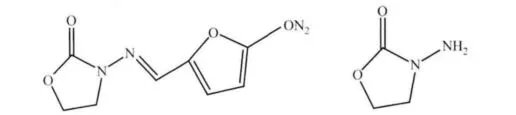
图1 呋喃唑酮及其代谢物
水产品及畜禽产品中呋喃唑酮及其代谢物的检测方法主要有高效液相色谱法(HPLC)[5]、高效液相色谱 -质谱法(HPLC-MS)[6]、液相色谱 - 串联质谱法(LC - MS/MS)[7]、酶 联免疫分析法(ELISA)[8]。HPLC -MS及 LC -MS/MS法的优点是能够在多种残留物同时存在的情况下对某种特定的残留物进行定性、定量分析,而且灵敏度高,但受高昂的仪器成本、复杂的样品处理过程及耗时长等限制,难以在基层检测单位普及。ELISA法操作简便快速,可大大提高检测效率,符合现场快速筛选要求。但是目前市场上所有ELISA试剂盒和胶体金试纸条检测方法都是先将生物样品用对醛基苯甲酸衍生化,抽提出衍生物后再检测,这种检测方法前处理步骤繁琐且耗时较长。解决这一问题首要是制备出抗AOZ特异性抗体,这样样品就不必衍生化处理,检测时间缩短。本研究通过改造呋喃唑酮代谢物结构得到半抗原,采用N-羟基琥珀酰亚胺活化酯法制备了人工抗原,抗AOZ特异性抗体的制备为免疫检测方法的建立与优化奠定了基础。
1 材料与方法
1.1 材料及主要仪器 AOZ,华南农业大学兽医学院药理实验室合成;对醛基苯甲酸、钯碳、1-乙基3-(3-二甲胺丙基)碳二亚胺盐酸盐(EDC)、N-羟基琥珀酸亚胺(NHS),阿拉丁试剂公司;牛血清白蛋白(BSA)、鸡卵清白蛋白(OVA),上海金穗生物科技有限公司;羊抗兔IgG-HRP、弗氏完全佐剂、弗氏不完全佐剂,Sigam公司;新西兰大白兔,广东省实验动物中心。
旋转蒸发仪,上海爱朗仪器厂;液相色谱-串联质谱联用仪,安捷伦6430;紫外/可见分光光度计,UV-1800,岛津公司;酶联免疫检测仪、离心机,Thermo scientific;磁力搅拌器,巩义市予华仪器厂。
1.2 半抗原制备与鉴定 首先以AOZ与对醛基苯甲酸反应合成CPAOZ。取AOZ 204 mg(2 mmol)溶于5mL甲苯,磁力搅拌下加入对醛基苯甲酸300 mg(2 mmol),100℃冷凝回流120 min。停止反应,乙酸乙酯洗涤三次后过滤蒸干得白色固体(合成路线见图2)。用HPLC-MS/MS鉴定目标产物。

图2 CPAOZ的合成路线
取234 mg(1 mmol)CPAOZ溶于4 mL N,N-二甲基甲酰胺(DMF)中,加入适量的钯碳,通入氢气于25℃下搅拌反应,通过TLC板监控反应程度,待反应产物反应完全后用适量的乙酸乙酯进行萃取。反应路线见图3。用HPLC-MS/MS鉴定目标产物。
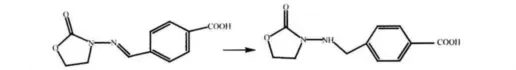
图3 半抗原合成路线
1.3 完全抗原的制备 采用N-羟基琥珀酰亚胺活化酯法以BSA为载体蛋白合成人工免疫抗原。称取15.5 mg半抗原、18 mg EDC、11 mg NHS 溶于DMF中,反应过夜,得A液;称取50 mg BSA,溶于PBS,得B液。将A液逐滴加入B液,反应4 h。透析3 d,1 d换液2次,离心,分装,Folin-酚法测定抗原浓度。紫外可见分光光度法鉴定完全抗原。同时,以相同偶联方法以 OVA作为载体合成包被原。
1.4 动物免疫 选用2只体重2 kg左右的健康雌性新西兰大白兔,生理盐水稀释免疫原,经弗氏完全佐剂乳化后皮下注射,免疫剂量为200μg/只。每隔3周进行一次加强免疫,加强免疫时,免疫原用弗氏不完全佐剂进行乳化。第3次免疫后的第7天耳中动脉采血,用间接ELISA和间接竞争ELISA法检测抗血清效价和特异性,待血清效价和特异性稳定后,进行抗血清的采集。抗血清用辛酸-硫酸铵两步法纯化。
1.5 抗血清的效价及特异性测定 将包被原按预试的1μg/mL的浓度包被酶标板,将纯化好的抗血清 1 ∶10000、1 ∶20000、1 ∶40000、1 ∶80000、1 ∶160000、1 ∶320000 、1 ∶640000、1 ∶1280000 倍比稀释,用间接ELISA测定抗血清的效价,用间接竞争ELISA测定抗血清的特异性。选择效价高且抑制效果好的抗血清,根据方阵滴定以OD450nm值在1.0左右的稀释度作为抗血清的工作浓度,将AOZ稀释成浓度为 0、0.5、1.5、4.5、13.5、40.5、121.5 ng/mL的一系列标准品溶液,建立间接竞争ELISA标准曲线。
将AOZ结构类似物呋喃它酮代谢物、呋喃妥因代谢物、呋喃西林代谢物,按AOZ标准品相同的方法稀释成一系列标准浓度,进行间接竞争ELISA检测,得出其半抑制浓度(IC50)值,计算它们与AOZ的交叉反应率。交叉反应率=(AOZ IC50/结构类似物IC50)×100%。
2 结果
2.1 半抗原结构鉴定 半抗原的分子量为234,分子离子峰为235(图4),表明目标化合物合成成功,且纯度大于85%,能达到偶联要求。
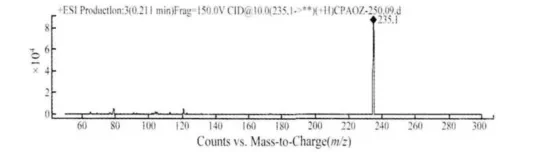
图4 半抗原质谱图
2.2 完全抗原鉴定 由紫外分光光度计鉴定完全抗原。由图5可见,半抗原在272 nm处、BSA在278 nm处有最大吸收,而完全抗原紫外扫描图不同于半抗原和BSA,完全抗原偶联了一定数量的半抗原,在最大吸收波长发生明显偏移,从而初步判定偶联成功。

图5 完全抗原紫外扫描
2.3 抗血清的检测 第4次免疫后,检测出有AOZ特异性抗体产生,抗体效价为1280000,结果见表1。以OD值在1.0左右的稀释度作为抗体工作浓度,将243 ng/mL的AOZ标准液稀释建立间接竞争 ELISA标准曲线(图6),线性方程为:y=-12.2 Ln(x)+98.88,R2=0.994,x 表示待测物浓度,y表示抑制率,计算得 IC50为 5.9 ng/mL,在1~27 ng/mL呈线性关系,以相同方法对抗血清的交叉反应性进行测定,对结构类似物AMOZ、AHD、SEM的交叉反应率分别为 0.76%、0.02%、0.02%、0.83%。

表1 AOZ抗血清的效价
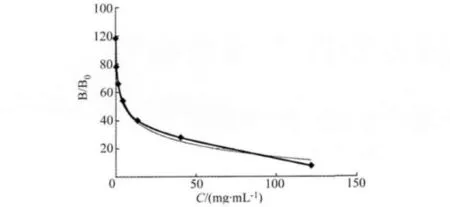
图6 AOZ间接竞争ELISA法标准曲线
3 讨论
AOZ属小分子半抗原,不具有免疫原性,需与载体蛋白偶联以合成人工完全抗原,因而制备出有效的完全抗原是制备AOZ特异性抗体的关键。目前制备呋喃唑酮代谢物抗原的常用方法是将AOZ的氨基和对羧基苯甲醛的醛基缩合反应合成半抗原CPAOZ,偶联蛋白后制备完全抗原,此种方法制备的抗CPAOZ单克隆抗体IC50可达0.30 ng/mL,但是对 AOZ却没有特异性[9-10],这样在检测过程中就要将待检物AOZ衍生化为CPAOZ,此过程操作繁琐,耗时长,不能满足现场快速检测的要求。本方案也引入了对羧基苯甲醛,但是还原了C=N双键,以减小共轭结构对抗原活性的影响,保证抗AOZ特异性抗体的产生,而非是CPAOZ特异性抗体。也曾尝试过在AOZ的氨基上引入4-溴丁酸乙酯或者丁二酸酐作为间隔臂,但是可能由于改造过的半抗原分子量过小,分子的空间结构过于简单,未能得到高效价和高特异性的抗体。
本研究成功制备了半抗原,与BSA偶联后,经紫外扫描对抗原的偶联情况进行鉴定,半抗原与载体的偶联比为16∶1。一般认为偶联比在5∶1~30∶1范围内能产生较好的特异性抗体[11-12]。本实验得到的偶联比为16,通过免疫新西兰大白兔得到了较高灵敏度的抗血清,与结构非常相近的呋喃它酮代谢物几乎没有交叉反应,其IC50为5.9 ng/mL,虽然与目前已报道的检测方法的灵敏度有较大差距,但这是对硝基呋喃代谢物的快速检测方案优化的新尝试。此方案对抗原合成和抗体制备还需进一步的研究和探索。
[1] 陈杖榴.兽医药理学[M].北京:中国农业出版社,2007.
[2] 倪奕昌,邵葆若.硝基呋喃的遗传毒理学性质[J].国外医学(药学分册),1981,(3):150 -152.
[3] Hoogenboom L A,van Bruchem GD,Sonne K,etal.Absorption of amutagenic metabolite released from protein-bound residues of furazolidone[J].Environmental Toxicology and Pharmacology,2002,11(3):273 -287.
[4] 农业部1077号公告 -2-2008[Z].
[5] Yu J X,Hu X Z,Lin Y F,et al.High - performance liquid chromatography-tandem mass spectrometry for the determination of the metabolites of nitrofuran antibiotics in honey and shrimp[J].Journal of Analyticl Science,2004,20(4):382 -385.
[6] Lin Liming,Lin Huichun,Gao Yanhui,et al.Determination of nitrofuran metabolites in animal tissues by isotop dilution linear combination high performance liquid chromatography-mass sepctrometry/mass spectrometry[J].Chinese Journal of Analytical Chemistry,2005,33(8):1081 -1086.
[7] 邢丽红,孙伟红,李兆新,等.液相色谱-串联质谱(LCMS/MS)法快速测定水产品中硝基呋喃类代谢物[J].环境化学,2011,30(6):1022 -1024.
[8] Kevin M Cooper,Anthony Caddell,Christopher T Elliott,et al.Production and characterisation of polyclonal antibodies to a derivative of 3-amino-2-oxazolidinone,a metabolite of the nitrofuran furazolidone[J].Analytica Chemical Acta,2004,520(1/2):79-86.
[9] 徐一平,胥传来.动物源食品中硝基呋喃类物质及其代谢物残留的检测技术研究[J].食品科学,2007,28(10):590-593.
[10] Cooper K M,C T Elliott,D G Kennedy.Detection of 3 - amino -2-oxazolidinone(AOZ),a tissue- bound metabolite of the nitrofuran furazolidone,in prawn tissue by enzyme immunoassay[J].Food Additives & Contaminants,2004,21(9):841 -848.
[11] Singh K V,Jasdeep Kaur,Grish C Varshney,et al.Synthesis and characterization of hapten-protein conjugates for antibody production against smallmolecules[J].Bioconjugate Chemistry,2004,15(1):168 -173.
[12]张庆华,高建忠,熊清明,等.恩诺沙星完全抗原的制备试验[J].免疫学杂志,2008,24(6):703 -706.

