人β防御素-3在人工关节感染患者中的表达及其意义的实验研究
倪卫东,罗 羲,费 军,黄显凯,杜顺华
人工关节术后感染被称为人工关节置换术的灾难性并发症,其中由血浆凝固酶阴性的葡萄球菌等毒力较低的细菌所致的慢性感染,常难以明确诊断并与无菌性松动鉴别[1],目前尚无统一诊断标准。笔者采用观察人β防御素-3(human beta-defensin-3,HBD-3)在人工关节感染、假体无菌性松动、占位器治疗后的假体周围的松质骨及正常髂骨中的表达情况,初步探讨其与人工关节感染的关系,为进一步探索其能否作为人工关节感染诊断及与假体无菌性松动鉴别的一种方法奠定基础。
材料与方法
1 一般资料
自2009年11月~2010年4月及2012年7月~2012年9月,收集住院治疗患者术中切取的人工关节感染患者假体周围组织13例(男性8例,女性5例);假体无菌性松动的假体周围组织8例(男性5例,女性3例);明确诊断为人工关节感染经清创,放置万古霉素骨水泥占位器和抗生素等综合治疗,感染得到有效控制后行关节翻修术者的占位器周围组织9例(男性4例,女性5例);四肢骨折患者行取髂骨植骨的正常髂骨7例(男性3例,女性4例)。按临床诊断分别分为人工关节感染组、假体无菌性松动组、占位器治疗后组及正常组。收集所有患者的术前外周血白细胞计数、ESR、CRP结果。
人工关节感染组均为术后2个月及以上始出现患肢关节持续性疼痛患者。其纳入标准采用骨肌系统感染学会(musculoskeletal infection society,MSIS)2012年发布的假体周围感染的诊断方法,如下:(1)存在与假体相通的窦道;(2)假体周围组织两处或多处取材或关节滑液细菌培养结果为同一病原菌;(3)以下6种情况满足4种及以上者:① a.血沉及血清C-反应蛋白增高者;② 关节滑液白细胞计数增高者;③ 关节滑液中性粒细胞百分比增高者;④ 关节内发现脓液者;⑤ 假体周围组织或关节滑液一次细菌培养发现细菌者;⑥ 假体周围组织高倍镜(400倍)下>5个中性粒细胞,至少5个独立视野。本组13例中3例为金黄色葡萄球菌,5例为血浆凝固酶阴性的葡萄球菌,1例表皮葡萄球菌,1例铜绿假单胞菌,3例未培养出细菌。
2 切片制备和HE染色光镜观察
所有标本以4%多聚甲醛固定,固定后置入0.5M PH8.0的EDTA缓冲液中脱钙,每7天更换1次相同浓度EDTA缓冲液,直至细针插入组织无阻力时为脱钙终点。常规脱水透明及石蜡包埋,连续5μm切片。常规HE染色,光镜下观察各组组织切片的形态及炎性细胞浸润情况。
3 切片免疫荧光染色和观察
3.1 主要试剂:抗HBD-3为鼠抗人多克隆抗体(NOVUS公司)。兔抗小鼠荧光抗体(ZYMED公司)。
3.2 染色、观察和平均光密度值测量:切片经脱蜡复水,枸橼酸盐抗原热修复,3%过氧化氢封闭内源性过氧化物酶,1%BSA封闭以减少非特异性染色,4℃孵育一抗过夜。复温后孵育TRITC染料标记的荧光二抗及DAPI染色,封片镜检,以PBS代替一抗作阴性对照。倒置相差荧光显微镜下观察阳性细胞数目及强度,任选5个独立视野成像,并采用Imagepro plus(IPP)7.0C图像分析软件,测量每个视野下阳性细胞的平均光密度值。
3.3 统计方法:采用SPSS 17.0统计学软件进行统计学分析,统计发现不满足t检验的要求(正态且方差齐),故采用两独立样本的秩和检验进行两组间比较,P<0.05为差异具有统计学意义。
结 果
1 各组HE染色结果
各组大体组织肉眼观察无区别,各组HE染色结果于显微镜下(×200)观察,见各组切片组织主要为骨小梁及骨髓构成,形态无明显差别,各组均无炎性细胞浸润(图1)。
图1 各组骨组织HE染色情况( ×200)
2 各组免疫荧光染色结果
免疫荧光染色于OLYMPUS-IX71倒置相差荧光显微镜下观察HBD-3表达情况。如图2所示,人工关节感染组、假体无菌性松动组及占位器治疗后组均可见骨细胞的胞浆中存在HBD-3表达(绿色箭头所示),且无明显差异。人工关节感染组、假体无菌性松动组、占位器治疗后组及正常组的骨小梁的骨内膜上均可见不同程度的HBD-3(白色箭头所示),以感染组最多及阳性程度最高,依次为假体无菌性松动组、占位器治疗后组、正常组。蓝色颗粒则为被DAPI所染色的细胞核(黄色箭头所示)。
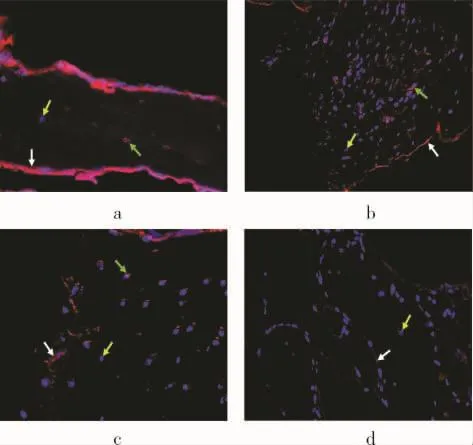
图2 各组松质骨免疫荧光染色情况( ×200)
3 各组平均光密度值结果
表1 各组的平均光密度值±s)

表1 各组的平均光密度值±s)
images/BZ_221_233_1474_1192_1532.png 人工关节感染组13 0.473±0.017无菌性松动组 8 0.345±0.006a占位器治疗后组 9 0.242±0.005bd正常组 7 0.138±0.003cde
人工关节感染组与假体无菌性松动组比较:aP<0.01;人工关节感染组与占位器治疗后组比较:bP<0.01;人工关节感染组与正常组比较:cP<0.01;无菌性松动与占位器治疗后组比较:dP<0.01;无菌性松动组与正常组比较:dP<0.01;占位器治疗后组与正常组比较:eP<0.01
4 外周血白细胞计数、ESR、CRP结果
其中外周血白细胞计数正常参考范围为(4~10×109);ESR正常参考范围为(男 <15mm/h,女<20mm/h)CRP正常参考范围为(0~0.8)。各项指标结果以各组结果以±s)的形式表示,结果如下见表2。
表2 各组白细胞计数、ESR、CRP结果(±s)

表2 各组白细胞计数、ESR、CRP结果(±s)
分组 白细胞计数(×109) ESR(mm/h)CRP(mg/dl)人工关节感染组0.39±0.08 6.19±1.98 35.15±23.47 2.39±2.51无菌性松动组 6.26±0.88 8.13±2.64a0.41±0.08占位器治疗后组 5.24±0.81 10.78±5.31b0.50±0.24正常组 6.12±0.68 8.29±2.29c
外周血白细胞计数各组两两比较:P>0.05。ESR及CRP人工关节感染组与假体无菌性松动组比较:aP<0.01;人工关节感染组与占位器治疗后组比较:bP<0.01;人工关节感染组与正常组比较:cP<0.01;无菌性松动与占位器治疗后组比较,无菌性松动组与正常组比较及占位器治疗后组与正常组比较:P>0.05
讨 论
人工关节感染为内置物相关感染,按病程区分可分为急性感染、亚急性感染和慢性感染。其中急性感染临床表现较为明显,诊断多无困难。然而慢性感染则多为如血浆凝固酶阴性的葡萄球菌等毒力较低的致病菌所致的人工关节假体周围感染,时常难以与假体无菌性松动进行有效鉴别,目前尚缺乏统一标准。其诊断方法为结合患者病史、症状及体征、影像学检查及各种辅助检查结果依靠术者经验作出综合判断。然而慢性人工关节感染患者常无特异性临床表现及体征,各种检查方法各有其局限性,术者的经验并不完全相同,因此现临床应用的诊断方法并不完全可靠。
外周血白细胞计数是临床常用的感染诊断指标,在局部感染和其他非感染性疾病时均可出现不同程度的增高,对慢性人工关节感染的诊断价值有限[2]。Di Cesare 等[3]报告患者术前外周血白细胞计数在人工关节感染与非感染间的差别没有统计学意义,本研究中各组两两比较均无统计学意义,因此我们认为外周血白细胞计数在慢性人工关节感染的诊断及其与假体无菌性松动的鉴别中价值不大。但同时仍应认识到,当外周血白细胞计数升高超出正常参考范围时,依然可以提示存在感染可能,尽管影响其升高的因素较多。
ESR及CRP是诊断感染性疾病的常用指标,但在用于单纯诊断人工关节感染时,尚需排除患者同时存在其他部位感染、合并结缔组织疾病或类风湿性关节炎等可导致ESR及CRP升高的情况。Della Valle等[2]的研究报道ESR对人工关节感染诊断的准确率为77%,CRP的准确率为84%。多数学者认为在排除干扰因素后,ESR及CRP在诊断人工关节感染时仍具有较高的诊断效力[2-3]。本研究中ESR和CRP在感染组与假体无菌性松动组间的差别及感染组与正常组间的差别具有统计学意义,表明ESR和CRP在人工关节感染的诊断及其与假体无菌性松动的鉴别中均具有参考价值。尽管如此,但其值正常时仍不能除外人工关节感染。
抗菌肽(antimicrobial peptides,AMPs)是一类具有广谱抗菌性的活性小分子肽类,是多种生物机体的一线防御物质[4-5],具有高效、广谱及不易产生耐药性等优点。人防御素为抗菌肽中的一个家族,其中人 β防御素现主要发现有 3种[6],HBD-3比HBD-1、HBD-2具有更强的抗菌活性[7],人β防御素(HBD-3除外)的抗菌活性在生理盐浓度下或二价阳离子存在时可受到强烈抑制[8-9],且HBD-3的表达增高与感染、肿瘤等疾病的发生具有相关性[10-11]。而 Warnke等[12]的研究表明,HBD-3 是骨组织固有免疫的一部分,在感染下颚骨中,骨小梁旁的骨内膜上及骨细胞的胞浆中均存在表达。而正常下颚骨的骨内膜上表达相对前者较弱,且骨细胞胞浆中无HBD-3表达,Stockmann等[13]对颚骨坏死的研究报告了相同的结果。但HBD-3在人工关节感染和假体无菌性松动的松质骨中的表达是否具有差异,以及其差异能否帮助判断感染或感染与松动的区分,目前国内外尚无相关研究。
人工关节感染的治疗单独使用抗生素是很难成功治愈的,且药物必须满足对细菌敏感,能抑制细菌生物膜的形成以及能杀灭生物膜内的细菌[14],因此常需手术治疗。人工关节感染的治疗多采用Ⅱ期翻修,即取出原有假体,尽可能清除炎性组织后配合使用抗生素及放置万古霉素骨水泥占位器等综合治疗,待感染得到有效控制后再进行翻修术的手术方式,优点在于感染清除率高,再感染率较低[15]。人工关节感染、占位器治疗后、感染治愈,是人工关节感染Ⅱ期翻修治疗的3个阶段,现尚无HBD-3在占位器治疗后的骨组织中的相关报道。
本研究分为4组,分别为人工关节感染组、假体无菌性松动组、占位器治疗后组、正常组。慢性人工关节感染通常为深部感染,存在感染或炎症反应的范围较广。在放置万古霉素占位器等综合治疗后,即便感染的症状得到有效控制,ESR和CRP指标正常时,深部组织内仍存在炎症反应。假体无菌性松动所产生的炎症反应,与磨损的聚乙烯颗粒等异物刺激有关[16-17],其炎症反应为慢性无菌性炎症反应。在各组平均光密度值的结果中,感染组高于其余各组,无菌性松动组高于正常组,占位器治疗后组高于正常组。推测感染或炎症反应可诱导HBD-3在局部的表达增加,且与其程度具有一定相关性,在感染局部的表达可能是一种能较好反应局部炎症程度的指标。就取材部位而言,本研究所取组织为感染局部组织,反应的是感染局部的炎症反应的情况,仅需要除外可引起局部炎症反应的一些疾病和情况。而临床常用的外周血白细胞计数、ESR、CRP为取外周静脉血所得出的结果,反应的是机体对感染等疾病作出的全身性反应的情况,可受到诸如患者其他部位存在感染或结缔组织病等多种方面的影响,尚需排除可引起其增高的全身性和(或)局部性疾病等因素,所需除外的因素较多而复杂。
综上分析我们认为,在人工关节感染的假体周围的松质骨内,HBD-3的表达都可能能较好的反应局部感染的情况,对于人工关节感染的诊断及其与假体无菌性松动的鉴别是一种较好的参考指标或方法。对Ⅱ期翻修综合治疗后,感染是否已控制的判断上也具有一定参考价值。
[1] Zimmerli W,Ochsner PE.Management of infection associated with prosthetic joints[J].Infection,2003,31(2):99-108.
[2] Della Valle CJ,Sporer SM,Jacobs JJ,et al.Preoperative testing for sepsis before revision total knee arthroplasty[J].J Arthroplasty,2007,22(6S2):90-93.
[3] Di Cesare PE,Chang E,Preston CF,et al.Serum interleukin-6 as a marker of periprosthetic infection following total hip and knee arthroplasty[J].J Bone Joint Surg(Am),2005,87(9):1921-1927.
[4]Beisswenger C,Bals R.Functions of antimicrobial peptides in host defense and immunity[J].Curr Protein Pept Sci,2005,6(3):255-264.
[5] Dubin A,Mak P,Dubin G,et al.New generation of peptide antibiotics[J].Acta Biochim Pol,2005,502(3):633-638.
[6] Selsted ME,Tang YQ,Morris WL,el al.Purification,primary structures,and antibacterial activities of beta-defensins,a new family of antimicrobial peptides from bovine neutrophils[J].J Biol Chem,1993,268(9):6641-6648.
[7] Paulsen F,Pufe T,Conradi L,et al.Antimicrobial peptides are expressed and produced in healthy and inflamed human synovial membranes[J].J Pathol,2002,198(3):369-377.
[8] Harder J,Bartels J,Christophers E,et al.Isolation and characterization of human beta-defensin-3.a novel human inducible peptide an tibiotic[J].J Biol Chem,2001,276(8):5707-5713.
[9] Garcia JR,Jaumann F,Sehulz S,et al.Identification of a novel,multifunctional beta-defensin(human beta-defensin3)with specific antimicrobial activity:its interaction with plasma membranes of Xenopus oeytes and the induction of maerophage chemoattraction[J].Cell Tissue Res,2001,306(2):257-264.
[10] Dressel S,Harder J,Cordes J,et al.Differential expression of antimicrobial peptides in margins of chronic wounds[J].Exp Dermatol,2010,19(7):628-632.
[11] Shuyi Y,Feng W,Jing T.Human beta-defensin-3(hBD-3)upregulated by LPS via epidermal growth factor receptor(EGFR)signaling pathways to enhance lymphatic invasion of oral squamous cell carcinoma[J].Oral Surg Oral Med Oral Pathol Oral Radiol Endod,2011,112(5):616-625.
[12] Warnke PH,Springer IN,Russo PA,et al.Innate immunity in human bone[J].Bone,2006,38(3):400-408.
[13] Stockmann P,Wehrhan F,Schwarz-Furlan S,et al.Increased human defensine levels hint at an inflammatory etiology of bisphosphonate-associated osteonecrosis of the jaw:an immunohistological study[J].J Transl Med,2011,15(9):135-141.
[14] Zimmerli W,Trampuz A,Ochsner PE.Prosthetic-Joint infections[J].N Engl J Med,2004,351(16):1645-1654.
[15] Haddad FS,Muirhead-Allwood SK,Manktelow AR,et a1.Two-stage uncemented revision hip arthroplasty for infection[J].J Bone Joint Surg(Br),2000,82(5):689-694.
[16]Harris WH.Wear and periproshetic osteolysis:the problem[J].Clin Orthop Relat Res,2001,12(393):66-70.
[17] Matthews JB,Besong AA,Green TR,et al.Evaluation of the response of pirmary human peirpheral blood mononuclear phagocytes to challenge with in vitro generated clinically relevant UHMWPE patricles of known size and dose[J].J Biomed Mater Res,2000,52(2):296-307.

