pEGFP/A2M(FP6)转染神经干细胞海马移植治疗APP/PS1双转基因AD小鼠的实验观察
武强 ,李露斯 ,范文辉 ,黎红华 ,濮捷 ,徐志鹏 ,程鹤 ,杨柳 ,刘菲 ,廖光昊
pEGFP/A2M(FP6)转染神经干细胞海马移植治疗APP/PS1双转基因AD小鼠的实验观察
武强1,李露斯2,范文辉2,黎红华1,濮捷1,徐志鹏1,程鹤1,杨柳1,刘菲1,廖光昊1
目的:携带pEGFP/A2M(FP6)的神经干细胞(NSCs)定向移植到APP/PS1双转基因AD小鼠海马内,观察移植细胞的分化、迁移,脑内Aβ沉积的变化,以及对AD小鼠学习记忆功能的影响。方法:APP/PS1转基因AD小鼠分为假手术(SO)组、人工脑脊液(ACSF)组、转染pEGFP的NSCs(pEGFP-NSCs)组及转染pEGFP/A2M(FP6)的NSCs(pEGFP/A2M(FP6)-NSCs)组,移植物小鼠海马CA1区定位注射,水迷宫实验检测小鼠认知功能,免疫组化观察小鼠脑内移植细胞的分化、迁移及Aβ病理变化。结果:pEGFP/A2M(FP6)-NSCs组和pEGFP-NSCs组转基因小鼠逃避潜伏期较SO组及ACSF组显著缩短(P<0.05);pEGFP/A2M(FP6)-NSCs组转基因小鼠逃避潜伏期较pEGFP-NSCs组缩短(P<0.05)。pEGFP/A2M(FP6)-NSCs组和pEGFP-NSCs组转基因小鼠海马及皮质内,部分Aβ染色阳性斑块周围可见表达EGFP的移植细胞。pEGFP/A2M(FP6)-NSCs组转基因小鼠额叶、海马区域,Aβ染色阳性斑块数量和平均面积均较其他3组显著减少(P<0.05)。移植的NSCs,部分细胞Nestin染色呈阳性,部分细胞GFAP染色呈阳性,少数细胞MAP-2染色呈阳性。结论:移植pEGFP/A2M(FP6)NSCs到APP/PS1双转基因AD小鼠海马,可减少AD小鼠脑内Aβ斑块沉积,部分移植的NSCs分化为神经元及星形胶质细胞,小鼠的学习记忆功能显著改善。
神经干细胞;pEGFP/A2M(FP6);APP/PS1双转基因小鼠
fanwenhui@gmail.com
阿尔茨海默病(Alzheimer’s disease,AD)是发生于老年和老年前期以进行性认知障碍和记忆力损坏为主的中枢神经系统退行性疾病[1]。本课题组前期已成功将携带α2巨球蛋白(alpha-2macroglobulin,A2M)cDNA片段[A2M(FP6)]-增强型绿色荧光蛋白(pEGFP)重组质粒[pEGFP/A2M(FP6)]转染神经干细胞(neural stem cells,NSCs),在体外多次传代不影响目的基因的表达及NSCs的分化[2]。研究显示,pEGFP/A2M(FP6)的转染能明显提高体外培养的NSCs体系对β淀粉蛋白(amyloidβ,Aβ)毒性的耐受性[3]。本研究拟观察携带pEGFP/A2M(FP6)的NSCs脑内移植后,能否减少Aβ斑块的沉积并改善AD小鼠的认知功能。
1 材料与方法
1.1 材料
1.1.1 实验动物 B6C3-Tg(APPswe,PSEN1de9)85Dbo/J品系双转基因小鼠杂合体种鼠购于Jackson动物中心。繁殖后得到APP/PS1转基因AD小鼠32只,非转基因小鼠32只,均为11~12月龄,分笼喂养于光照/黑暗为12 h/12 h的恒温环境,2只/笼,自由摄食和饮水。
1.1.2 主要试剂与材料 山羊抗小鼠Nestin一抗、兔抗小鼠胶质纤维酸性蛋白(glia fibrillary acidic protein,GFAP)一抗购于Santa Cruz公司;小鼠抗小鼠微管相关蛋白 -2(microtubule associated protein-2,MAP-2)一抗购于Chemicon公司;小鼠抗人Aβ一抗购于Sigma公司。异硫氰酸荧光素(fluoresceinisothiocyanate,FITC)标记的山羊抗兔、山羊抗小鼠及兔抗山羊二抗、罗丹明标记的山羊抗小鼠、兔抗山羊及山羊抗兔二抗均购于北京中杉金桥生物技术有限公司。江湾I型动物脑立体定位仪购于上海奥尔科特生物科技有限公司,Leica冰冻切片机购于Leica公司,荧光显微镜(OLYMPUS IX70)购于OLYMPUS公司,Morris水迷宫DMS-2系统由中国科学院药物研究所提供。
1.2 方法
1.2.1 分组及海马移植 实验小鼠分为4组(每组含APP/PS1转基因AD小鼠及非转基因小鼠各8只):①假手术(sham operated,SO)组:仅进行动物麻醉、手术钻孔后缝合头皮;②人工脑脊液(artificial cerebrospinal fluid,ACSF)组:海马移植ACSF 5 μL;③转染 pEGFP的 NSCs(pEGFP-NSCs)组:海马细胞移植转染pEGFP的NSCs 2×105个,溶于 5μLACSF;④转染 pEGFP/A2M(FP6)的 NSCs(pEGFP/A2M(FP6)-NSCs)组:海马移植转染pEGFP/A2M(FP6)的NSCs 2×105个,溶于 5μL ACSF。海马CA1区移植:麻醉小鼠后固定于脑立体定位仪;于前囟后2.3mm,矢状缝右侧旁开2.0mm,常规钻孔,微量注射器抽吸5μL移植物,硬脑膜下进针1.8mm;注射速度1μL/m in,注射完留针 15m in,缓慢退针;术后预防感染。
1.2.2 学习记忆功能测定 术后 53~59 d进行水迷宫实验(隐蔽平台获得实验+空间搜索实验)测定各组小鼠学习记忆功能。在隐蔽平台获得实验中,测量小鼠的逃避潜伏期,用于检测学习和记忆能力;在空间搜索实验中,测量在规定时间内小鼠在目标象限的百分比,用于测量记忆保持能力。
1.2.3 小鼠脑内移植物的免疫组织化学鉴定 术后60 d,处死小鼠,灌注取脑,切片厚度35μm,将包含海马注射位点的所有切片按顺序收集于盛有抗冻缓冲液的12孔培养板中,每隔5张切片取1张切片,每只小鼠可得5套部位相同或相近、每套包含海马和齿状回的12张切片。采用漂片法免疫荧光组织化学染色检测Nestin、GFAP及MAP-2的表达,抗体稀释比例均为1:100,荧光显微镜观察摄片。数码图像应用Image-Pro plus6.0图像分析软件进行统计处理。
1.2.4 小鼠脑组织的Aβ免疫组织化学分析 取包含海马注射位点的连续5张切片,采用漂片法免疫荧光组织化学染色检测Aβ的表达。小鼠抗人Aβ抗体稀释比例1:1 000,罗丹明标记的山羊抗小鼠二抗稀释比例为1:50,荧光显微镜观察摄片。数码图像应用Image-Pro plus6.0图像分析软件进行统计处理。
1.3 统计学处理
采用SPSS 10.0软件处理数据,计量资料以(x±s)表示,组间比较采用双因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 水迷宫测试结果
2.1.1 隐蔽平台获得实验 各组平均逃避潜伏期随训练时间延长均明显缩短,提示各组小鼠均有学习记忆的能力。比较各组双转基因小鼠第4、5、6天的平均逃避潜伏期 ,pEGFP/A2M(FP6)-NSCs组 及pEGFP-NSCs组明显较SO组及ACSF组缩短(P<0.05),以 pEGFP/A2M(FP6)-NSCs组尤为明显,且pEGFP/A2M(FP6)-NSCs组较pEGFP-NSCs组缩短(P<0.05),见图1A。各组非转基因小鼠的平均逃避潜伏期差异无统计学意义,见图1B。
2.1.2 空间探索实验 pEGFP-NSCs组和pEGFP/A2M(FP6)-NSCs组的APP/PS1双转基因AD小鼠在目标象限搜索时间的百分比较SO及ACSF组有所增加,以pEGFP/A2M(FP6)-NSCs组更明显,但各组间差异无统计学意义,见图2。
2.2 各组小鼠脑内移植物的免疫组织化学鉴定
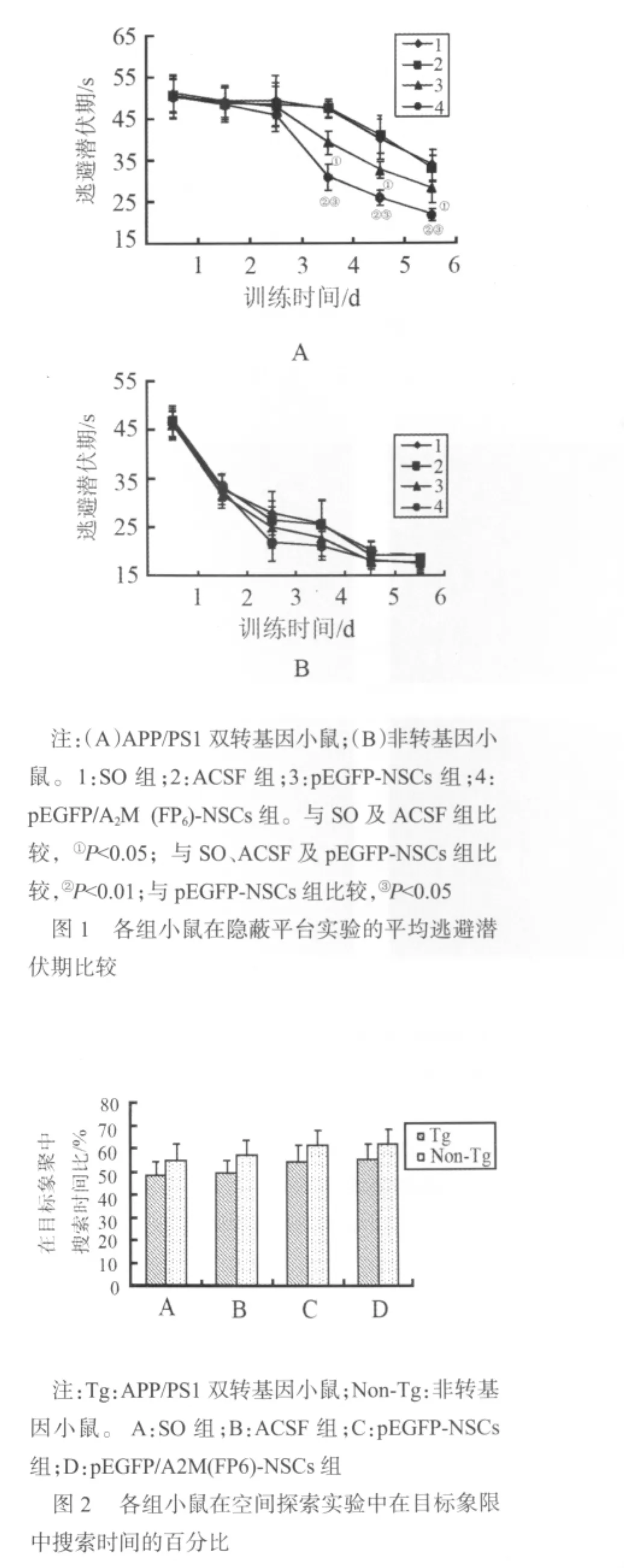
ACSF组和SO组小鼠脑内未见表达EGFP的细胞,而pEGFP/A2M(FP6)-NSCs组和pEGFP-NSCs组小鼠脑内可见表达EGFP的细胞,大多分布在针道附近,发出亮绿色荧光,部分细胞向深部迁移,见图3A,部分迁移到同侧大脑皮质,亦有部分细胞沿着胼胝体向对侧大脑迁移;部分EGFP阳性细胞分布在Aβ斑块周围,见图3B。移植的部分细胞Nestin染色呈阳性,见图3C;部分细胞GFAP染色呈阳性,少量细胞MAP-2染色呈阳性,见图3D。
2.3 各组小鼠脑组织的Aβ免疫组织化学分析
各组APP/PS1双转基因AD小鼠注射侧相同部位的额叶皮质及海马区Aβ免疫荧光结果显示,pEGFP-NSCs组及ACSF组小鼠额叶皮质及海马区Aβ斑块数量及平均面积与SO组相比差异无统计学意义,但3组Aβ斑块数量及平均面积均显著高于 pEGFP/A2M(FP6)-NSCs组(P<0.01),见表 1,图 4。
3 讨论
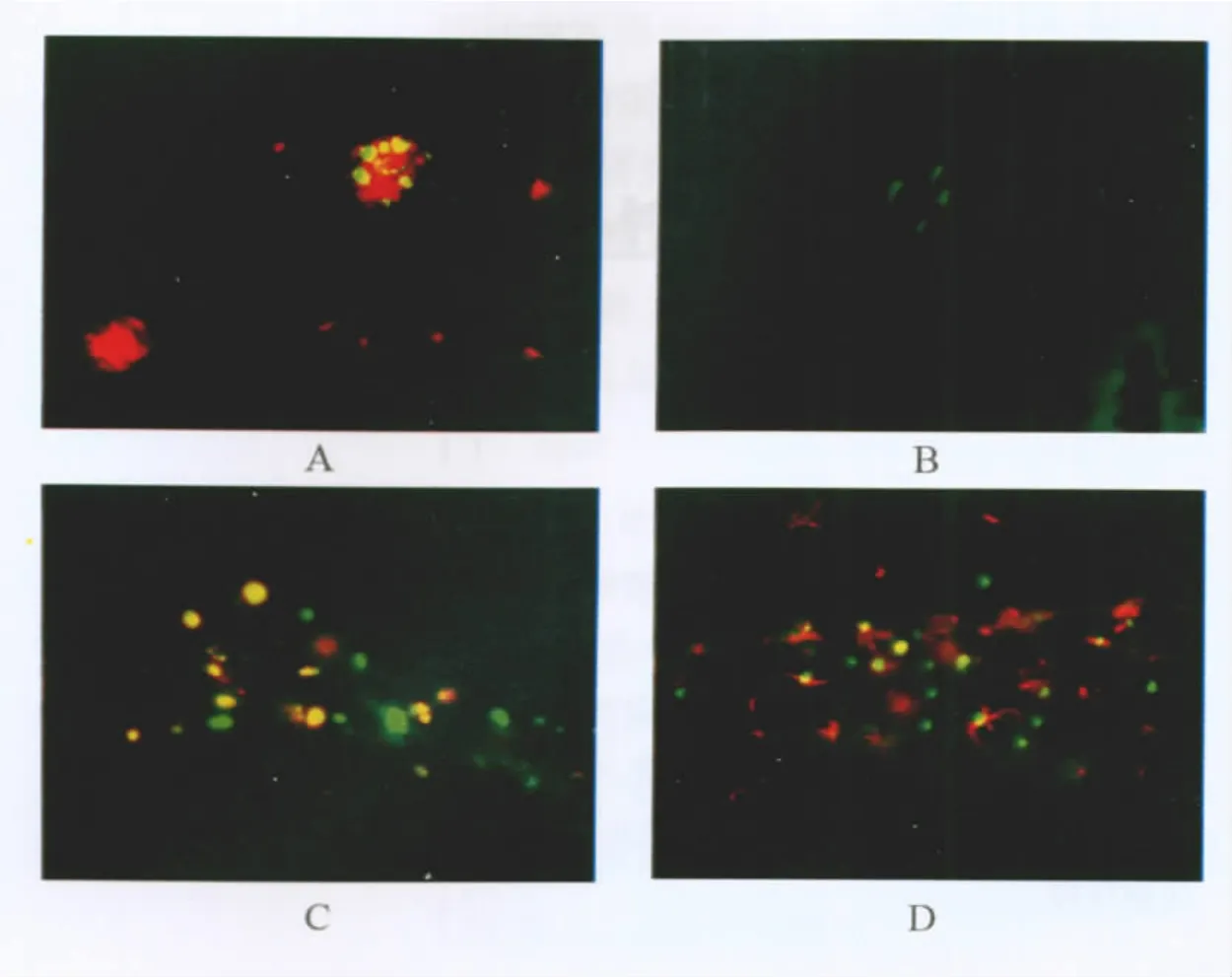
图3 pEGFP/A2M(FP6)-NSCs组小鼠脑内移植物的免疫组织化学鉴定结果(荧光显微镜,×200)
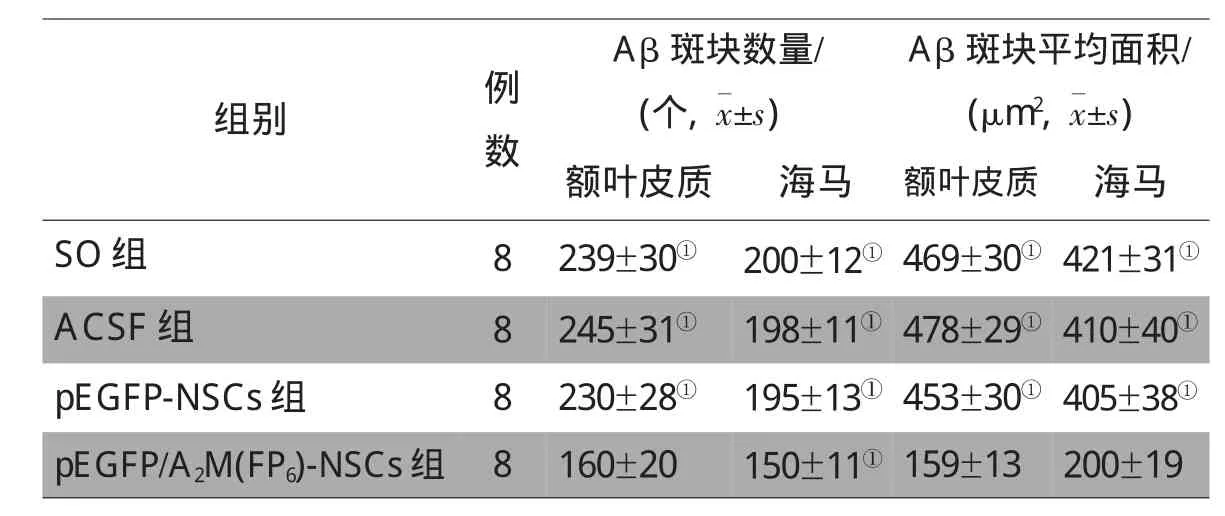
表1 各组小鼠额叶皮质、海马Aβ斑块数量及平均面积
A2M是Aβ的一种高亲和力的结合蛋白,其C末端的27个氨基酸可与Aβ肽特异性结合来中和Aβ的毒性,降解并清除Aβ。通过不同的限制性内切酶消化及PCR技术可将A2M分为FP1~6共6个片段,Aβ与FP6段选择性结合,且具有高度特异性[4],提示A2M(FP6)可能成为一个治疗AD的新方向。前期本课题组已将pEGFP/A2M(FP6)重组质粒利用Nucleofector转染技术成功转染进 NSCs,转染了 pEGFP/A2M(FP6)的NSCs在体外经多次传代后仍可表达A2M(FP6)mRNA及A2M蛋白,NSCs本身仍能分化为神经元和神经胶质细胞[2]。
本实验发现,移植转染pEGFP/A2M(FP6)-NSCs组APP/PS1双转基因AD小鼠海马及皮质内,Aβ斑块数量及平均面积均明显减少。结合本课题组前期体外实验的结果[2],笔者推测转染了pEGFP/A2M(FP6)的NSCs在体内也具有合成A2M(FP6)蛋白的功能。本实验结果显示,部分移植的EGFP阳性细胞包绕Aβ斑块,包含EGFP阳性的移植细胞因同时包含有A2M(FP6),推断移植的细胞可能将A2M(FP6),定向输送到病变的Aβ斑块周围,从而清除Aβ。
本实验水迷宫测试结果显示,海马移植pEGFP/A2M(FP6)-NSCs组及pEGFP-NSCs组均能显著改善APP/PS1双转基因AD小鼠的学习记忆功能,其中以pEGFP/A2M(FP6)-NSCs组更为显著。而在空间探索实验中,各组的APP/PS1双转基因AD小鼠及非转基因小鼠在目标象限停留时间比例差异无统计学意义,但pEGFP-NSCs组和pEGFPA2M(FP6)-NSCs组的APP/PS1双转基因AD小鼠在目标象限搜索时间的百分比有所增加,以pEGFP/A2M(FP6)-NSCs组更为明显。虽无统计学意义,但可能说明海马移植转染pEGFP/A2M(FP6)NSCs对APP/PS1双转基因AD小鼠的空间记忆保持能力较其它组小鼠改善更明显。从水迷宫实验的结果可以得出,转染pEGFP/A2M(FP6)的NSCs海马移植后,可以显著地改善AD小鼠的学习记忆功能。推断其原因,可能由于转染pEGFP/A2M(FP6)的NSCs可以减少皮质及海马区Aβ斑块的沉积,从而改善了小鼠的学习记忆功能。本研究还显示,pEGFP-NSCs组中AD小鼠在水迷宫测试中,其逃避潜伏期较对照组明显缩短,但小鼠脑内Aβ斑块并无明显变化。推测可能是由于pEGFPNSCs组没有针对Aβ环节的治疗措施,移植后小鼠的Aβ斑块没有变化。但可能移植后的NSCs在局部微环境的作用下,分化成为胆碱能神经元和其他神经支持细胞,提高了AD小鼠的学习记忆功能[5]。
实验中笔者观察到移植后的NSCs可向同侧皮质迁移,也可沿胼胝体向对侧大脑迁移,而且部分EGFP阳性细胞迁移后可包绕Aβ斑块,移植的NSCs多数分化为星形胶质细胞,少量分化为神经元。这也与大多数学者的研究一致,且研究显示,NSCs迁移分化的机理可能与所处的微环境密切相关,局部环境而不是NSCs自身的内在特性决定了移植细胞的最终命运[6,7]。Kim等[9]研究认为,在成年脑组织中,NSCs必须迁移到靶区域才能表现出它们的神经可塑性。另外,NSCs是未分化的原始细胞,具有低免疫源性,移植后相对较少发生异体排斥反应,有利于其存活[10]。Tate等[11]的研究显示,移植后的NSCs能被特异性吸引到脑内神经退行性变区域,即NSCs具有Aβ损伤区的自主追踪性,可以在治疗AD等全脑神经退行性病变中起传递治疗性分子的作用,然而目前尚不清楚刺激NSCs迁移的信号为Aβ本身还是Aβ造成的损伤区释放的炎症分子。
本实验结果初步表明,转染pEGFP/A2M(FP6)-NSCs海马移植可以减少APP/PS1双转基因小鼠额叶皮质及海马区的Aβ斑块沉积,并能改善AD小鼠的学习记忆障碍,但其作用机制仍有待作进一步的研究。如何诱导NSCs向修复所需的神经功能(目的)细胞分化,诱导NSCs在病变部位定向分化为胆碱能神经元,建立功能连接,优化用于对NSCs进行修饰的基因或药物等问题还需要进一步的探索。
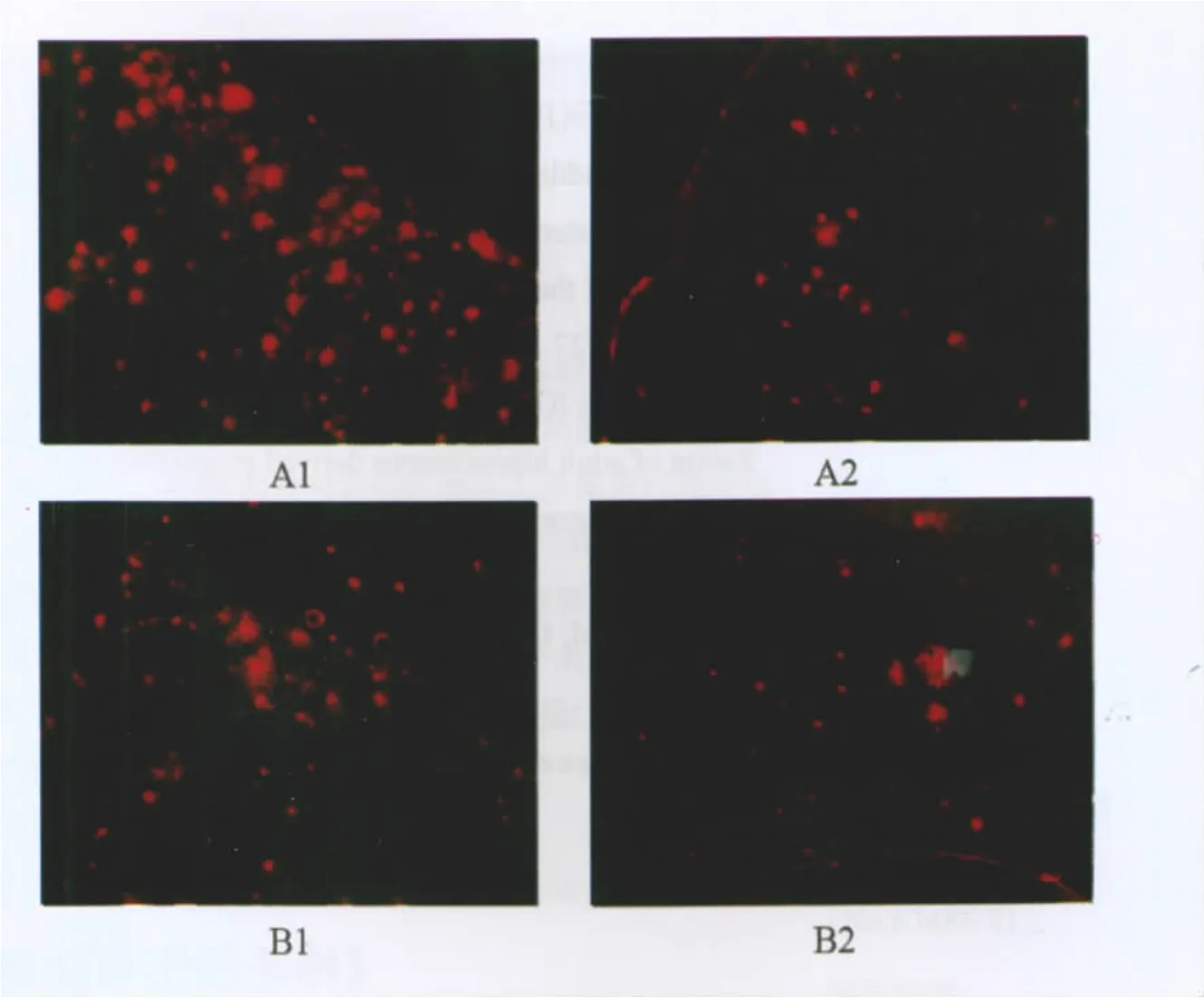
图4 SO组及pEGFP/A2M(FP6)-NSCs组双转基因AD小鼠额叶皮质及海马区Aβ斑块免疫荧光染色结果(荧光显微镜,×200)
[1]Clark C,Karlaw ish J.A lzheimer disease:Current concepts and emerging diagnostic and therapeutic strategies[J].Ann Intern Med,2003,138:400-410.
[2]武强,李露斯,范文辉,等.pEGFP/A2M(FP6)重组质粒转染小鼠胚胎神经干细胞的实验研究[J].神经损伤与功能重建,2011,6:19-23.
[3]刘之荣,范文辉,李露斯.pEBFP/FP6共表达质粒转染神经干细胞的实验研究 [J].西北国防医学杂志,2007,28:124-126.
[4]Mettenburg JM,Webb DJ,Gonias SL.Distinct binding sites in the structure ofα2-macroglobuin mediate the interaction withβ-amyloid peptide and growth factors[J].JBiol Chem,2002,277:13338-13345.
[5]武强,李露斯,范文辉,等.小鼠胚胎神经干细胞海马移植对APP/PS1双转基因AD小鼠的治疗作用[J].第三军医大学学报,2007,29:915-918.
[6]Vescovi AL,Synder EY.Establishment and propertiesof neuralstem cell clones:plasticity in vitro and in vivo[J].Brain Pathology,1999,9:569-598.
[7]Shihabuddin LS,Homer PJ,Ray J,et al.Adult spinal cord stem cells generate neurons after transplantation in the adult dentate gyrus[J].JNeurosci,2000,20:8727-8735.
[8]Suhonen JO,Peterson DA,Ray J,etal.Differentiation of adulthippocampus derived progenitors into olfactory neurons in vivo[J].Nature,1996,383:624-627.
[9]Kim HM,Qu T,Kriho V,etal.Reelin function in neural stem cell biology[J].Proc Natl Acad Sci USA,2002,99:4020-4025.
[10]Modo M,Rezaie P,Heuschling P,etal.Transplantation of neural stem cells in a rat model of stroke:assessmentof short-term graftsurvivaland acute host immunological response[J].Brain Research,2002,958:70-82.
[11]Tate BA,Werzanski D,Marciniack A,et al.M igration of neural stem cells to A lzheimer-like lesions in an animalmodel of AD[J].Soc Neurosci Abstr,2000,26:496-497.
Treatment of APP/PS1 Double Transgenic mice of Alzheimer’s Disease by Transplanting pEGFP/A2M
(FP6)Transfected Neural Stem Cells into the Hippocampus
WU Qiang▲,LILu-si,FAN Wen-hui,LI Hong-hua,PU Jie,XU Zhi-peng,CHENG He,YANG Liu,LIU Fei,LIAO Guang-hao.▲Department ofNeurology,GeneralHospitalofGuangzhou PLA,Wuhan 430070,China
Objective:To observe themigration and differentiation of pEGFP/A2M(FP6)transfected neural stem cells(NSCs),the depositsof Aβin the brain and the change of learning andmemory ability of APP/PS1 double transgenicmice of Alzheimer’s Disease(AD)after the NSCswere transplanted into the hippocampus.Methods:APP/PS1 transgenic ADmicewere random ly divided intofour groups:sham operated(SO)group,artificial cerebrospinal fluid(ACSF)group,transfected pEGFP neural stem cell(pEGFP-NSCs)group and transfected pEGFP/A2M(FP6)neural stem cell(pEGFP/A2M(FP6)-NSCs)group.The ACSF,pEGFP-NSCs or pEGFP/A2M(FP6)-NSCswere transplanted into the CA1 region of the hippocampusof themice.The learning andmemory ability of themicewereassessedwith M irrorwatermaze test.Themigration and differentiation of pEGFP/A2M(FP6)transfected NSCsand the depositsof Aβin thebrain of themicewereobserved by immunohistochem istry.Results:The latenciesof pEGFP/A2M(FP6)-NSCsgroup and pEGFP-NSCsgroup were significantly shorter than that in the SO group and ASCF group(P<0.05).The latency of pEGFP/A2M(FP6)-NSCs groupwasshorter than that in the pEGFP-NSCsgroup(P<0.05).Anti-Aβdetection showed Aβdeposits in the hippocampusand cortex of pEGFP/A2M(FP6)-NSCsgroup and pEGFP-NSCsgroup were surrounded by transplanted NSCs.The amount and average size of Aβdeposits in the hippocampus and cortex of pEGFP/A2M(FP6)-NSCs group were reducedmarkedly,compared with the other three groups(P<0.05).The expression of Nestin was detecte after transplantation.Immunofluorescent detection indicated thatmajority of transplanted cells expressed GFAPwhile only a few cells expressed MAP-2.Conclusion:Transplantation of pEGFP/A2M(FP6)-NSCs into the hippocampal region of APP/PS1 double transgenic ADmice could reduce the Aβdeposits and promote the learning andmemory ability.Partial transplanted NSCsw illdifferentiate into neuronsorastrocytes.
neuralstem cells;pEGFP/A2M(FP6);APP/PS1 double transgenicmice
R741;R741.05
A
1001-117X(2013)02-0103-06
1.广州军区武汉总医院神经内科 武汉430070
2.第三军医大学西南医院神经内科 重庆400038
收稿目期2012-09 -06
范文辉
- 神经损伤与功能重建的其它文章
- 《神经损伤与功能重建》杂志网络投稿及审稿系统正式启用公告

