HPLC同时测定新健胃包芯片中5种蒽醌类成分的含量
李平,郑艳春,杨冬丽,张东阁,崔雅慧,闫春风,秦婷
(颈复康药业集团有限公司,河北省中药新辅料工程技术研究中心,河北 承德 067000)
HPLC同时测定新健胃包芯片中5种蒽醌类成分的含量
李平,郑艳春*,杨冬丽,张东阁,崔雅慧,闫春风,秦婷
(颈复康药业集团有限公司,河北省中药新辅料工程技术研究中心,河北 承德 067000)
目的:建立HPLC法测定新健胃包芯片中5种蒽醌类成分的含量。方法:色谱柱:Diamonsil C8柱,流动相:甲醇(A)-0.3%磷酸(B)梯度洗脱,柱温:25 ℃,流速:1.0 mL·min-1,检测波长:430 nm。结果:芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚平均回收率(n=9)分别为99.5%,97.7%,105.4%,100.1%,106.1%,RSD值分别为1.15%,1.76%,1.79%,1.74%,1.93%;芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚分别在进样量为0.041~0.205、0.041~0.202、0.049~0.245、0.097~0.484、0.042~0.212 μg与峰面积呈良好线性关系。结论:该方法简便、灵敏、结果准确可靠,适用于该制剂中蒽醌类成分的质量控制。
包芯片;芦荟大黄素;大黄酸;大黄素;大黄酚;大黄素甲醚;HPLC
新健胃包芯片由陈皮、大黄、黄芩、苍术等中药组成,是在新健胃片[WS-10080(ZD-00807)-2002]剂型的基础上进行的工艺改进和剂型的改革,具有清热燥湿,制酸和胃之功效,方中黄芩具有清热燥湿、泻火解毒功效,大黄具清热解毒功效,是方中主药,原标准仅收载了黄芩苷的含量测定方法,相关大黄及其制剂的文献多以测定大黄素、大黄酚含量为主,新健胃包芯片在原标准的基础上增加了大黄中5 种蒽醌类成分的检测,以期更全面控制该制剂的内在质量。
1 仪器与试药
1.1 仪器
Agilent 1200型高效液相色谱仪:1260型高压泵,1260 DAD检测器;梅特勒AE240电子分析天平;KQ100超声波清洗器(昆山市超声仪器有限公司)。
1.2 试药
芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚对照品(中国食品药品检定研究院,批号分别为:110795-201007,110757-200206,110756-200110,110796-200615,110758-200912);新健胃包芯片(承德颈复康药业集团有限公司,批号:20120305,20120306,20120307,规格:每片重0.53 g);甲醇为进口色谱纯(美国);水为重蒸水;其他试剂均为分析纯。
2 方法与结果
2.1 色谱条件
色谱柱:Diamonsil C8柱(250 mm×4. 6 mm,5 μm),流动相:甲醇(A)-0.3%磷酸(B),梯度洗脱,检测波长:430 nm;流速:1.0 mL·min-1;柱温:25 ℃;进样量:10 μL。
2.2 对照品、供试品溶液的制备及测定方法
2.2.1 对照品溶液的制备 分别称取芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚对照品适量,精密称定,加甲醇制成浓度分别为10,10,10,20,10 μg·mL-1的混合对照品溶液。
2.2.2 供试品溶液的制备 取新健胃包芯片20片,研细,称取3.0 g,精密称定,置具塞锥形瓶中,精密加入甲醇50 mL,密塞,称定重量,75 ℃回流1.5 h,放冷,再称,甲醇补足减轻的重量,摇匀,滤过,精密量取续滤液25 mL,蒸干,残渣加8%(v/v)盐酸20 mL,超声处理2 min,再加入三氯甲烷20 mL,加热回流2 h,冷却,置入分液漏斗中,分取三氯甲烷层,水层再用三氯甲烷振摇提取4 次,每次20 mL,合并三氯甲烷液,蒸干,残渣加甲醇溶解,转移至10 mL量瓶中,并稀释至刻度,摇匀,滤过,取续滤液,即得。分别精密吸取对照品和供试品溶液各10 μL,注入液相色谱仪,测定[1],计算大黄各成分含量。
2.3 线性关系考察
分别称取芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚对照品适量,精密称定,加甲醇制成含芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚41.08,40.48,39.7,76.8,42.36 μg·mL-1的对照品贮备溶液,再分别精密吸取贮备液 1,2,3,4,5 mL 置10 mL 量瓶中,加甲醇稀释至刻度,摇匀,按测定方法测定,以样品的浓度为横坐标(X),测得的峰面积值为纵坐标(Y),进行线性回归,得回归方程。芦荟大黄素:Y1=23.111X1+3.3,r=0.999 7;大黄酸:Y2=20.877X2-9.17,r=0.999 6;大黄素:Y3=21.402X3+5.31,r=0.999 8;大黄酚:Y4=25.139X4+6.83,r=0.999 9;大黄素甲醚:Y5=12.559X5-2.8,r=0.999 6。表明芦荟大黄素在进样量0.041~0.205 μg,大黄酸在进样量0.041~0.202 μg,大黄素在进样量0.049~0.245 μg,大黄酚在进样量0.097~0.484 μg,大黄素甲醚在进样量0.042~0.212 μg与峰面积呈良好线性关系。
2.4 干扰性试验
按处方比例(缺大黄)称取其他中药,按照新健胃包芯片的制备工艺和供试品溶液的制备方法制备空白溶液,作为阴性对照溶液。按上述色谱条件测定,结果见图1。
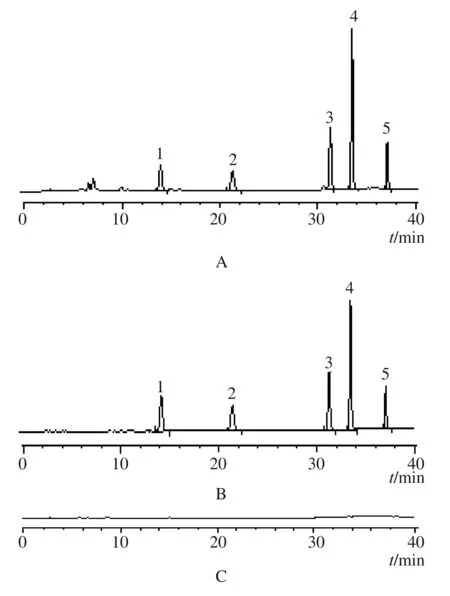
A:新健胃包芯片样品 B:对照品 C:阴性对照品1.芦荟大黄素 2.大黄酸 3.大黄素 4.大黄酚 5.大黄素甲醚图1 新健胃包芯片及对照品HPLC图
2.5 精密度试验
取上述供试品(批号:20120305)溶液,按上述色谱条件,平行进样6次,芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚峰面积的RSD值分别为0.32%,0.35%,0.12%,0.15%,0.32%。
2.6 稳定性试验
取上述供试品溶液,分别于0,2,4,6,8,10,12 h进行测定,芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚峰面积RSD 分别为0.31%,0.43%,0.20%,0.11%,0.22%,结果表明供试品溶液在12 h内稳定。
2.7 重现性试验
取同一批次样品(批号:20120305)6份,按2.2制备供试品溶液,测定,计算芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚含量,结果RSD分别为0.89%,1.01%,0.76%,0.85%,1.15%,表明重现性良好。
2.8 加样回收率试验
取同一批号样品(批号:20120305)1.5 g,精密称定,另精密称取一定量对照品加入样品中,按2.2制备供试品溶液,测定,计算回收率(n=9),结果见表1。
2.9 样品含量测定
取样品3批,按2.2制备供试品溶液,按上述色谱条件分别测定各成分的峰面积,计算样品中各组分含量及总含量(n=3),结果见表2。
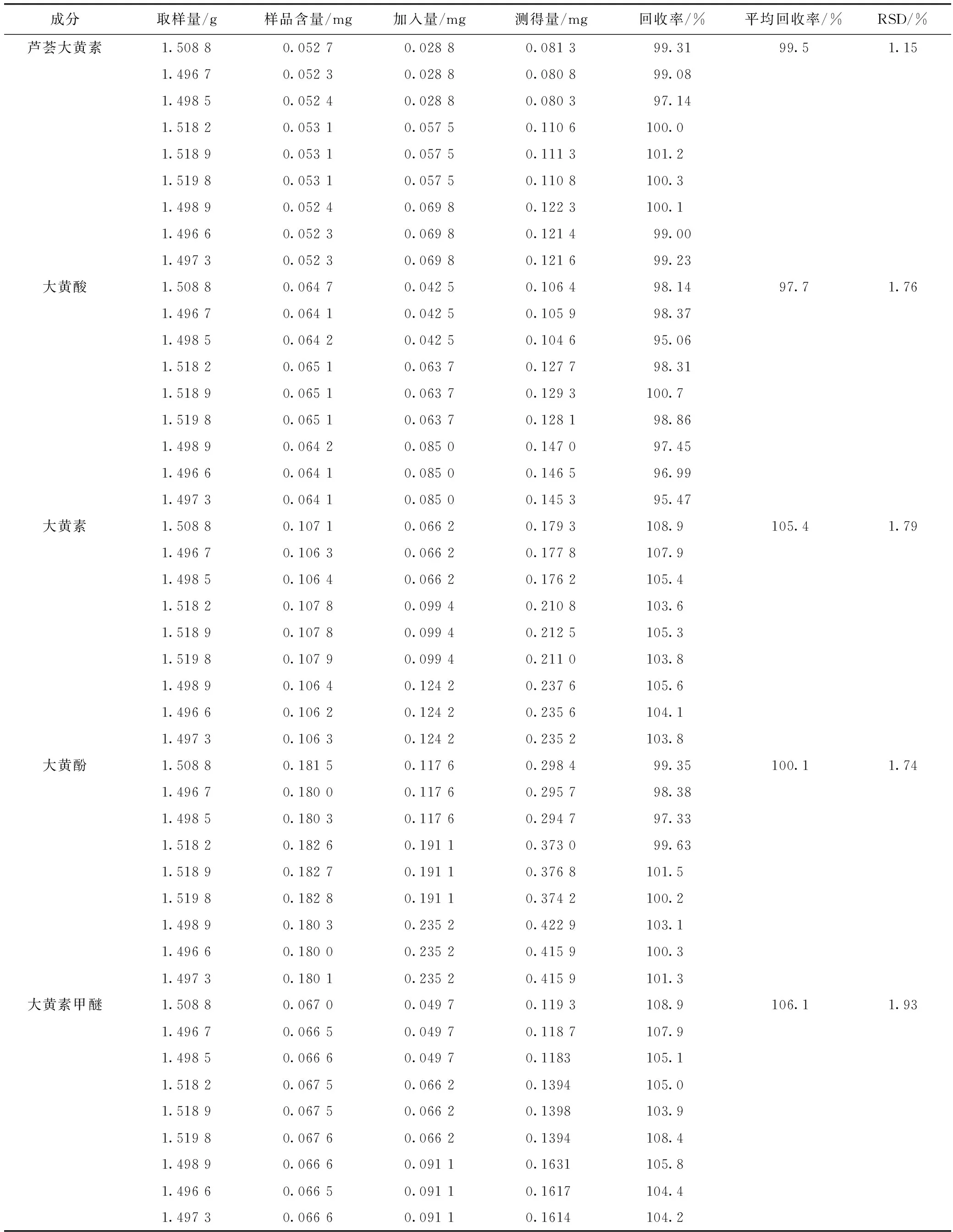
表1 加样回收率试验
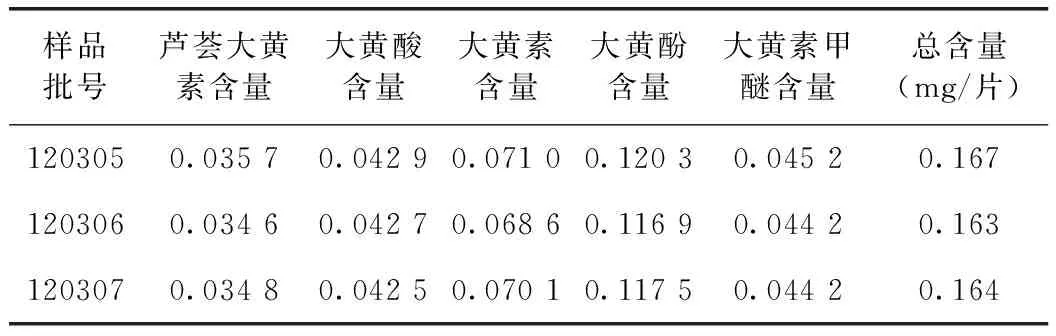
表2 5种蒽醌类成分含量测定结果 /mg·g-1
3 讨论
3.1 波长的选择
根据参考文献[2]及光谱扫描的结果,大黄蒽醌类成分在254、430 nm下均有明显吸收,在实验研究中发现,本制剂在254 nm下分离5种成分[3]时,芦荟大黄素前后各有一个干扰峰,很难分离,而在430 nm下消除了其他吸收峰的干扰,各峰分离较好。
3.2 色谱柱的选择
根据文献[2-9],大多数蒽醌类成分的检测色谱柱为C18柱,本实验在研究中发现,使用C18柱子芦荟大黄素分离较差,大黄素的前面有干扰峰存在,很难分离,而用C8柱样品分离好,出峰时间短。
3.3 提取温度及提取溶剂的选择
试验中考察了样品在70~100 ℃水浴下提取、蒸干,结果发现80 ℃以上各成分均有不同的降低[4],在75 ℃提取、蒸干、水解时的含量最高。提取溶剂[5]主要考察了乙醇、10%盐酸-乙醇(3∶1)、甲醇,结果以甲醇提取含量最高,提取液容易过滤,蒸干快。
3.4 提取方法的选择
主要选择了甲醇回流法和超声法以及放置过夜再超声法,结果发现回流法提取的各成分含量高,超声法偏低[3,10]。可能的原因是大黄蒽醌类成分在水解过程中温度不同水解的程度不同,该结果与实验中得出的结果相符,相关的化学性质还有待于进一步的考察。
[1] 国家药典委员.中国药典[S].一部.北京:中国医药科技出版社,2010:22-23.
[2] 何素琴,欧阳吉德,肖琳.HPLC法测定胆石通胶囊中芦荟大黄素、大黄酸、大黄素、大黄酚及大黄素甲醚的含量[J].西北药学杂志,2011,26(3):180-182.
[3] 张红霞,金艺,许海燕,等.HPLC 法测定胃力片中大黄酸、大黄素、大黄酚和大黄素甲醚的含量[J].沈阳药科大学学报,2007,24(7):417-419.
[4] 杨柳,许舜军.大黄蒽醌类成分在提取过程中的量变规律[J].中国医院药学杂志,2007,27(7):908-910.
[5] 吕慧英,赵晨曦,梁逸曾,等.5种大黄蒽醌类衍生物的同时测定及应用[J].时珍国医国药,2009,20(10):2490-2492.
[6] 方既明,章怀奋.高效液相色谱法同时测定麻仁丸中大黄素、大黄酚、大黄酸、大黄素甲醚、芦荟大黄素的含量[J].中南药学,2011,9(5):342-346.
[7] 王瑞芬,郭海丽.HPLC同时测定喘舒片中5种蒽醌类成分的含量[J].中成药,2011,33(3):446-449.
[8] 吴俊珠,周浓,罗碧燕,等.HPLC测定黄连上清丸中5 种大黄蒽醌类化合物的含量[J].云南中医中药杂志,2010,31(9):66-67.
[9] 岳淑梅,冯玲玲,齐潇潇,等.肝宁颗粒中大黄所含5种蒽醌苷元的HPLC测定[J].中成药,2008,30(8):1155-1158.
[10] 樊磊磊. HPLC法测定通腑胶囊中大黄素、大黄酸、大黄酚、大黄素甲醚及芦荟大黄素的含量[J].中国医药指南,2011,9(12):11-12.
DeterminationofFiveAnthraquinoneComponentsinXinJianweiPackageTabletbyHPLC
LI Ping,ZHENG Yan-chun*,YANG Dong-li,ZHANG Dong-ge,CUI Ya-hui,YAN Chun-feng,QIN Ting
(JingfukangPharmaceuticalGroupCo.Ltd.,TheNewExcipientsofTraditionalChineseMedicineEngineeringResearchCenterofHebeiProvince,Chengde067000,China)
Objective:To establish a HPLC method for determining five anthraquinone components in Xin Jianwei package tablet.Methods:Diamonsil C8column was used with the mobile phase methanol(A)-0.3% phosphate acid solution(B),gradient elution,the flow rate was 1.0 mL·min-1and detection wavelength was set at 430 nm.Results:The average recoveries of aloe-emodin,rhein,emodin,chrysophanol and physcion were 99.5%,97.7%,105.4%,100.1%,106.1% respectively;RSD were 1.15%,1.76%,1.79%,1.74%,1.93% respectively.The linear range of them was 0.041~0.205,0.041~0.202,0.049~0.245,0.097~0.484,0.042~0.212 μg respectively.Conclusion:The method is simple,sensitive,accurate and can be used for the quality control of Xin Jianwei package Tablet.
Package tablet;Aloe-emodin;Rhein;Emodin;Chrysophanol;Physcion;HPLC
2012-09-16)
*
郑艳春,Tel:(0314)2292050,E-mail:zhengyanchun2001@163.com

