温脾通络开窍汤对AD大鼠海马GSK-3β和PP2A活性的影响及作用机制1)
杨进平,吴 林,陈 炜,郑福奎,蔡鑫昆,温惠娟,王青碧,毕信亚
阿尔茨海默病(AD)又称老年性痴呆,是一种以进行性记忆障碍和智能衰退为主要临床特征的中枢神经系统退行性疾病[1]。AD发病机制极其复杂,病因学尚不清楚,其典型的病理特征是老年斑(SP)形成、神经纤维缠结(NFT)及胆碱能神经元的变性、坏死。其中,NFT的数量和患者的痴呆程度呈明显的正相关,被认为是AD患者的神经元退化的病理基础[2],是AD的核心病理改变。NFT的主要成分是由异常过度磷酸化的tau蛋白聚集而形成的双螺旋(PHFs)。糖元合成酶激酶3β(GSK-3β)是最重要的催化tau蛋白磷酸化的蛋白激酶之一[3],GSK-3β在tau蛋白磷酸化及其在AD致病过程的作用及GSK-3β抑制剂在AD防治方面具有潜在作用[4]。而蛋白质磷酸酶2A(PP2A)是一种丝/苏氨酸磷酸酶,能使蛋白质脱磷酸,PP2A活性的降低可能是导致AD患者脑中Tau蛋白过度磷酸化的原因[5]。
本实验应用脑立体定向技术向大鼠海马注射冈田酸建立AD大鼠动物模型,采用酶联免疫吸附法检测大鼠海马GSK-3β和PP2A活性,观察温脾通络开窍汤对其表达水平的影响,探讨温脾通络开窍汤抗AD的作用及机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 3月龄SPF级雄性SD大鼠60只,体重(200±20)g,由广西医科大学动物中心提供(编号:SCXK2007-0002)。
1.1.2 实验药品及试剂 温脾通络开窍方(黄芪30g,益智仁10g,三七10g,石菖蒲10g,何首乌10g,绞股蓝10g),由江苏江阴天江药业有限公司提供中药配方颗粒;冈田酸(OA)Sigma公司生产(批号:04511);二甲亚砜(DMSO)Amresco公司生产(批号:0231);石杉碱甲,浙江震元制药有限公司生产(批号:120303);GSK-3β及PP2A大鼠Elisa试剂盒均购自上海碧云天生物技术有限公司。
1.1.3 主要器材和设备 脑立体定位仪(ST-3ND型脑立体定位),成都仪器厂生产;Morris水迷宫设备全套(包括Morris水迷宫、电脑摄像系统、配套软件分析系统),北京中科院生理所生产;酶标仪(ELX-800,美国BlO-Tek)。
1.2 实验方法
1.2.1 造模方法 60只SD大鼠适应性喂养1周,大鼠经10%水合氯醛3mL/kg腹腔注射麻醉后,固定于大鼠脑立体定位仪上。52只大鼠实施OA右侧的海马CA1区注射造模,另8只作为空白对照组。参照George等《大鼠脑立体定向图谱》,选择右侧海马CA1区,为注射靶区。用特制三棱针手动钻颅骨,将溶于10%DMSO的 OA 1.5μL(0.4mmol/L)缓慢注入。空白组大鼠于相同部位注射等体积的10%DMSO。间隔2d后以相同方法再注射一次。所有大鼠术后伤口均涂适量红霉素软膏,术后腹腔注射青霉素钠8×104U/只,以防感染。
1.2.2 Morris水迷宫制作及MWM定位航行实验 MWM参照相关文献制作[6],将水池等分为4个象限,在第三象限中心放置一黑色平台,平台为圆形,直径11cm,平台高28cm(称隐藏平台)。水迷宫正上方2m高处装有一个小型摄像机,记录大鼠逃避潜伏期及跨越平台次数。MWM实验共进行4.5d。定位航行实验:每天分上下午2个时间段,每个时间段每只大鼠训练4次。每次均随机顺序从不同等分水池的4个起点将大鼠面向池壁放入池中,记录其60s内成功进驻平台所需时间(即逃避潜伏期)。如在60s内大鼠不能成功进驻平台,则将其引上平台并令其停留10s,记录逃避潜伏期为60s,每次训练间隔时间为60s。每一时间段内4次潜伏期的算术均数作为这一时间段的成绩。
1.2.3 AD模型筛选 造模14d后进行AD模型筛选,按照上述定位航行实验方法,参照赵宪林等[7]的AD大鼠模型筛选标准进行筛选,计算模型组大鼠各时段成绩平均逃避潜伏期与参考值之差占该鼠的平均逃避潜伏期时间比例,该值>20%定为AD大鼠。造模2周内造模组大鼠死亡4只,空白组死亡1只。经过筛选,造模组48只大鼠符合要求的大鼠40只进行后续实验,造模成功率为76.9%。
1.3 分组及给药剂量 将造模成功的模型组大鼠40只随机分为温脾通络开窍方高、中、低剂量组,西药对照组,模型组。每组8只。空白组7只。造模第20天开始灌胃给药,给药量均按人与大鼠体表面积系数比确定,以临床人用药等效剂量作为中剂量,中药高、中、低剂量组大鼠的给药剂量分别为4.15g/kg、8.3 g/kg、16.9g/kg,西药组给药剂量为3mg/kg。模型组及空白对照组均予相应体积的双蒸水灌胃。各组大鼠按剂量每天灌胃给药一次,共21d。治疗期间,模型组、中药低剂量组、中药中剂量组各死亡2只,西药组、中药高剂量各死亡1只。
1.4 取材 动物水迷宫后断头,冰台上迅速取脑,分离海马组织一部分放入-80℃冰箱冻存为下一步实验备用。另一部分称其重量,加入一定量的PBS(pH7.4)溶液,用匀浆器将标本匀浆 充分,离心20min左右(3 000r/min),收集上清,分装后放于-80℃待检测。
1.5 检测方法 标准品稀释与加样:在酶标包被板上设标准孔8个。每孔中各加入标准品稀释液50μL。加样:设空白孔、待测样品孔。在酶标包被板上待测样品孔中先加样品稀释液40 μL,然后再加待测样品10μL。温育:用封板膜封板后置37℃温育30min。配液:将20倍浓缩洗涤液用蒸馏水20倍稀释后备用。洗涤:小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30s后弃去,如此重复5次,拍干。加酶:每孔加入酶标试剂50μL,空白孔除外。显色:每孔先加入显色剂A 50μL,再加入显色剂B 50μL,轻轻震荡混匀,37℃避光反应15min。使用酶标仪在450nm波长依序测量各孔的吸光度(OD值)。
1.6 统计学处理 应用SPSS15.0分析,计量资料用均数±标准差(±s)表示。对数据进行方差齐性检验,若方差齐,采用单因素方差分析,若方差不齐则对数据进行适当的变量转换以满足方差齐性检验,若转换数据仍未达到方差齐要求,则改用秩和检验。
2 结 果
Elisa结果,模型组GSK-3β的活性较空白组有提高(P<0.05),而PP2A的表达两者相比有降低。中药低剂量组和西药组与模型组比较无统计学意义。中药高、中剂量组与模型组相比有统计学意义(P<0.05),GSK-3β的活性亦明显低于模型组,而PP2A的表达明显高于模型组,其中尤以中药高剂量组的作用最明显,中药高、中、低剂量组之间存在一定的量效关系。详见表1。
表1 温脾通络开窍法对AD大鼠脑组织GSK-3β和PP2A活性的影响(±s) pg/mg
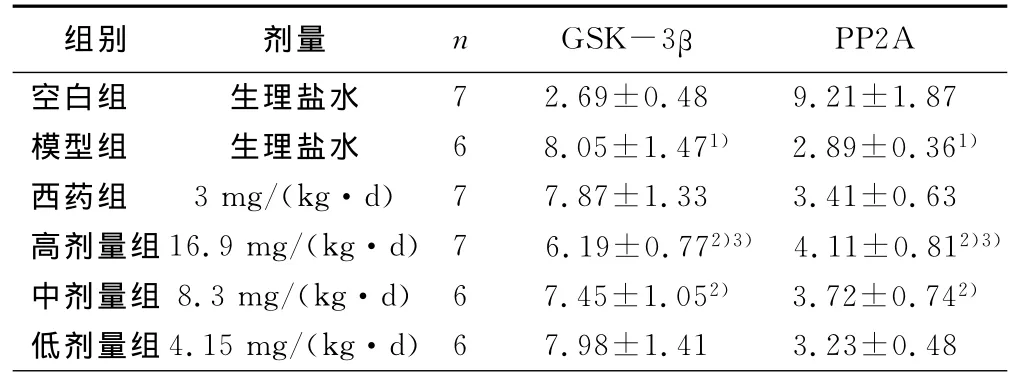
表1 温脾通络开窍法对AD大鼠脑组织GSK-3β和PP2A活性的影响(±s) pg/mg
与空白组比较,1)P<0.05;与模型组比较,2)P<0.05;与西药组比较,3)P<0.05
组别 剂量 n GSK-3βPP2A空白组 生理盐水7 2.69±0.48 9.21±1.87模型组 生理盐水 6 8.05±1.471) 2.89±0.361)西药组 3mg/(kg·d) 7 7.87±1.33 3.41±0.63高剂量组16.9mg/(kg·d) 7 6.19±0.772)3) 4.11±0.812)3)中剂量组 8.3mg/(kg·d) 6 7.45±1.052) 3.72±0.742)低剂量组4.15mg/(kg·d) 6 7.98±1.41 3.23±0.48
3 讨 论
GSK-3β是一个深受关注的蛋白激酶[8],因能够磷酸化并抑制糖原合成过程中的限带酶-糖原合成酶(glycogen synthase)而得名。GSK-3β是AD脑中引起Tau蛋白异常过度磷酸化的最主要蛋白激酶,其在AD脑中含量增高,并主要集中于神经元纤维缠结。它主要参与AD的病理形成,主要途径是使微管相关蛋白(Tau蛋白)磷酸化,在许多异常磷酸化位点使Tau蛋白磷酸化,Tau磷酸化后导致微管蛋白不稳定,并聚集成神经纤维缠结,可致神经元可塑性改变及神经元退行性变化[9],GSK-3β在许多异常磷酸化位点使Tau蛋白磷酸化,目前的研究证实,GSK-3β能够磷酸化Tau蛋白上的10个位点,这一活性能调节Tau与微管的结合,进而影响神经元的结构和可塑性。GSK-3β的活性可通过磷酸化调节,Ser9磷酸化后活性抑制,而Ty r216磷酸化后活性增高[10]。另外,GSK-3β抑制对星形胶质细胞生长锥的延伸和运动性亦是十分重要的。GSK-3β对微管结合域C端的磷酸化能力较强,且被GSK-3β磷酸化的tau蛋白有更强的成纤维特性[11]。
蛋白质磷酸酶2A是一种丝/苏氨酸磷酸酶,能够使蛋白质脱磷酸,具有多种生物活性。蛋白磷酸酯酶的降低,特别是PP2A活性的降低可能是导致AD脑中tau以及其他蛋白过度磷酸化的原因[6]。具有代谢活性的大鼠脑片和转基因动物模型研究表明,PP2A的活性降低不仅仅导致其催化tau去磷酸化的能力下降,而且还可通过激活cAMP依赖性蛋白激酶(PKA)、应激激活的蛋白激酶和钙/钙调蛋白依赖性的蛋白激酶Ⅱ(CaMK2Ⅱ)和应激激活蛋白激酶等激酶的活性来引起tau的异常过度磷酸化。实验研究还发现,AD患者脑中磷酸酶PPI,PP2A和PP2B的活性均明显低于正常脑,特别是PP2A的活性丢失严重,而蛋白激酶的活性则显著升高。张魁华等[12]发现,AD模型组大鼠脑组织神经元表达脱磷酸的磷酸酯酶PP2A明显减少,降低程度为正常的66%左右,而温脾通络开窍方治疗组可以使这种现象得到改善。
本实验采用冈田酸海马区注射制作AD模型,通过ELISA方法检测大鼠海马GSK-3β和PP2A的活性,模型组大鼠海马GSK-3β的水平较空白组有明显降低,中药组各组GSK-3β的水平较模型组有所下降,其中高、中剂量组作用明显。模型组大鼠海马PP2A的水平较空白组有明显升高,中药组各组PP2A的水平较模型组有所升高,其中高、中剂量组作用明显。从以上可以看出,本实验中药组之间存在一定的量效关系,温脾通络开窍方在一定剂量范围内可以抑制GSK-3β和提高PP2A的活性,降低AD模型大鼠Tau异常磷酸化的水平,故温脾通络开窍方具有抗AD的治疗作用。
由于AD发病机制复杂,单一作用点药物很难取得满意效果,目前仍缺乏有效的防治药物,临床主要用胆碱酯酶抑制剂,但也只能改善早、中期患者的部分症状。而中医药不但在缓解衰老及衰老相关疾病的防治方面有着丰富的理论和实践经验,且其还具有多途径、多方式、多靶点特征。本研究结果也体现了温脾通络开窍汤多靶点、多途径的优势。
[1] 丁新生.重视Alzheimer病的诊治[J].临床神经病学杂志,2005,18(4):241-243.
[2] 陈罗西,郭玲玲,李亮.Morris圆形水迷宫的应用及其相关检测指标分析[J].辽宁中医药大学学报,2008,8(10):55-57.
[3] Riley KP,Snowdon DA,Markesbery WR.Alzheimer’s neurofibrillary pathology and the spectrum of cognitive function:Findings from the nun study[J].Ann Neurol,2002,51(5):567-577.
[4] Alonso Adel C,Zaidit,Grundke-Iqbal I,et al.Role of abnormally phosphory latedsin the breakdown of microtubules in Alzheimer disease[J].Procnat Acad Sci USA,1994,91(12):5562- 5566.
[5] 刘飞,施建华,丁绍红,等.糖原合成激酶3B对微管蛋白Tau的磷酸化作用[J].生物化学与生物物理进展,2007,34(9):945-951.
[6] Gong CX,Liu F,Grundke IQ,et al.Poet tmnslatiorud modificationsof Tau protein in Alzheimers disease[J].J Neural Transm,2005,112(6):813.
[7] 赵宪林,方秀斌,李东培.大鼠血管性痴呆模型制作[J].中国医科大学学报,2002,31(3):166-167.
[8] Analyze the change in Tau phosphorylation in a GSK-3βbeta and Tau over- expressing EcR-293cell line[J].Neurochem Int,2006,48(5):374-382.
[9] Raherty BD,Soria PJ,Tomasiewiez HG,et al.Getalphosphotylation of human tau protein by mierotubule-associated kinases:GSK-3βbeta and edk5are key participants[J].Neurosci,2009,62(2):468.
[10] Lee CW,Lau KF,Miller CC,et al.Glycogen synthase kinase-3beta- mediated tau phosphorylation in cultured cell lines[J].Neuroreport,2003,14(2):257.
[11] 丁绍红,施建华,尹晓敏,等.PKA,GSK-3B和cdk5对微管相关蛋白tau的位点特异性磷酸化[J].南通大学学报(医学版),2006,26(4):235.
[12] 张魁华,赖世隆,胡镜清,等.补肾益智方对AD动物模型大脑神经元Tau蛋白及其相关酶类的影响[J].中国中医基础医学杂志,2002,8(6):30.

