基于胸腔积液肿瘤标志物的PLS-DA和ANN-MPL模型对肺癌的诊断价值分析
田刚,周明术,宋敏,杭永伦,王开正,刘靳波
(泸州医学院附属医院检验科,泸州 646000)
恶性胸腔积液是由恶性肿瘤累及胸膜或胸膜本身肿瘤所致。目前,肺癌仍然是引起恶性胸腔积液的首要病因,临床上约15.0%的肺癌患者首发症状为胸腔积液[1]。由于多数患者胸腔积液症状明显而原发病灶不典型,故胸腔积液良恶性的鉴别较困难。联合检测胸腔积液肿瘤标志物可以提高诊断的灵敏度、特异性和阳性率,但如何利用已知数据建立诊断模型并对未知患者进行预测就显得更加困难。本文以肺癌患者为例,分别采用偏最小二乘判别分析(partial-least-squares discriminant analysis,PLSDA)线性模型和人工神经网络多层感知(artificial neural network-multiplayer perceptron,ANNMPL)非线性模型对4种胸腔积液肿瘤标志物建模,以期建立一种简便、实用的诊断模型,实现对肺癌和其它肺部非肿瘤疾病的快速鉴别诊断。
1 资料和方法
1.1 临床资料
选取2010年1月~2013年2月在泸州医学院附属医院病理或细胞学证实的53例肺癌患者作为肺癌组,肺癌组平均年龄(62.1±13.6)岁,男性46例,女性7例,其中鳞癌17例,腺癌30例,小细胞肺癌6例。包括局限期(limited-stage disease,LD)42 例,广泛期 (extensive-stage disease,ED)11例。52例其它肺部疾病作为对照,对照组平均年龄为(54.8±20.5)岁,包括肺结核27例,慢性支气管炎11例,肺炎4例,肺纤维化2例,糖尿病2例,心肌病5例,系统性红斑狼疮1例。
1.2 胸水癌胚抗原(CEA)、神经元特异性烯醇化酶(NSE),细胞角蛋白19片段(CYFRA21-1)和CA125的测定
所有患者入院治疗处理前在无菌条件下抽取胸腔积液,标本采集后2h内送至检验科,3 000g离心10min后取上清液测定。采用电化学发光免疫分析仪 (Elecsys 2010)及 配 套 CEA、NSE、CYFRA21-1和CA125定量测定试剂盒对样本进行测定。由于尚未建立健康人群胸水肿瘤标志物的参考范围,仍沿用血清肿瘤标志物的参考范围。CEA、NSE、CYFRA21-1和CA125的参考值范围分别为(0~3.4)ng/mL、(0~35.0)μg/mL、(0~3.3)ng/mL和(0~15.2)ng/mL。
1.3 统计学方法
胸水中 CEA、NSE、CYFRA21-1和 CA125的浓度均成偏态分布,以中位数和四分位数间距[M(P25~P75)]表示,完全随机化设计两独立样本的秩和检验与受试者工作特征曲线(receive operating characteristic curve,ROC),采用SPSS 17.0进行分析,采用SIMCAP 12.0软件进行PLS-DA分析,P<0.05为差异有统计学意义PLS-DA分析。
2 结果
2.1 肺癌和其它肺部良性疾病患者的秩和检验
肺癌和其它肺部疾病患者比较(见表1),肺癌组胸腔积液中 CEA、NSE、CYFRA21-1和 CA125水平均高于对照组(Z值分别为-8.78、-1.54、-4.91和-2.96),肺癌组胸腔积液中CEA、CYFRA21-1和CA125水平变化差异有统计学意义(P<0.01)。
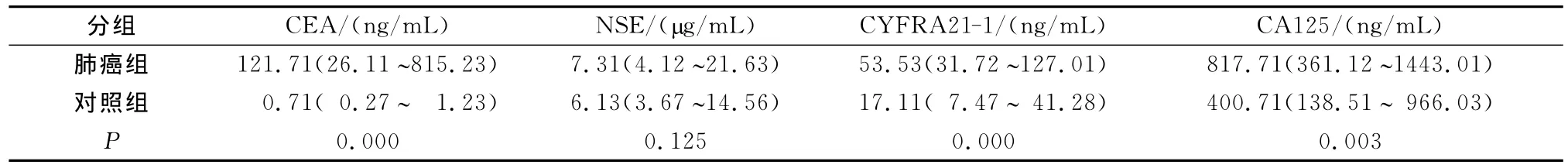
表1 肺癌组和对照组胸腔积液中CEA、NSE、CYFRA21-1和CA125测定值([M(P25~P75)])
2.2 肺癌和其它肺部疾病患者PLS-DA模型的建立
PLS-DA模型是一种数学优化技术,它通过最小化误差平方和找到一组数据的最佳匹配函数,建立线性诊断模型。利用PLS-DA模型对个体属性进行判断,可见对照组个体聚类较好,而肺癌患者个体差异大,分布较分散,两组个体不能完全鉴别(见图1)。在PLS-DA模型中,采用内代法随机选取10%的个体进行预测验证,该模型的灵敏度、特异性、准确性和预测能力分别为58.5%、98.1%、78.1%和84.6%。
2.3 肺癌和其它肺部疾病患者的ROC曲线分析
ROC曲线是一种全面、准确评价诊断试验的工具,ROC曲线下面积(area under the ROC curve,AUC)是反映诊断试验准确性的关键指标,通常认为其取值在0.70~0.90时具有中等的诊断准确性,而>0.90时诊断的准确性较高[2]。肺癌和其它肺部疾病患者的ROC曲线分析(见图2)。4种肿瘤标志物中CEA、CA125、CYFRA21-1和 NSE的ROC曲线下面积(AUC)分别为0.990、0.668、0.778和0.587。
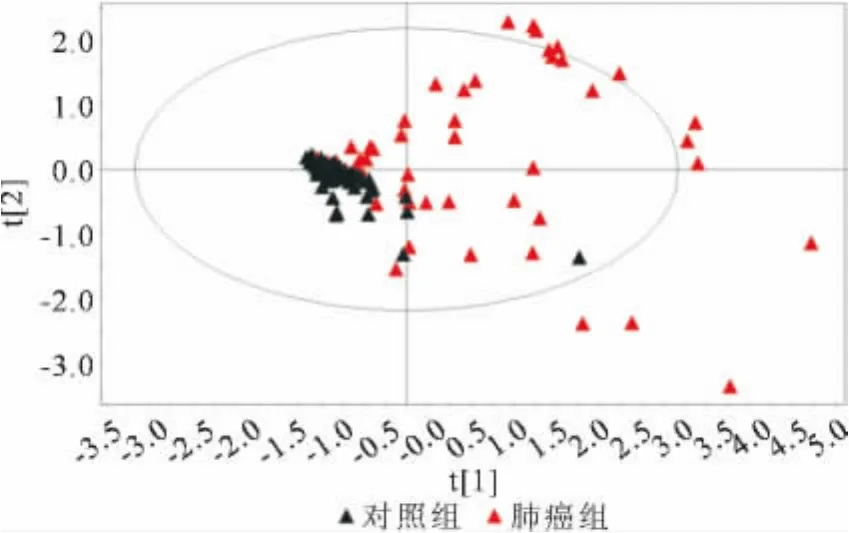
图1 肺癌组和对照组胸腔积液中检测CEA、NSE、CYFRA21-1和CA125诊断肺癌的PLS-DA得分散点图

图2 胸腔积 液 中 测定 CEA、NSE、CYFRA21-1 和CA125诊断肺癌的ROC曲线图
2.4 肺癌和其它肺部疾病患者ANN-MPL的ROC曲线的建立
ANN模型是一种模拟人脑运行的智能化处理系统,在数据挖掘中应用广泛。MPL模型是ANN中常见的方法,MPL通过多层感知器来拟合神经网络,适用于一个或多个因变量的数据建模。以胸腔积液中 CEA、NSE、CYFRA21-1和CA125数据建立ANN-MPL模型,数据经过标准化处理后,通过自动设置输入层、隐含层和输出层获得最佳诊断模型,计算出输入层、隐含层和输出层分别为4、1、2。该模型随机选取60%样本作为训练集,40%样本作为测试集,训练时间仅为0∶00∶00.047,交叉熵错误为6.03,百分比错误预测值为7.1%。其训练集模型的灵敏度、特异性和准确性分别为93.9%、100.0%和96.8%。在预测模型中其灵敏度和特异性分别为90.0%、95.5%,具有92.9%的预测正确率,该模型中联合测定胸水CEA、NSE、CYFRA21-1和CA125水平的AUC达到0.997(见图3)。
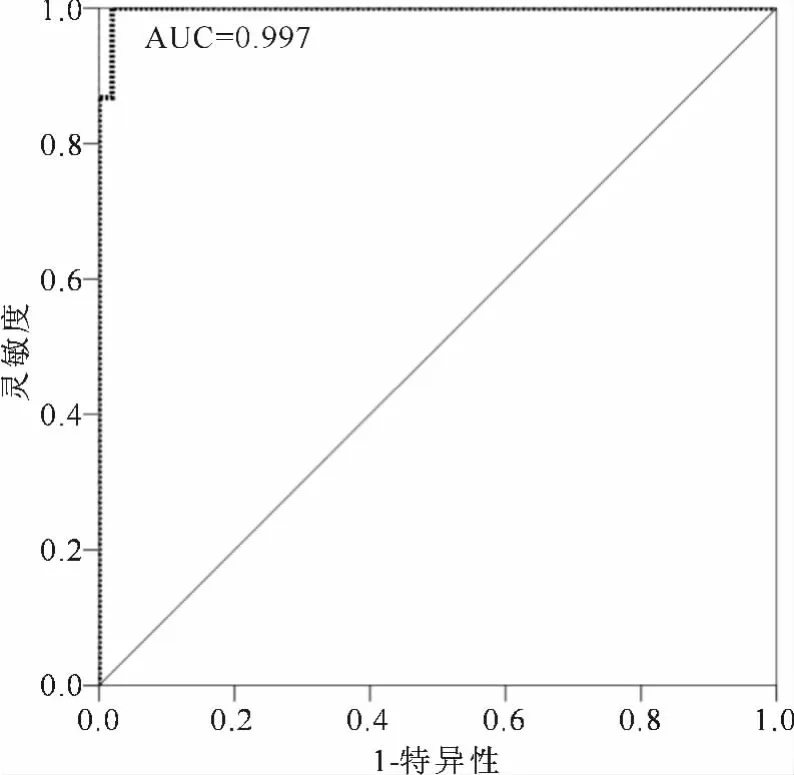
图3 胸腔积液中测定 CEA、NSE、CYFRA21-1和CA125诊断肺癌的ANN-MPL-ROC曲线图
3 讨论
肺癌是全世界最常见、导致死亡人数最多的恶性肿瘤之一[3],目前肺癌的5年生存率仅有15%,但早期诊断的肺癌患者其5年生存率可达到85%[4]。肿瘤标志物的检测可为肺癌的早期诊断和治疗提供重要依据。CEA可由肺腺癌细胞直接产生,因此,肺癌患者血清或胸腔积液中CEA水平可显著升高[5]。本研究中肺癌组约60%的患者为肺腺癌,故CEA在肺癌患者胸腔积液中水平显著升高(P<0.01)。CYFRA21-1是细胞角蛋白19的片段,当细胞死亡或恶变时其血清或胸水中CYFRA21-1可显著升高,而CA125是卵巢癌常见的肿瘤标志物。近年来研究[6]发现,CA125对肺癌的诊断和预后具有一定的价值,CA125作为一个独立指标,不受肿瘤大小、分期、组织类型和年龄分期的影响。本研究发现肺癌患者胸腔积液中CEA、CYFRA21-1和CA125水平明显高于其它肺部良性疾病,与周明术等[7]的报告一致。进一步的研究发现胸腔积液肿瘤标志物的ROC曲线中CEA和CYFRA21-1的AUC均>0.70,其中CEA的AUC达到0.99,提示胸腔积液中CEA对肺癌的鉴别诊断具有较高的准确性。NSE是小细胞性肺癌较理想的标志物,研究发现NSE对小细胞性肺癌的诊断具有较高的灵敏度(83.0%~92.0%)和特异性(92.9%)[8]。本 研 究 发 现 肺 癌 患 者 胸 腔 积 液 中NSE水平高于对照组,但差异不具有统计学意义,可能与肺癌组中非小细胞性肺癌患者数量较少有关。
研究表明,肺恶性肿瘤患者胸腔积液中可检出比血清更高浓度的肿瘤分子标志物[9]。由于各种肿瘤分子标志物在良恶性胸腔积液时其水平各不相同,故多采用肿瘤标志物联合检测以提高肺癌诊断的阳性率[10]。尽管如此,但联合检测多种肿瘤标志物时单一指标绝对的升高和降低对结果的判定影响很大,同时由于胸水肿瘤标志物的参考范围尚未确定,充分挖掘数据信息建立诊断模型并对未知患者进行合理预测就显得尤为重要。线性和非线性建模是目前常用的两类数据处理模式,可对数据进行归一化处理[(测定值-均值)/标准差]以消除量纲的影响。PLS-DA模型是常见的线性判别模式,本研究发现,尽管该模型具有很高的特异性(98.1%)、较高的准确性(78.1%)和预测能力(84.6%),但灵敏度较低(58.5%),提示本例数据不太适合PLS-DA线性建模分析,4种肿瘤标志物可能与肺癌的最终诊断没有明显的线性相关性。相反,采用ANNMPL非线性模型其灵敏度、特异性和预测准确性均在90.0%以上,ANN-MPL非线性数据拟合模型更适合本例数据,利用ANN-MPL模型建模能够挖掘出更多隐含信息。联合测定胸水中CEA、NSE、CYFRA21-1和CA125的ANN-MPL模型的AUC达到0.997,提示ANN-MPL模型是一种很可靠的数据处理模式,有助于肺癌患者胸水的良恶性鉴别。
由于海量数据不断产生,只有合理的数据挖掘和有效利用才能为临床医生提供更多有益信息,本文以肺癌患者4种胸水肿瘤标志物建模对比分析体现了不同数据处理模型的重要性。由于健康人无法获取胸腔积液也尚未建立其参考范围,采用PLS-DA线性和ANN-MPL非线性模型以综合指标建立诊断和预测模型,从另一个角度揭示联合检测胸腔积液肿瘤标志物对肺癌的诊断价值。当然,最佳数据处理模式的获取和强大专家诊断系统的建立需要海量的数据加以验证。只有确保数据的准确性和大量临床实践对模型的后期验证和评估,才能为肺癌和其它肿瘤的早期诊断、分型,预后评估以及个体化靶向治疗提供依据,最终更好地服务于临床,服务于患者。
[1]戈伟,伍纲.实用肺部肿瘤学[M].北京:人民军医出版社,2003:447-448.
[2]李哓松.医学统计学[M].2版.北京:高等教育出版社,2008:236-237.
[3]Spira A,Ettinger DS.Multidisciplinary management of lung cancer[J].New England Journal of Medicine,2004,350(4):379-392.
[4]Kasprzak A,Zabel M,Biczysko W.Selected markers(chromogranin A,neuron-specific enolase,synaptophysin,protein gene product 9.5)in diagnosis and prognosis of neuroendocrine pulmonary tumours[J].Pol J Pathol,2007,58(1):23-33.
[5]杭志强,郑明峰,黄捷辉.肺癌患者血清中癌胚抗原和细胞角蛋白片段19的检测与临床价值[J].中华肿瘤杂志,2011,33(11):847-849.
[6]陈锋,曾雪峰,包勇,等.联合检测血清肿瘤标志物对早期肺癌的临床诊断价值[J].全科医疗,2010,24(11):90-91.
[7]周明术,邓述凯.肿瘤分子标志联合检测对胸腔积液鉴别诊断价值分析[J].中华肿瘤防治杂志,2013,20(10):772-774.
[8]叶应妩,王毓三,申子瑜.全国临床检验操作规程[M].3版.南京:东南大学出版社,2006:701-702.
[9]朱婉凌,刘艳红,于洪涛.联合检测CEA、CA125、CA153对肺癌并胸腔积液的诊断意义[J].中国社区医师:医学专业,2011,13(11):207.
[10]景永宏,刘冬宇.肿瘤标志物联合检测对肺癌诊断的应用价值研究[J].中国现代医生,2012,50(20):68-69.

