LRP16基因在子宫内膜癌组织中的表达及其对细胞增殖的作用*
张宇骄,刘 玲,汪春燕,詹 平,伍宗惠,何 雯,王定玉
(泸州医学院附属医院妇产科,四川泸州646000)
子宫内膜癌为女性生殖系统常见三大恶性肿瘤之一,占女性生殖道恶性肿瘤的20%~30%。子宫内膜癌早期诊断和治疗预后较好,但一旦转移或复发,5年生存率降低70%。不典型增生使癌变的风险较高,但单纯性增生和复杂性增生发生癌变的风险低,子宫内膜癌可能存在误诊或治疗过度的倾向[1],因此寻找新的预测风险的肿瘤标记物是诊治研究的重点。LRP16基因在雌激素相关肿瘤中表达升高,其异常表达与肿瘤的发生和发展有着密切的联系。本研究应用WST-1法、逆转录聚合酶链反应(RT-PCR)技术等来探讨子宫内膜癌组织和子宫内膜癌细胞株HEC-1-B细胞中LRP16表达的变化及其在细胞增殖中的作用。
1 材料与方法
1.1 材料 收集2008年10月至2010年3月在本科室进行手术治疗的子宫内膜癌患者的组织标本26例。26例内膜癌组织病理诊断为高分化腺癌10例,中分化腺癌10例,低分化腺癌6例,其中雌激素受体(ER)阳性患者19例,ER阴性患者
7例;根据2009FIGO子宫内膜癌手术病理分期Ⅰ期19例,Ⅱ期3例,Ⅲ期3例,Ⅳ期1例。另取同期良性疾病(子宫肌瘤或子宫腺肌瘤)手术患者的正常子宫内膜组织标本10例作为对照,患者平均年龄为51岁。所有患者术前均未接受放、化疗。
1.2 试剂 实验所用LRP16真核表达载体EX-Y2069-M29、空质粒EX-NEG-M29由本实验组构建。人子宫内膜癌细胞株HEC-1-B购自上海中科院细胞库。RNA提取试剂盒及RTPCR试剂盒为Invitrogen公司产品,PCR引物由上海生物工程公司合成,WST-1细胞增殖及细胞毒性检测试剂盒为碧云天公司产品。
1.3 方法
1.3.1 LRP16mRNA表达的检测 采用Invitrogen公司的Trizol反应试剂盒提取正常子宫内膜组织及子宫内膜癌组织总的RNA,逆转录合成cDNA,以LRP16和β-action(作为内参照)引物进行PCR反应,最后进行PCR产物的定性检测。
1.3.2 细胞培养、基因转染和转染克隆的筛选 HEC-1-B细胞用含10% 小牛血清的RPMI-1640培养基在5%CO2培养箱中培养。实验分为空白对照组、EX-Y2069-M29组、EX-NEG-M29组。第1组中加入无质粒的脂质体稀释液,第2组中加入70μL EX-Y2069-M29-Opti-Lipofecter复合物,第3组中加入70μL EX-NEG-M29-Opti-Lipofecter复合物,轻轻混匀,置37℃5%CO2的孵箱培养,5h后换成无双抗新鲜培养基。转染48h后,3组细胞同时加入浓度为400μg/mL的G418选择培养液进行筛选,每3天换液1次,筛选抗G418克隆,挑选阳性克隆并扩大培养。快速脂质体转染:将HEC-1-B细胞接种于24孔板,在转染48h后用RT-PCR法检测LRP16基因的表达。
1.3.3 转染克隆的鉴定 收集各实验组细胞,提取细胞总RNA,采 用 RT-PCR 法 检 测 HEC-1-B 细 胞 LRP16 基 因 的表达。
1.3.4 细胞生长曲线的绘制 收获对数生长期的稳定转染细胞及未转染HEC-1-B细胞,每孔2×104个细胞接种于6孔板中,次日开始每天计数各组的细胞数量,连续计数7d,绘制生长曲线。
1.3.5 WST-1检测细胞增殖 收集对数生长期的未转染和转染HEC-1-B细胞,每孔6×104个细胞接种于96孔培养板,待细胞融合率达到70%~80%时,用脂质体转染,实验设3组即:重组质粒转染组、空载体转染组和未转染组 HEC-1-B细胞,每组5个复孔。向每孔中各加入10μL 5mg/mL WST-1液,37℃5%CO2饱和湿度下孵育5h,分别在第24、48、72小时用酶标仪测定450nm波长时每孔的光密度(OD)值,实验重复2次,记录实验结果。
2 结 果
2.1 LRP16mRNA在子宫内膜癌、正常子宫内膜组织中的表达 26例子宫内膜癌组织中有21例LRP16mRNA阳性(83.33%),LRP16mRNA的平均表达水平为0.82±0.21;10例子宫内膜组织中有3例LRP16mRNA阳性(30.00%),LRP16 mRNA的平均表达水平为0.47±0.18;LRP16mRNA的阳性表达率及表达水平分别比较,差异有统计学意义(P<0.05)。
2.2 基因转染及转染克隆的筛选与鉴定 HEC-1-B细胞在G418筛选培养基选择培养1个月后,未转染的HEC-1-B细胞全部死亡。维持选择培养2周时,实验组和空载体组分别获得抗G418克隆,大量扩增抗性细胞,并传代培养,分别命名为EX-Y2069-M29(转染LRP16cDNA)和EX-NEG-M29(转染空载体)。RT-PCR法检测显示,未转染组及EX-NEG-M29组和EX-Y2069-M29组的 HEC-1-B细胞均有LRP16基因表达,未转染组和 EX-NEG-M29组的表达量分别为0.123 1±0.036 6、0.148 6±0.028 7,二者差异无统计学意义(P>0.05);EX-Y2069-M29组表达量为0.506 0±0.019 8,未转染组、EX-NEG-M29组、EX-Y2069-M29组三者差异有统计学意义(P<0.05),EX-Y2069-M29组表达明显增高,见图1。
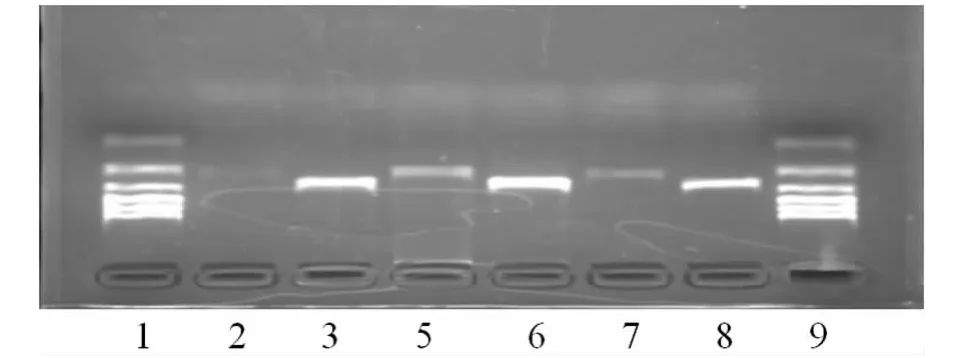
图1 RT-PCR产物凝胶电泳
2.3 LRP16对HEC-1-B细胞增殖的影响 转染组细胞增殖速度明显低于非转染组,转染组细胞的生长速率低于对照组未转染HEC-1-B细胞;自转染的24h起,转染细胞的生长明显低于未转染组细胞,增殖明显减慢(图2)。WST-1法检测结果显示LRP16转染组较阴性对照组、空载体转染组任意一组间HEC-1-B细胞OD值低(P<0.05);阴性对照组和空载体转染组OD值差异无统计学意义(P>0.05),见表1。
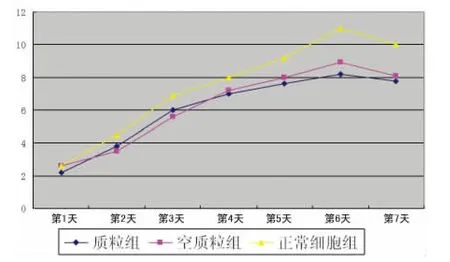
图2 HEC-1-B细胞的生长曲线
表1 各组细胞质粒转染后的OD(A450)值(±s)
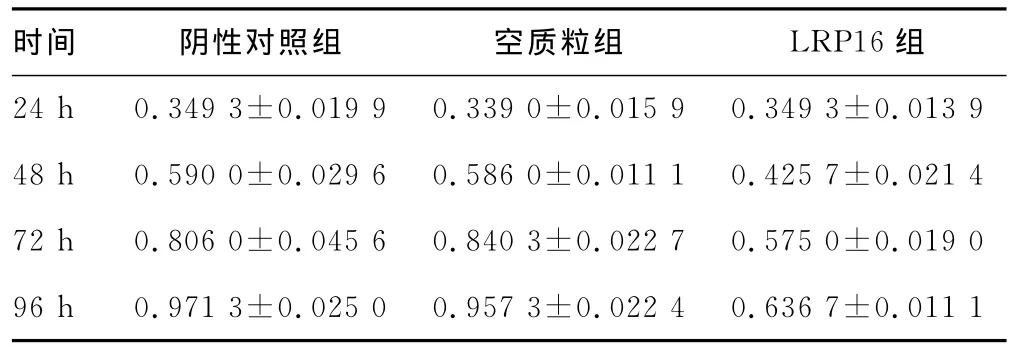
表1 各组细胞质粒转染后的OD(A450)值(±s)
时间 阴性对照组 空质粒组 LRP16组24h0.349 3±0.019 9 0.339 0±0.015 9 0.349 3±0.013 9 48h0.590 0±0.029 6 0.586 0±0.011 1 0.425 7±0.021 4 72h0.806 0±0.045 6 0.840 3±0.022 7 0.575 0±0.019 0 96h0.971 3±0.025 0 0.957 3±0.022 4 0.636 7±0.011 1
3 讨 论
在既往对细胞系的研究中发现人体各种组织细胞内均有不同程度的LRP16表达,该基因在人类多种肿瘤细胞如乳腺癌等中的表达量明显高于其正常对应组织,尤其是在雌激素依赖性的肿瘤中表达量增高更明显,而在已公认的与雌激素无关的肿瘤中和雌激素受体阴性的肿瘤中,LRP16基因的表达低,LRP16的异常表达与肿瘤的发生、发展有着密切的联系[2-3]。研究表明,LRP16是雌激素反应性识别靶基因,雌激素诱导LRP16的表达上调,具体调控途径由ERa介导[4]。在细胞系的研究中发现,ERa阳性乳腺癌细胞和子宫内膜癌细胞中LRP16的表达水平依赖于雌激素活性;过表达的LRP16通过增强雌激素激活ERa功能从而促进人乳腺癌 MCF-7细胞的增殖,抑制LRP16基因的表达通过上调ERa介导的E-cadherin表达从而抑制雌激素反应性乳腺癌和子宫内膜癌细胞的侵袭能力[5-6]。Han等[5]观察到乳腺癌 MCF-7细胞 LRP16表达下调后,雌激素并没有促进细胞的生长,下调LRP16破坏了雌激素刺激细胞生长的作用。此外,LRP16mRNA的表达水平与乳腺癌的病理分级呈正相关[7]。由此表明,LRP16在致癌过程中起着重要的作用,通过激活ERa调控激素依赖性肿瘤的进展。大量研究表明,ERa与雌激素依赖性肿瘤的治疗及预后判断密切相关,LRP16与ERa之间存在表达调控与反馈激活的作用,所以检测肿瘤中LRP16的表达水平具备了反映ERa信号活性的良好特征,鉴于LRP16蛋白的功能特征,检测雌激素相关肿瘤中LRP16的表达应优于检测肿瘤中ERa本身的含量及其目前临床上使用的任何一个靶蛋白的水平。作为激素相关的恶性肿瘤的诊断及预后判断指标,LRP16可能成为反映该类肿瘤预后标志物,进一步探索LRP16和ER相互作用的分子生物学机制,以及ER调控下游基因的机制和通路,为进一步探索该类肿瘤形成和进展机制创造了条件。
该研究发现,子宫内膜癌组织中LRP16mRNA的阳性表达率及表达水平均高于正常子宫内膜组织,由此推测LRP16与子宫内膜癌的发生、发展有密切联系,参与子宫内膜癌的发生、发展过程,同既往的研究结果相似,其可能成为子宫内膜癌诊断和预后判断的肿瘤标记物。该研究发现,LRP16转染组HEC-1-B细胞在体外能继续增殖,说明利用脂质体转染LRP16基因到子宫内膜癌细胞HEC-1-B是安全可行的,并可使LRP16基因获得稳定表达,为下一步研究LRP16基因的转录调节和对子宫内膜癌细胞增殖情况的影响,探讨LRP16基因的分子生物学机制及对子宫内膜癌发生、发展的影响打下基础。但HEC-1-B细胞增殖能力明显下降,由此可见,LRP16基因表达上调并没有促进子宫内膜癌HEC-1-B细胞的增殖,其可能通过增加HEC-1-B细胞的体外侵袭、生长能力参与子宫内膜癌的发生、发展[8],其具体机制有待进一步研究。LRP16基因参与致癌过程,参与子宫内膜癌的发生、发展过程,可望通过选择性阻遏LRP16基因表达,抑制正常子宫内膜细胞的恶性转变,治愈子宫内膜恶性肿瘤,从而为分子水平治愈激素相关性疾病开辟广阔的治疗前景。
[1] Sherman ME.Theories of endometrial carcinogenesis:a multidisciplinary approach[J].Mod Pathol,2000,13(3):295-308.
[2] 韩为东,楼方定,于力,等.LRP16基因的SAGE谱分析及其在正常血细胞、白血病细胞中的表达状况[J].军医进修学院学报,2002,23(3):161-163.
[3] 韩为东,母义明,卢学春,等.雌激素通过其受体上调LRP16mRNA表达并促进 MCF-7细胞增殖[J].中华内分泌代谢杂志,2004,20(2):165-168.
[4] Han WD,Zhao YL,Zang YL,et al.Up-regulation of LRP16mRNA by 17beta-estradiol through activation of estrogen receptor alpha(ERalpha),but not ERbeta,and promotion of human breast cancer MCF-7cell proliferation:apreliminary report[J].Endocr Related Cancer,2003,10(2):217-224.
[5] Han WD,Zhao YL,Meng YG,et al.Estrogenically regulated ERαtarget gene LRP16interacts with ERαand enhances the receptor′s transcriptional activity[J].Endocr Related Cancer,2007,14(3):741-753.
[6] Meng YG,Han WD,Zhao YL,et al.Induction of LRP16 gene by estrogen promotes the invasive growth of Ishikawa human endometrial cancer cells through down-regulation of E-cadherin[J].Cell Research,2007,17(5):869-880.
[7] Liao DX,Han WD,Zhao YL,et al.The expression and dinical significance of the LRP16gene in human breast cancer[J].Chin J Cancer,2006,25(1):44-49.
[8] 孟元光,韩为东,黄柯,等.雌激素调控子宫内膜癌IShikawa细胞中LRP16基因表达及其意义[J].第四军医大学学报,2006,27(11):980-983.

