机械和感染双重损伤法建立新西兰大白兔宫腔粘连模型*
刘 芳,何援利
(南方医科大学珠江医院妇产科,广州510282)
宫腔粘连(intrauterine adhesions,IUA)是宫腔操作的严重并发症,可以引起不孕、月经过少、闭经或反复流产[1]。近年IUA的发病率和检出率呈上升趋势,已成为女性继发不孕的第二大病因[2]。目前,临床针对IUA的治疗尽管能恢复宫腔的形态,但对于子宫生理功能的恢复尚属于临床治疗的难题,导致IUA的治愈率和妊娠率无明显改善,而且中、重度IUA治疗后复发率较高[3],因此,IUA的诊断和治疗日益受到临床的重视。目前研究认为,IUA的病因主要有创伤[4]、感染[5]、子宫内膜修复障碍和低雌激素状态[1]。为此,本研究拟建立兔IUA动物模型,探讨其发病机制和治疗方案,报道如下。
1 材料与方法
1.1 实验动物 选择普通级成年雌性新西兰大白兔60只,10~12周龄,体质量2.500~3.500kg,常规单笼饲养适应环境1周后,随机分为4组:对照组15只,机械损伤组15只,感染损伤组15只,双重损伤组15只。
1.2 脂多糖棉线制备 细菌脂多糖(LPS,购自SIGMA公司,来源于Escherichia coli 055:B5)溶于生理盐水配成浓度为6mg/L溶液,4℃冰箱保存备用。造模前1d准备20cm长的10号医用无菌手术线,在4℃脂多糖生理盐水溶液中浸泡24h备用。
1.3 造模方法 按5mL/kg耳缘静脉注射20%乌拉坦麻醉。机械损伤组随机取一侧子宫,于子宫中下1/3处做0.5cm纵切口,用直径4mm子宫内膜刮勺刮取中上段子宫内膜,当感觉子宫四壁粗糙时,停止刮宫,缝合子宫切口,生理盐水冲洗腹腔。感染损伤组随机取一侧子宫,于子宫中下1/3处做0.5 cm纵切口,宫腔留置脂多糖棉线,棉线残端留置于腹部,留长约3cm尾丝,剪去多余棉线,2d后轻拉尾丝,取出宫腔内棉线。双重损伤组机械损伤后,将脂多糖棉线置入损伤段子宫,2 d后取出子宫腔内棉线(图1B)。对照组只开腹,不损伤子宫。分别于损伤后2、14、28d分批处死3只新西兰大白兔,损伤后7d处死6只,收集子宫组织(图1)。
1.4 子宫内膜腺体数量纤维化检测 兔子宫组织样本的石蜡切片分别行HE和马松三色染色(massons trichrom stain,Masson染色)。每张HE染色切片选取4个高倍镜视野,计数每个视野下腺体数量,取其平均值。纤维化面积比率计算方法:每张Masson切片选取4个视野,纤维化面积比率为每个视野子宫内膜间质纤维化的总面积除以子宫内膜间质和腺体面积之和,取平均值,以图像分析系统自动计算完成。
1.5 统计学处理 应用SPSS13.0统计软件进行数据分析,计量资料以±s表示,组间比较采用单向方差(One way ANOVA)和SNK法分析,以P<0.05为差异有统计学意义。
2 结 果
子宫内膜间质微血管丰富。Masson染色镜下观察见黏膜、黏膜下层、血管和肌肉呈暗红色;子宫内膜间质胶原纤维呈蓝色,梭状,排列较整齐(图2)。子宫内膜机械损伤后2d,70%~80%宫腔表面有上皮细胞再生,但无腺体再生。间质出血、水肿、白细胞浸润,出现少量凝固性坏死,间质裸露区有纤维素样渗出;损伤后7d,宫腔表面几乎全部覆盖上皮细胞,再生上皮层下出现一些腺体,上皮表面偶可见腺体开口。间质层纤维组织增多,胶原聚集,少量新生毛细血管(图2B);损伤后14d宫腔表面上皮和腺体完全再生。间质少量白细胞和巨噬细胞浸润,部分间质纤维化,胶原聚集。新生毛细血管增多;损伤后28d子宫内膜形态学基本恢复正常,间质无充血和淋巴细胞浸润,少数间质区可见纤维化改变。
感染损伤的子宫移去脂多糖棉线2d后宫腔表面均有子宫内膜细胞覆盖,上皮下无腺体。间质有炎性反应;损伤后7 d,宫腔表面覆盖柱状上皮细胞,上皮下多量腺体,表面可见腺体开口。间质仍可见炎性改变(图2C);损伤后14d宫腔表面上皮和腺体完全再生。间质白细胞浸润。毛细血管无扩张、充血;损伤后28d子宫内膜形态学恢复正常,间质无充血和淋巴细胞浸润。
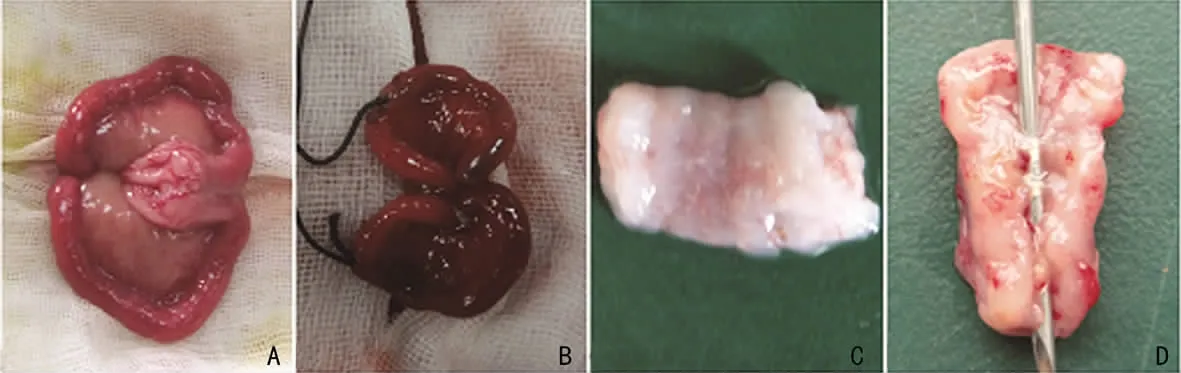
图1 兔子宫造模前、后照片
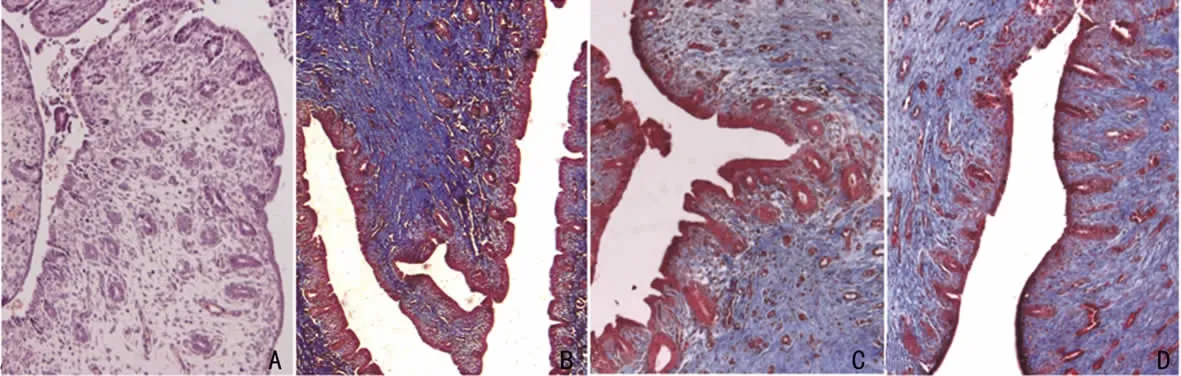
图2 正常及损伤后7d兔子宫内膜

表1 损伤后7d兔子宫内膜纤维化面积比率与腺体数量比较
子宫内膜双重损伤后2d,宫腔偶有扁平上皮细胞再生,宫腔大量纤维素渗出以及坏死组织碎片。间质出血,水肿,淋巴细胞浸润,部分区域纤维化,胶原纤维增加。一些毛细血管管腔闭锁;损伤后7d,宫腔部分闭锁,纵行剖开,大体可见一些较牢固纤维性粘连带。镜下可见纤维性粘连带增厚,70%~80%未粘连区域覆盖扁平上皮细胞,上皮层下可见极少量腺体。80%~90%间质区纤维化增生,胶原纤维聚集,间质毛细血管稀少;损伤后14d宫腔改变和损伤后7d类似,但宫腔未粘连区域基本由无功能的扁平上皮细胞覆盖,上皮层下腺体稀疏。损伤后28d子宫内膜形态学未恢复,宫腔瘢痕修复。损伤后7 d兔子宫内膜纤维化面积比率与腺体数量见表1。
3 讨 论
创伤和感染是IUA发生的两个主要高危因素[6]。本研究根据IUA发生的主要高危因素设计了3种方法建立IUA动物模型。其中机械损伤方法可以完全刮除子宫内膜表面上皮以及部分间质,引起新西兰大白兔的子宫内膜全层损伤,但在损伤后短时间内子宫内膜上皮细胞即开始再生,子宫内膜间质的修复过程较慢,损伤后28d少数间质区仍有纤维化改变,但子宫内膜上皮的形态学基本恢复。这说明仅用机械损伤的方法对子宫内膜上皮再生过程影响较小。
感染可促使IUA进一步发展已基本得到学者的共识[7]。宫腔操作引起的继发感染、急慢性子宫内膜炎、产褥感染等均可导致子宫内膜的炎症反应,抑制子宫内膜修复,甚至破坏正常子宫内膜,促进子宫内膜纤维化增生,导致IUA形成[8]。本研究中用感染损伤的方法虽然也能引起子宫内膜的部分脱落和间质的炎症反应,但其引起的损伤是完全可逆的,在损伤后7d子宫内膜组织完全再生。提示单纯的感染对子宫内膜腺上皮损伤后修复的影响较小,虽然引起子宫内膜间质纤维化暂时性增加,但可能由于子宫腔表面有腺上皮覆盖,几乎不形成纤维粘连。
采用机械和感染双重方法损伤子宫内膜后,在损伤后2d宫腔内没有再生的上皮细胞覆盖,致使子宫内膜间质的纤维化渗出阻塞了宫腔,损伤后7d形成粘连带,损伤发生了不可逆的改变,子宫内膜瘢痕修复。子宫内膜损伤后完全再生可能取决于2个因素:(1)子宫内膜表面上皮细胞的迅速再生,覆盖子宫内膜创面;(2)较轻的炎症反应[9]。子宫内膜损伤后,子宫内膜表面上皮再生延迟可能是宫腔粘连形成的关键[10],由于缺乏足够的再生上皮细胞覆盖宫腔表面,间质裸露,间质纤维活性增加,加之炎症引起的纤维性渗出,子宫内膜瘢痕修复,引起宫腔粘连。
随着对IUA的研究深入,研究者意识到IUA的形成是多种损伤因素共同作用的结果[11]。由于子宫内膜再生能力强,单一的方法损伤后,子宫内膜在短时间内完全再生,难以构建IUA模型,因此,采用两种以上的损伤方法联合可能更易于建立IUA动物模型。Chen等[12]根据创伤和低雌激素状态的病因采用刮宫和切除卵巢降低雌激素水平两种方法联合建立了兔IUA模型,有助于研究和妊娠子宫宫腔操作后IUA发生的机制。而Li等[13]用刮宫后放置铜丝的方法建立了兔子宫内膜损伤的模型,但宫腔没有粘连带形成,可能是因为铜丝虽然抑制了子宫内膜上皮细胞再生,同时也抑制了宫腔内纤维化粘连带的形成,尽管模型没有宫腔粘连形成,但子宫内膜容受性降低,对于研究子宫内膜损伤引起的胚胎着床失败有重要的作用。
本研究显示,IUA的主要病因是创伤和感染,采用机械和感染双重损伤方法建立新西兰大白兔IUA动物模型,对子宫内膜的机械损伤能基本清除子宫内膜层;同时在术后立即置入脂多糖棉线,2d后取出脂多糖棉线,一方面在子宫内膜再生过程开始之前即抑制子宫内膜再生,另一方面脂多糖加重了炎症反应[14],有助于瘢痕修复,而且及时取出棉线也不影响宫腔纤维化粘连带的形成。综合以上因素,双重损伤法能建立稳定的IUA模型。
该模型的建立可以从基因、蛋白以及干细胞等多个角度深入研究IUA的发病机制,而且可以作为一个平台从细胞因子、生物材料以及干细胞移植等方面探求新的治疗方法并检测其有效性及安全性。
[1] Yu D,Wong YM,Cheong Y,et al.Asherman syndrome--one century later[J].Fertil Steril,2008,89(4):759-779.
[2] 李敏,王蔼明.宫腔粘连的研究进展[J].中国妇幼保健,2011,26(8):1267-1270.
[3] Roy KK,Baruah J,Sharma JB,et al.Reproductive outcome following hysteroscopic adhesiolysis in patients with infertility due to Asherman′s syndrome[J].Arch Gynecol Obstet,2010,281(2):355-361.
[4] Taylor PJ,Cumming DC,Hill PJ.Significance of intrauterine adhesions detected hysteroscopically in eumenorrheic infertile women and role of antecedent curettage in their formation[J].Am J Obstet Gynecol,1981,139(3):239-242.
[5] Gupta N,Sharma JB,Mittal S,et al.Genital tuberculosis in Indian infertility patients[J].Int J Gynaecol Obstet,2007,97(2):135-138.
[6] Panayotidis C,Weyers S,Bosteels J,et al.Intrauterine adhesions(IUA):has there been progress in understanding and treatment over the last 20years[J].Gynecol Surg,2009,6(3):197-211.
[7] Czernobilsky B.Endometritis and infertility[J].Fertil Steril,1978,30(2):119-130.
[8]Schenker JG.Etiology of and therapeutic approach to synechia uteri[J].Eur J Obstet Gynecol Reprod Biol,1996,65(1):109-113.
[9] Liechty KW,Kim HB,Adzick NS,et al.Fetal wound repair results in scar formation in interleukin-10-deficient mice in a syngeneic murine model of scarless fetal wound repair[J].J Pediatr Surg,2000,35(6):866-873.
[10]Bigsby RM.Control of growth and differentiation of the endometrium the role of tissu e interactions[J].Ann N Y Acad Sci,2002,955:110-117.
[11]Socolov R,Anton E,Butureanu S,et al.The endoscopic management of uterine synechiae.A clinical study of 78 cases[J].Chirurgia(Bucur),2010,105(4):515-518.
[12]Chen F,Duan H,Zhang Y,et al.Effect and mechanism of formation of intrauterine adhesion at different dose of estrogen[J].Zhonghua Fuchanke ZaZhi,2010,45(12):917-920.
[13]Li L,Shi J,Zhang QF,et al.Effect of curettage and copper wire on rabbit endometrium:a novel rabbit model of endometrial mechanical injury[J].Chin Med J(Engl),2011,124(11):1708-1713.
[14]Bannerman DD,Goldblum SE.Direct effects of endotoxin on the endothelium:barrier function and injury[J].Lab Invest,1999,79(10):1181-1199.

