28例下肢软组织肉瘤患者调强放射治疗的剂量学优势及近期疗效观察
白 雪
(桂林医学院附属医院放疗科 541001)
软组织肉瘤(soft tissue sarcoma,STS)是一种起源于间叶组织的少见恶性肿瘤,常见于四肢肢体。目前,其主要治疗措施为保肢手术联合放射治疗,放射治疗为重要的辅助治疗及新辅 助治 疗 措 施[1-4];调 强 放 射 治 疗 (intensity modulated radiation therapy,IMRT)能增加肿瘤剂量并减少周围正常组织的受照剂量以解决肢体STS放疗的剂量学问题。本研究应用剂量体积直方图(dose vomule histogram,DVH)、靶区覆盖率、适形指数(conformity index,CI)及股骨受量等指标来综合评价IMRT治疗效果,为临床肢体STS的精确放疗提供理论依据。
1 资料与方法
1.1 一般资料 选择2009年5月至2011年1月在本院治疗的大腿STS患者28例,其中,男性22例,女性6例,年龄20~75岁,中位年龄48岁。恶性纤维组织细胞瘤10例,脂肪肉瘤5例,神经纤维肉瘤4例,恶性神经鞘瘤4例,滑膜肉瘤3例,横纹肌肉瘤2例。按2002年美国癌症联合委员会(American joint committee on cancer,AJCC)术后病理分期,Ⅱ期9例,Ⅲ期19例。全部患者均接受保肢手术,未发现远处转移且无放疗禁忌证,并排除复发及侵犯骨组织患者。治疗结束后的随访前3个月内每个月复查1次,以后每3个月复查1次,28例患者全部接受术后IMRT治疗,其中1例失访,随访率96.4%,随访期15~35个月,中位时间23.6个月。
1.2 定位方法 患者采用真空气垫及网状体模固定体位,根据照射范围选择参考等中心层面,采用三维激光灯标记——前和两侧等中心体表标记(扫描时用铅点标记)。CT模拟定位机扫描范围为从骨盆入口至胫骨上缘,层厚3cm,层距3cm。扫描结果通过局域网传至三维治疗计划系统。
1.3 靶区及危及器官的勾画 根据术前影像学检查以及手术银夹来确定临床靶区(clinical tumor volume,CTV);计划靶区(planning target volume,PTV)由手术瘤床(CTVtb)均匀外放,PTV1设定为手术瘤床均匀外放2cm;PTV2设定为手术瘤床横向外扩3cm,纵向外扩5~7cm;PTV3包括PTV1、PTV2以及整个肌腔隙;PTV除外骨结构,包至皮下0.5cm,整个股骨作为危及器官。
1.4 治疗计划 为每位患者设计IMRT和常规放射治疗(conventional radiotherapy,CRT)2套治疗计划。IMRT 计划给予7~8野照射,采用同步推量技术,一段计划完成全部靶区照射,根据计划系统算出结果进行优化,治疗计划最大剂量应在靶体积内,全部病例采用多叶光栅静态调强方式进行。CRT计划予2野对穿照射,按PTV形状调整多叶光栅予连续3段缩野照射,每段计划均予不同剂量处方,PTV3予50Gy/25F、然后PTV2缩野照射10Gy/5F、最后PTV1缩野推量照射10 Gy/5F,采用2.0Gy/次,5次/周;两种技术采用射线能量均为6MV X射线,均为共面照射;两种治疗计划采用LQ模型重新计算生物学等效剂量来进行比对;全部患者治疗均使用西门子primus直线加速器,IMRT计划由ADAC Pinncale3version 7.4逆向调强计划系统完成;两种治疗计划均给予合适的照射角度来避免对侧腿部接受照射。
表1 患者两种放疗技术股骨受量比较(±s,n=28)
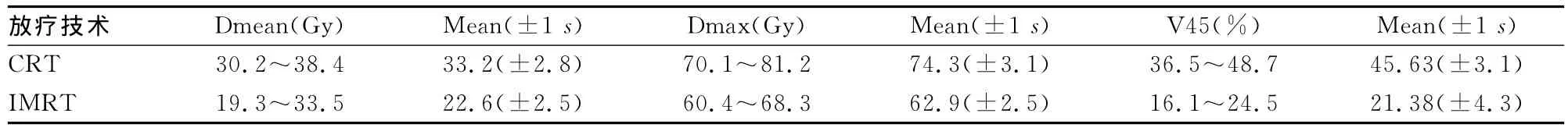
表1 患者两种放疗技术股骨受量比较(±s,n=28)
放疗技术 Dmean(Gy) Mean(±1 s) Dmax(Gy) Mean(±1 s) V45(%) Mean(±1 s)CRT 30.2~38.4 33.2(±2.8) 70.1~81.2 74.3(±3.1) 36.5~48.7 45.63(±3.1)IMRT 19.3~33.5 22.6(±2.5) 60.4~68.3 62.9(±2.5) 16.1~24.5 21.38(±4.3)
1.5 治疗计划评估 每例患者均分别于横断、矢状面及冠状面上比较两种技术的靶区剂量分布;采用DVH图来评价PTV及危及器官;评价适形指数,其中适形指数采用公式CI=(VPTV95×VPTV95)/(Vbody95×VPTV95)计算[5];分别评价 PTV 的最小剂量(Minimum dose,Dmin)及最大剂量(maximal dose,Dmax);研究股骨平均剂量(mean dose,Dmean)及 Dmax,以及接受45Gy处方剂量体积百分比(V45)大小。
1.6 质量保证 放疗前再次用CT进行等中心的验证与校正,确认摆位误差小于3cm。采用多通道剂量仪进行剂量验证,实测值与计划值相差小于3%;使用柯达慢感光胶片分别测通量分布单野,实测通量分布与计划通量分布相一致。
1.7 疗效评价 放疗后每个月(3个月以内)及每3个月(2年以内)行患侧肢体MRI或CT检查,来评价肿瘤是否复发。骨组织不良反应按美国肿瘤放射治疗协作组(radiation therapy oncology group,RTOG)评价标准:0级为正常;1级为无症状,无生长停滞;骨密度降低;2级为中度疼痛或触痛;生长停滞;不规则骨硬化;3级为重度疼痛或触痛;骨生长完全停滞;致密骨硬化;4级为坏死及自发性骨折。皮肤不良反应按RTOG评价标准:0级为正常;1级为轻度萎缩,色素沉着,少许脱发;2级为片状萎缩,中度毛细血管扩张,完全脱发;3级为明显萎缩,明显毛细血管扩张;4级为溃疡。
1.8 统计学处理 应用SPSS13.0统计软件进行分析,计量资料以±s表示,计数资料采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
CRT和IMRT靶区剂量分布PTV3的平均值分别为(95.4±1.2)% 和 (98.6±1.1)%;Dmax 平 均 值,IMRT(103.7±2.2)%显著低于 CRT(113.2±1.1)%,P<0.05。CRT与IMRT的适形指数均值分别为:0.39±0.03和0.74±0.08。IMRT的适形度明显优于CRT。CRT和IMRT放疗技术股骨受量见表1。局部控制率92.6%(25/27),总生存率为96.3%(26/27);所有患者都出现了皮肤和骨组织不良反应,见表2。

表2 不良反应发生情况(n)
3 讨 论
STS是一种相对少见的肿瘤,发病率在恶性肿瘤中约占1%,其中肢体发病约占75%,而其中下肢发病率最高,占总发病率的50%左右[6]。其组织类型复杂多样,以恶性纤维组织肉瘤、脂肪肉瘤和平滑肌肉瘤最多见。目前,STS多采用多学科综合治疗,根据肿瘤类型、组织学分级以及分期予手术、放疗及化疗,其中放疗在STS综合治疗中起到了非常重要的作用,可以缩小手术范围,在提高肢体保全率的同时保持较高的局部控制率,国内外进行的大量肢体STS放疗的研究大部分都明确肯定其疗效[1-4]。随着患者局部控制率的改善,放疗相关不良反应报道日益增多,包括肱骨、尺骨、股骨、胫骨、腓骨等患侧肢体的长骨骨折,尤其股骨骨折发病率较高[7-10],其危害较大,常出现延迟愈合、不愈合及骨不连接,需要接受人工假体置换手术或截肢手术治疗,严重影响患者的生活质量[11-12];长期以来,肢体STS均以前后对穿野的常规放疗为主,其靶区的剂量分布上存在着一些难以克服的问题,如靶区剂量偏低、骨及周边正常组织剂量过高等,而IMRT可产生高度适合靶区形状的剂量分布,明显减少周围危及器官的受照剂量和体积,减轻周围正常组织的不良反应,达到提高治疗增益比的目的。本研究结果显示,在靶区的剂量分布与适形性方面,IMRT技术相对于其他技术具有明显优势,尤其当靶区形状为凹形时;所有患者IMRT计划中股骨的平均剂量及最大剂量均显著减低,股骨V45减少近50%,高剂量区明显减低,减少了放疗后发生骨折的风险,本研究关于靶区适形度与骨结构保护的结果与其他报道的结果相近[13-14]。同时,IMRT通过同步推量技术,使多个靶区可以在同一段计划中得到不同的照射剂量,缩短了治疗时间;短期随访发现IMRT有较好的近期疗效,初步临床观察证实,IMRT治疗大腿STS保肢术后患者有较高的局部控制率,皮肤及骨组织的晚期不良反应较轻,改善了患者的生活质量。
与CRT比较,IMRT能提高大腿STS保肢术后放疗靶区剂量,减少周围骨组织等危及器官受照剂量,减轻急慢性放射反应。但IMRT在临床应用中仍面临着许多问题:靶区范围的确定难度大,分次剂量变化大,执行时间长,对肿瘤生物学效应的影响尚不明确等。
[1] 易俊林,刘新帆,顾大中.术后放射治疗在原发肢体软组织肉瘤治疗中的作用[J].中华放射肿瘤学杂志,2000,9(2):23-26.
[2] Clarkson P,Ferguson PC.Primary multidisciplinary management of extremity soft tissue sarcomas[J].Curr Treat Options Oncol,2004,5(6):451-462.
[3] 罗英,胡炳强.184例软组织肉瘤患者不同治疗方法分析[J].中华肿瘤杂志,2004,13(8):57-59.
[4] Alektiar KM,Hong L,Brennan MF,et al.Intensity modulated radiation therapy for primary soft tissue sarcoma of the extremity:preliminary results[J].Int J Radiat Oncol Biol Phys,2007,68(2):458-464.
[5] Kutcher GJ,Burman C,Brewster L,et al.Histogram reduction method for calculating complication probabilities for three-dimensional treatment planning evaluations[J].Int J Radiat Oncol Biol Phys,1991,21(1):137-146.
[6] Swallow CJ,Catton CN.Local management of adult soft tissue sarcomas[J].Semin Oncol,2007,34(3):256-269.
[7] Cannon CP,Ballo MT,Zagars GK,et al.Complications of combined modality treatment of primary lower extremity soft-tissue sarcomas[J].Cancer,2006,107(10):2455-2461.
[8] Dickie CI,Parent AL,Griffin AM,et al.Bone fractures following external beam radiotherapy and limb-preservation surgery for lower extremity soft tissue sarcoma:relationship to irradiated bone length,volume,tumor location and dose[J].Int J Radiat Oncol Biol Phys,2009,75(4):1119-1124.
[9] Blaes AH,Lindgren B,Mulrooney DA,et al.Pathologic femur fractures after limb-sparing treatment of soft-tissue sarcomas[J].J Cancer Surviv,2010,4(4):399-404.
[10]Gortzak Y,Lockwood GA,Mahendra A,et al.Prediction of pathologic fracture risk of the femur after combined modality treatment of soft tissue sarcoma of the thigh[J].Cancer,2010,116(6):1553-1559.
[11]Lin PP,Boland PJ,Healey JH.Treatment of femoral frac-tures after irradiation[J].Clin Orthop Relat Res,1998(352):168-178.
[12]Lin PP,Schupak KD,Boland PJ,et al.Pathologic femoral fracture after periosteal excision and radiation for the treatment of soft tissue sarcoma[J].Cancer,1998,82(12):2356-2365.
[13]Alektiar KM,Brennan MF,Singer S.Influence of site on the therapeutic ratio of adjuvant radiotherapy in soft-tissue sarcoma of the extremity[J].Int J Radiat Oncol Biol Phys,2005,63(1):202-208.
[14]Stewart AJ,Lee YK,Saran FH.Comparison of conventional radiotherapy and intensity-modulated radiotherapy for post-operative radiotherapy for primary extremity soft tissue sarcoma[J].Radiother Oncol,2009,93(1):125-130.

