平顶猴在HIV/AIDS动物模型中的应用及研究进展
雷爱华,庞 伟,张高红,郑永唐,3,4,*
1. 中国科学院和云南省动物模型与人类疾病机理重点实验室, 中国科学院昆明动物研究所, 云南 昆明 650223;
2. 中国科学院大学, 北京 100049;
3. 中国科学院昆明灵长类研究中心, 云南 昆明 650223;
4. 中国科学院昆明动物研究所-香港中文大学生物资源与疾病分子机理联合实验室, 云南 昆明 650223
非人灵长类(nonhuman primates, NHP)动物在组织结构、免疫、生理和代谢等方面与人类非常相似,对于研究 HIV/AIDS传播和致病机制以及抗AIDS药物和疫苗具有不可替代的作用(Li et al,2007a; Zhang et al, 2007; Van Rompay, 2012; Zhu et al, 2010)。在NHP动物中,黑猩猩(chimpanzee, Pan troglodytes)和长臂猿(gibbon, Nomascus nasutus)能被HIV-1感染,但感染后不发病;且由于它们是濒危珍贵动物,作为AIDS模型动物受到了极大限制。旧大陆猴(Old World monkey)中的猕猴(rhesus macaques, Macaca mulatta)和食蟹猴(cynomolgus macaques, Macaca fascicularis)均不能被 HIV-1感染,而能被猴免疫缺陷病毒 (simian immunodeficiency virus, SIV)和人/猴嵌合免疫缺陷病毒(simian-human immunodeficiency virus, SHIV)所感染,感染后会出现类似人AIDS症状。目前,SIV/SHIV猕猴模型是最常用的 AIDS动物模型(Ambrose et al, 2007)。然而,SIV/SHIV与HIV-1之间存在较大的遗传差异,在评价药物及疫苗有效性和安全性上存在局限性 (Ambrose et al, 2007; Van Rompay, 2012; Zhang et al, 2007)。因此,构建合适的NHP动物模型仍然是HIV/AIDS研究中的热点和难点。
平顶猴(pigtailed macaques),又称豚尾猴,是目前唯一报道可以被HIV-1感染的旧大陆猴(Agy et al,1992; Hu, 2005),作为HIV/AIDS模型动物具有许多优势。本文综述了平顶猴在HIV/AIDS动物模型上的研究进展及其相关分子机制,阐述了 SIV、HIV、SHIV和HSIV通过不同途径感染平顶猴的特点,并结合我们实验室的工作探讨了平顶猴 AIDS模型的限制因素和前景。
1 平顶猴HIV/AIDS动物模型的优点
猴科猕猴属的平顶猴、猕猴 (包括印度猕猴和中国猕猴)和食蟹猴是目前 HIV/AIDS研究中应用最为广泛的 NHP动物(Baroncelli et al, 2008;Hatziioannou & Evans, 2012)。平顶猴在~500万年前与猕猴和食蟹猴从进化上产生了分歧,而猕猴和食蟹猴之间则在 240万年后才出现分歧(Baroncelli et al, 2008; Morales & Melnick, 1998)。2001 年动物分类学家将平顶猴中的3个亚种提升为3个不同的种:巽他平顶猴 (sunda pigtailed macaques, M.nemestrina)、北平顶猴 (northern pigtailed macaques,M. leonina)和明打威猴 (mentawai macaques, M.pagensis) (Groves, 2001; Gippoliti, 2001; Kuang et al,2009)。在地理分布上,巽他平顶猴(M. nemestrina)主要分布于马来西亚半岛南部、苏门答腊及波罗洲;明打威猴 (M. pagensis)主要生活在明打威群岛;北平顶猴 (M. leonina)主要栖息在我国云南西南部和西藏东南部以及缅甸、泰国、马来半岛和印度支那地区等地 (Rosenblum et al, 1997)。目前尚无这3种平顶猴对SIV/HIV病毒易感性是否存在差异的研究报道。迄今为止,几乎所有SIV/HIV感染平顶猴模型的研究报道使用的平顶猴均为巽他平顶猴 (M. nemestrina)。
与猕猴和食蟹猴相比,平顶猴在HIV/AIDS动物模型方面具有许多优势。首先,在HIV-1性传播模型方面,平顶猴体型较大,生殖道组织结构及月经周期与人很相似,全年均可繁殖,非常适合作为性传播疾病模型动物 (Patton et al, 2009)。尽管食蟹猴全年可繁殖,但是其体型较小,阴道腔和子宫颈直径也较小,给阴道镜检查和多次活检带来了很大的困难 (Patton et al, 2004)。猕猴的繁殖则具有明显的季节性。目前,平顶猴在阴道毛滴虫,沙眼衣原体等性传播疾病方面的相应模型已经建立 (Patton et al, 2001; Patton et al, 2006)。鉴于其它性传播疾病会增加HIV-1感染人的风险,Henning et al (2011)首次成功建立了SHIVSF162P3、沙眼衣原体与阴道毛滴虫的共感染平顶猴模型,临床症状与人类似,为平顶猴在杀微生物剂等方面的应用提供了技术支持。其次,在HIV-1静脉传播模型方面,由于病毒限制因子TRIM5α的存在,猕猴和食蟹猴对HIV-1感染存在一种进入后限制感染的现象 (Stremlau et al, 2004)。与猕猴和食蟹猴不同,平顶猴可被HIV-1感染 (Agy et al, 1992; Bosch et al, 2000)。我们实验室首次发现平顶猴不表达限制 HIV-1复制的TRIM5α蛋白,而是形成TRIM5-CypA融合模式,且融合产物不限制HIV-1的复制,在细胞和分子水平上证实了北平顶猴是较理想的艾滋病模型动物(Cao et al, 2012; Kuang et al, 2009; Liao et al, 2007)。此外,近年来发现平顶猴对simian tropic (st) HIV-1和 HSIV-vif易感(Hatziioannou et al, 2009;Hatziioannou & Evans, 2012; Thippeshappa et al,2011),预示平顶猴在HIV-1/AIDS动物模型的研究中具有较好前景。
2 HIV/AIDS平顶猴模型
当前,静脉吸毒和黏膜传播 (同性传播和异性传播)是HIV-1传播的两种主要途径。在感染途径方面,Zhou et al (2013)发现通过血液途径感染的HIV-1患者比通过黏膜途径感染的患者具有更强的T细胞免疫应答。然而,在猴AIDS模型上,一些研究发现静脉和黏膜感染两种途径对于感染后病毒载量和CD4+T细胞的变化影响不大 (Batten et al,2006; Laurén et al, 2006)。同时也有研究发现HIV/SIV的接种途径会影响病毒在体内的遗传变异及致病性 (Couedel-Courteille et al, 2003; Ambrose et al, 2001)。这也许与不同病毒感染不同非人灵长类动物有关。以下重点介绍SIV、HIV、SHIV和HSIV通过不同途径感染平顶猴的特征及模型的应用价值。
2.1 SIV感染平顶猴
现已发现有~40种物种特异性(species specificity)的 SIV存在于不同的非洲猴中,在进化和来源上至少可以分为 SIVsm、SIVagm、SIVgsn、SIVcpz、SIVlhoest、SIVcol和 SIVmnd等 7 大支系(Klatt et al, 2012b)。SIV感染其自然宿主后,尽管宿主体内的病毒载量较高但通常不发病(Hatziioannou &Evans, 2012; Klatt et al, 2012b)。SIV和HIV-2的基因组序列相似性为~80%,而与HIV-1的基因组序列相似性仅为45% (Baroncelli et al, 2008) ,SIV与HIV-1的基因结构图如图1。由于SIV感染的猕猴出现肠系膜淋巴结处记忆CD4+T细胞减少和AIDS样临床症状 (Lackner & Veazey, 2007),因而被大量用于AIDS研究。
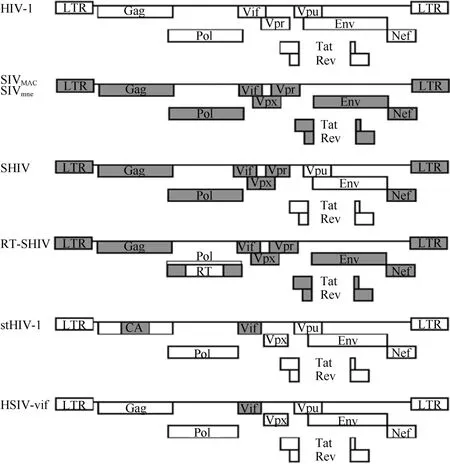
图1 不同免疫缺陷病毒的基因结构 (经Elsevier许可,修改自Ambrose et al, 2007)Figure 1 Genome structure of various immunodeficiency viruses (Adapted from Ambrose et al, 2007 with permission from Elsevier)
早在1988年,科学家就发现从SIV感染的平顶猴淋巴结中分离出的SIVmne能感染平顶猴,感染的平顶猴出现腹泻、贫血和消瘦等症状 (Benveniste et al, 1988)。迄今为止,研究者已利用多种SIV建立平顶猴感染模型。例如,SIVagm感染平顶猴能引起其CD4+T细胞数减少,最终出现猴AIDS症状(Goldstein et al, 2005)。同时,研究发现SIVsmm的变异株SIVsmmPBj14感染平顶猴后,在10~14 d内平顶猴会出现CD4+T细胞数量快速下降、腹泻和消瘦等致死性综合征 (O'Neil et al, 1999),而HIV-1感染者是在感染晚期由于免疫缺陷而出现各种 AIDS临床症状。由于SIVsmmPBj14感染的平顶猴与人AIDS在发病时间和致病机制上不同,目前该模型研究较少。与SIVsmmPBj14不同,SIVsun和SIVlhoest静脉感染平顶猴能使平顶猴的外周血和淋巴结处CD4+T细胞数下降,出现鸟分枝杆菌和卡氏肺囊虫等机会性感染,但病毒载量与平顶猴的疾病进程无明显关联(Beer et al, 2005),与人AIDS情况不太一致。有些研究者发现SIVmac感染平顶猴后,血浆中最高的病毒载量与HIV-1感染人的相当 (表1), 外周血CD4+T细胞逐渐下降,与人感染 HIV-1的情况很相似(Batten et al, 2006; Klatt et al, 2012a; Smith et al,2005)。Klatt et al (2012a) 在对 SIVmac239静脉感染平顶猴动态过程的研究中发现,平顶猴比猕猴的疾病进程要快,平均分别为42.17周和69.56周,其原因可能是由于平顶猴感染SIV前的免疫活化水平高于猕猴,这与他们之前的研究结果较为一致 (Klatt et al,2010) 。而Mason et al (2008) 发现SIV感染前平顶猴中心记忆CD4+T细胞数的多少与SIVmac251感染平顶猴的疾病进程快慢有关,即感染前中心记忆CD4+T细胞数越少,感染后平顶猴的发病进程越快。此外,SIVmac感染平顶猴后疾病进程的快慢可能与平顶猴的自身免疫遗传背景有关。例如,Smith et al (2005)研究发现平顶猴中MHC-I类分子Mane-A*10 (将SIV Gag KP9抗原肽呈递给效应T细胞)和猕猴中的Mamu-A*01一样会抑制SIV在猴体内的复制。这些结果均说明SIV感染平顶猴的疾病进程可能受多方面因素影响。

表1 HIV/AIDS平顶猴模型的主要特征Table 1 Main characteristics of HIV/AIDS infection in pigtailed macaques
总之,SIV感染的平顶猴发病症状较明显,与人AIDS相似。SIVmac感染平顶猴模型现已被应用于AIDS发病机制,药物和疫苗等方面的研究。此外,有些SIVmac239感染平顶猴的疾病进程缓慢,类似 HIV-1感染者中的长期无进展者,可作为HIV-1/AIDS研究中的长期不进展模型 (Klatt et al,2012a)。不足的是,SIV与HIV-1间遗传差异较大,不能真实反应HIV-1蛋白在猴体内的功能。例如,SIV不表达HIV-1的Vpu蛋白,从而限制了Vpu基因相关功能和靶标的研究。同样,SIV表达的Vpx蛋白在 HIV-1中不表达。由于序列的差异性,对HIV-1逆转录酶 (RT) 有抑制作用的非核苷类逆转录酶抑制剂(NNRTIs)对 SIVmacRT无抑制作用(Uberla et al, 1995)。此外,由于囊膜蛋白及抗原表位的差异,猴体内对抗SIV复制的天然和获得性免疫反应(中和抗体,CTL反应)与HIV-1感染人所引起的免疫反应不尽不同 (Ambrose et al, 2007)。因此,SIV感染模型用于AIDS研究具有局限性。
2.2 HIV感染平顶猴
在寻找建立HIV/AIDS动物模型的过程中,Agy et al (1992)首次在体外使用不同的HIV-1感染平顶猴、猕猴和食蟹猴等的外周血单个核细胞(PBMC),发现仅平顶猴PBMC对 HIV-1易感;用 HIV-1LAI通过静脉成功感染的2只平顶猴在感染后能持续检测到 HIV-1抗体并且从分离的 PBMC中能培养出HIV-1LAI。但是,令人遗憾的是 HIV-1感染的平顶猴CD4+T细胞数基本不变,病毒载量很低且缺乏持续性,亦不表现猴AIDS症状 (表1)。为使HIV-1在平顶猴体内持续复制,Agy et al (1997) 试图通过HIV-1NL4-3和 HIV-1LAI在多只平顶猴体内传代以得到致病力更强的毒株,但未取得成功。Bosch et al(2000) 将HIV-1在新生平顶猴中传代,结果HIV-1发生累积突变,毒力得到提高,但是猴CD4+T细胞数量无变化且病毒血症仍缺乏持续性。在免疫应答方面,Kent et al (1995)研究发现HIV-1感染平顶猴后4~8周就出现了针对 HIV-1 gag、env和nef蛋白的细胞毒T细胞效应(CTL)并持续至140周。同时,他们得出 HIV-1特异的 T淋巴细胞反应与HIV-1不能持续感染平顶猴有关(Kent et al, 1997)。这些研究结果说明细胞免疫对控制HIV-1在平顶猴中的复制发挥了重要作用。
与HIV-1感染平顶猴不同,HIV-2静脉感染平顶猴后,CD4+T细胞数明显下降且产生持续的病毒血症并出现人AIDS症状 (表1)。强致病株HIV-2287静脉感染的平顶猴CD4+T细胞数在2个月时开始下降,6~12个月就发展到AIDS期 (Kuller et al,2001)。相比之下,SIVsm感染的猕猴CD4+T细胞数下降通常发生在感染后4~12个月,发展到AIDS期则需要1~3 a (Hirsch & Johnson, 1994)。HIV-1感染者的CD4+T细胞数逐渐下降一般发生在感染后7~10 a,发展到AIDS期通常也在感染后7~10 a,而 HIV-2感染者的病程很缓慢(Staprans &Feinberg, 2004)。HIV-2287对平顶猴的致病力很强,可用于AIDS急性致病机理的研究。此外,Pullium et al (2001)采用HIV-2GB122分别通过静脉和直肠感染平顶猴,平顶猴精浆中出现病毒的时间要比血液中出现病毒的时间晚 1~2周,且在病毒载量上低10倍。同时,与通过静脉感染的平顶猴相比,通过直肠感染的平顶猴精液中病毒的持续时间较短。这对于 HIV-1静脉和性传播的预防研究具有重要意义。
综上所述,迄今为止,研究建立的HIV-1感染平顶猴是一个急性过程,病毒血症缺乏持续性,尚不能应用于AIDS药物和疫苗的研究。HIV-2感染平顶猴是目前HIV感染旧大陆猴中唯一出现AIDS样症状的动物模型。由于HIV-2仅在西非局部地区流行,致病力较弱,因此对 HIV-2/AIDS动物模型的研究较少。平顶猴不表达TRIM5α限制因子可能是其对 HIV易感的一个重要原因 (Brennan et al,2007; Kuang et al, 2009; Liao et al, 2007)。尽管已经发现宿主的细胞免疫对于控制病毒复制发挥重要作用,但是在HIV-1感染平顶猴的后期,病毒是否转为潜伏感染或是被宿主彻底清除仍有待进一步研究。
2.3 SHIV感染平顶猴
由于SIV感染猕猴模型在评价艾滋病疫苗和药物的有效性方面存在较大局限性,因此,研究者采用分子克隆技术构建了以SIVmac为骨架嵌合HIV-1 env、tat、rev和 vpu基因的 SIV-HIV 嵌合病毒Env-SHIV(Shibata et al, 1991) (图1)。为了评价逆转录酶抑制剂的有效性,Uberla et al (1995)构建了嵌入HIV-1 RT的RT-SHIV,并成功感染猕猴。近年来,研究者通过将SHIV病毒在猴体内多次传代培养已经得到了诸如 SHIV89.6P(X4型, env来自HIV-189.6)、SHIVKU-1(X4型,env来自 HIV-1IIIB)和SHIVSF162P3(R5型, env来自HIV-1SF162)等强致病株(Staprans & Feinberg, 2004)。SHIV病毒可以通过静脉和黏膜两种途径感染平顶猴,感染猴出现CD4+T细胞数下降和腹泻、消瘦等重要艾滋临床指标 (表1)。SHIVSF162P3感染猴的疾病进程较缓慢,病毒载量与 HIV-1感染人的较为接近,因而被大量用于HIV/AIDS研究(Staprans & Feinberg, 2004)。Vishwanathan et al (2011)研究了反复低剂量SHIVSF162P3阴道途径攻毒感染平顶猴与其月经周期的关系,发现在黄体后期(孕酮水平很高且局部免疫水平较低)平顶猴对SHIV易感。Polacino et al (2008)将R5型的SHIVSF162P4采用静脉和黏膜两种途径感染平顶猴和猕猴,发现平顶猴的病毒载量高于猕猴且病毒血症持续时间较长,说明SHIV病毒对平顶猴更易感。此外,Shehu-Xhilaga et al (2007) 用SIVmac251静脉感染和 SHIVmn229直肠感染平顶猴,发现在急性感染期后,平顶猴的睾丸和附睾组织均含有SIV和SHIV病毒。这对于研究HIV-1性传播机制和HIV-1传播的预防具有重要意义。Ambrose et al (2001)则用SHIV89.6通过阴道和静脉两种途径感染平顶猴,发现通过阴道比通过静脉感染的平顶猴的前病毒载量峰值和 CD4+细胞下降出现的时间要晚1周;在黏膜免疫应答方面,阴道途径感染的平顶猴黏膜CD8+T细胞反应更快、黏膜抗SHIV抗体水平更高,而在系统免疫应答方面无差别。这说明病毒通过阴道感染宿主时,宿主产生了更强的抗病毒免疫反应。在 RT-SHIV感染平顶猴模型方面,Jiang et al (2009)研究发现 RT-SHIV(RT来自HIV-1HXB2)对非核苷酸逆转录酶抑制剂(NNRTIs)敏感且能够通过阴道途径感染平顶猴,可用于NNRTIs以及杀微生物剂和疫苗的研究。
总之,SHIV在基因序列上比 SIV更接近于HIV-1,在抗体研究和以囊膜蛋白为抗原的疫苗评价中具有明显的优势 (Ambrose et al, 2007; Zhang et al, 2007)。因此,SHIV感染平顶猴模型在AIDS发病机制、疫苗和杀微生物剂研究等方面得到了广泛应用(Batten et al, 2006; Kent et al, 2005; Zhu et al,2010)。然而,SHIV是以SIV为骨架所构建,在序列上与HIV-1存在较大差异。因此,SHIV感染平顶猴模型在研究AIDS发病机制及药物和疫苗等方面仍然具有一定的局限性。最近,相关研究采用焦磷酸测序技术研究了平顶猴和正常女性阴道菌群的组成及含量,发现平顶猴的阴道菌群与正常女性的阴道菌群之间存在差异 (Spear et al, 2012),这为阴道菌群如何影响SIV/SHIV通过阴道途径感染平顶猴的研究打下了基础。
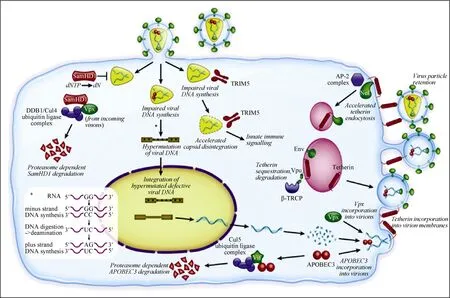
图2 抗HIV和SIV的限制因子和拮抗它们的病毒蛋白 (经Elsevier许可,引自Blanco-Melo et al, 2012 )Figure 2 Restriction factors that target HIV and SIV and their vial antagonists(Cited from Blanco-Melo et al, 2012 with permission from Elsevier)
2.4 HSIV感染平顶猴
近年来,研究者采用分子生物学手段对 HIV-1和宿主的相互作用进行了深入研究,发现了一系列抗病毒的宿主限制因子, 如 TRIM5、APOBEC3及SAMHD1 等(图 2)(Blanco-Melo et al, 2012)。其中,三模体蛋白 5α (tripartite motif protein 5α, TRIM5α)和 载 脂 蛋 白 B mRNA 编 辑 酶 3G 和 3F(apolipoprotein B mRNA-editing enzyme 3G and 3F,APOBEC3G/3F)是 3个主要的限制因子。猕猴TRIM5α 能识别HIV-1并与HIV-1衣壳蛋白相互作用,限制HIV-1在猕猴细胞中的复制 (Stremlau et al,2004)。APOBEC3G和APOBEC3F为胞嘧啶脱氨酶,在病毒逆转录时可以将其 cDNA的胞嘧啶(C)脱氨为尿嘧啶(U), 使前病毒发生超突变,抑制病毒的复制作用,而这一作用可被病毒的辅助蛋白Vif (virion infectivity factor)所拮抗且拮抗作用具有物种特异性(species-specificity)。HIV-1的 Vif蛋白能够拮抗人的APOBEC3G/F,而不能拮抗猴的APOBEC3G/F(Chiu & Greene, 2008)。研究发现,APOBEC3H也能限制HIV-1的复制 (Albin & Harris, 2010)。在一些HIV-1感染者中,APOBEC3 mRNA的表达水平和HIV-1病毒载量或病毒发生超突变的百分比呈负相关,而与CD4+T细胞数正相关 (Albin & Harris,2010)。例如,Ulenga et al (2008)发现在 APOBEC3G和APOBEC3F mRNA水平上,低调定点病毒载量的HIV-1感染者比高调定点病毒载量的感染者的表达量明显要高。同时,Mussil et al (2011)发现SIV感染的猕猴中,病毒载量较低或长期不进展的猕猴体内APOBEC3G和APOBEC3F mRNA表达量明显升高。最近,Endsley & Ho (2012)发现HIV-2287感染平顶猴后,APOBEC3G-CD4、Vif-CD4及APOBEC3G-Vif间存在较强的相关性。
基于拮抗猕猴TRIM5α和APOBEC3蛋白限制病毒复制的作用及缩小SIV/SHIV与HIV-1之间的遗传差异的双重考虑,Hatziioannou et al (2006)以HIV-1为骨架将其表达衣壳蛋白(CA)的基因和 vif基因替换成 SIVmac的相应基因构建了 stHIV-1(simian-tropic HIV-1) (图1)。他们发现stHIV-1在体外多次传代后能在猕猴外周血淋巴细胞(PBL)中复制。Kamada et al (2006)则将HIV-1NL4-3的CA基因的一小段 (HIV-1 cyclophilin A结合位点)和vif基因替换成 SIVmac的相应基因并经体外传代后得到HIVNL-DT5R。他们的体外结果显示平顶猴 T淋巴细胞比猕猴T淋巴细胞对HIVNL-DT5R更易感。平顶猴感染HIVNL-DT5R后能产生针对HIV-1蛋白的抗体,但平顶猴感染后的CD4+T细胞数没有下降,没有出现AIDS病症 (Igarash et al, 2007) (表1)。此外,Kuroishi et al (2009)在HIVNL-DT5R的基础上将HIV-1衣壳蛋白的 α螺旋 6和 7之间的环序列替换成SIVmacL6/7 CA的序列提高了其在食蟹猴细胞上的复制能力。随后,Saito et al (2011)采用基因工程方法构建了HIV-1(MN4-5S),发现其在食蟹猴体内、外的复制能力强于 HIVNL-DT5R的复制能力,与HIVNL-DT5R感染平顶猴的能力相当 (Igarashi et al,2007),而MN4-5S和HIVNL-DT5R均不能在猕猴细胞中复制。随后,他们对stHIV-1的Gag-CA的序列区进行改造得到了一系列的 HIV-1mt (macaquetropic HIV-1), 体外实验发现病毒 MN4Rh-3(Gag-CA 发生 Q110D 突变)在食蟹猴细胞中的复制能力得到提高但与TRIM5α蛋白的抗病毒作用无关,这说明猴体内可能还存在其他蛋白与 Gag-CA蛋白相互作用影响病毒的复制水平(Nomaguchi et al,2013)。上述研究结果表明stHIV-1病毒对宿主的易感性受猴的免疫遗传背景影响,stHIV-1对不同猴的易感性排序为:平顶猴>食蟹猴>猕猴。
由于平顶猴细胞不表达限制 HIV-1复制的TRIM5α蛋白,研究人员以HIV-1为骨架仅将HIV-1的 vif基因替换成SIV的vif基因构建了 HSIV-vif毒株 (Hatziioannou et al, 2009; Thippeshappa et al,2011) (图 1)。Hatziioannou et al (2009) 在 HIV-1NL4-3的基础上构建了stHIV-1SV(vif来自SIVmac239,env来自SHIV-KB9)、stHIV-12V(vif来自HIV-2ROD,env来自SHIV-KB9)和stHIV-1SCA+SV(在stHIV-1SV基础上将CA的序列替换成SIVmac239的CA序列),且它们在平顶猴细胞中均能很好地复制(图3)。同时,他们将stHIV-1SV和stHIV-12V混合感染平顶猴后发现感染急性期的病毒载量水平与HIV-1感染者急性期的病毒载量水平相当,且在感染后0.5 a内均能在猴体内检测到病毒血症 (表1),而随后由于CD8+T细胞或其他免疫细胞和分子的抗病毒作用,病毒在平顶猴体内的复制受到了抑制。同时,采用鸡尾酒疗法对平顶猴进行感染前预防用药(pre-exposure prophylaxis, PrEP),发现PrEP可有效预防高剂量的stHIV-1sv/2v静脉感染平顶猴。与之类似的是,Thippeshappa et al (2011) 在HIV-1NL4-3的基础上只将 vif 替换成 SIVmne027的 vif得到 HSIV-vif,,通过静脉感染平顶猴后,也出现持续的病毒血症(>1.5~2 a)和针对HIV-1的特异抗体反应。Humes& Overbaugh (2011)在R5嗜性A亚型的HIVAQ23的基础上将其 vif基因替换为 SIVmac239的 vif构建了HIVAQ23/SIVvif病毒。HIVAQ23/SIVvif在平顶猴淋巴细胞中的复制能力较弱,但在体外传代过程中gp120处发生了2个独立的突变: G312V(V3环)和A204E(C2区)。这2个突变显著提高了病毒gp120与平顶猴细胞CD4分子的相互作用,使得病毒复制水平明显上升。这为提高含HIV-1A亚型基因的HSIV病毒在平顶猴细胞中的复制水平提供了有用线索。
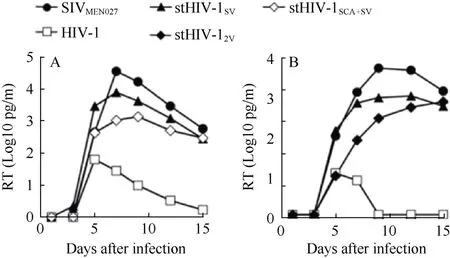
图 3 stHIV-1在平顶猴淋巴细胞上的复制 (引自Hatziioannou et al, 2009)Figure 3 Replication of stHIV-1 variants in pigtailed macaque lymphocytes in vitro (cited from Hatziioannou et al, 2009)
创建接近于人 AIDS的动物模型一直是 AIDS非人灵长类动物模型研究的方向,而HIV/AIDS动物模型能否用于HIV-1方面的研究取决于所用病毒与HIV-1在病毒传播、致病性和变异性等方面的相似程度。与SHIV(含28%~30%的HIV-1序列)不同,stHIV-1或HSIV-vif涵盖了≥90%的HIV-1序列,为针对HIV-1的药物、疫苗和杀微生物剂的研究提供了很好的平台。建立类似人AIDS症状的stHIV-1或HSIV感染平顶猴模型将是未来AIDS研究领域中的一个重要方向。目前,HSIV-vif感染平顶猴模型解决了HIV-1不能持续感染平顶猴的问题,但是感染后的平顶猴CD4+T细胞数没有明显变化,平顶猴不出现艾滋病症。另外,当前大部分流行HIV-1病毒是CCR5嗜性的(Staprans & Feinberg, 2004),因此构建R5型的HSIV-vif感染平顶猴模型具有重要的现实意义。Thippeshappa et al (2011) 的体外实验结果表明R5型的HSIV-vif与X4型的HSIV-vif在平顶猴PBMC中的复制水平相当。然而,HSIV-vif是否能通过黏膜途径感染平顶猴,R5型的HSIV-vif是否能持续感染平顶猴等的问题有待进一步研究。2011年,研究者在髓系来源的单核细胞中发现了抗HIV-1限制因子 SAMHD1(sterile alpha motif and histidine/aspartic acid domain-containing protein 1),其在活化的CD4+T细胞中不表达,而在表达CCR5受体的静息CD4+T细胞、巨噬细胞以及树突状细胞中均有所表达 (Baldauf et al, 2012; Li PL et al,2012)。SAMHD1是一种 dGTP激活的三磷酸水解酶,通过降解HIV-1逆转录所需的dNTPs来抑制病毒的复制,且可被HIV-2和SIV编码的Vpx蛋白所拮抗(Blanco-Melo et al, 2012)。Vpx蛋白在SIV有效感染平顶猴中发挥重要作用 (Belshan et al,2012)。猴和人的SAMHD1均能有效抑制HIV-1的复制水平。因此,R5型的stHIV-1或HSIV病毒在平顶猴体内的复制会受到 SAMHD1的抑制。由此可见,为使 HSIV-vif感染的平顶猴发病进程与人AIDS相似,我们有必要对stHIV-1或HSIV-vif病毒在猴体内进行传代或进一步改造,如嵌入SIV的vpx基因、替换HIV-1的其他基因序列或对病毒质粒进行定点突变。
3 展 望
在过去的30 a中,HIV/AIDS灵长类动物模型在HIV-1的传播和致病机制、临床前AIDS疫苗的研发、药物和杀微生物剂等的研究方面发挥了举足轻重的作用。HAART治疗能控制HIV-1复制,但是不能清除病毒潜伏库。我们或许能在非人灵长类动物模型上找到根治HIV-1的方法或策略。但是病毒感染物种的特异性给构建合适的AIDS动物模型带来了极大的挑战,缺少对HIV-1易感的动物模型仍然是制约人类对抗HIV/AIDS的一大瓶颈。在旧大陆猴中,平顶猴与猕猴和食蟹猴不同,能急性感染HIV-1且对某些SIV/SHIV更易感。尽管HSIV感染平顶猴后未出现艾滋症状,但HSIV能持续感染平顶猴,有望成为更合适的HIV/AIDS静脉和性传播动物模型。
近年来,平顶猴数量的不足及其遗传背景资料的缺乏严重限制了其在病毒免疫学方面的研究和应用。灵长类动物的某些MHC会影响病毒的免疫逃逸,某些 MHC的等位基因能够显著延缓 AIDS疾病的进展 (Baroncelli et al, 2008; Dai et al, 2008)。因此,系统研究平顶猴MHC的遗传背景对于深入理解SIV/HIV感染平顶猴的致病机理及疫苗研究具有重要意义。中国科学院昆明动物研究所规模引进了北平顶猴 (M. leonina)并进行饲养繁育和种群扩大,将为我国科技自主创新、疾病防控和人类健康提供强有力的支撑。我们实验室已经建立了SIV/SHIV感染中国猕猴的AIDS动物模型并进行了相关机制研究 (Li et al, 2007b; Li SY et al, 2012; Ma et al, 2012; Xia et al, 2010; 2011),积累了较丰富的经验。我们还对北平顶猴的血液学和血液生化学指标参数进行了测定,为北平顶猴动物模型创建提供了重要的基础生物学数据(Pang et al, 2013)。目前正在开展新型HIV/HSIV感染北平顶猴方面的工作,旨在进一步研究感染北平顶猴的特性及机制,为HIV/AIDS发病机制、药物和疫苗研究提供更好的研究平台。
Agy MB, Frumkin LR, Corey L, Coombs RW, Wolinsky SM, Koehler J,Morton WR, Katze MG. 1992. Infection of Macaca nemestrina by human immunodeficiency virus type-1. Science, 257(5066): 103-106.
Agy MB, Schmidt A, Florey MJ, Kennedy BJ, Schaefer G, Katze MG, Corey L, Morton WR, Bosch ML. 1997. Serial in vivo passage of HIV-1 infection in Macaca nemestrina. Virology, 238(2): 336-343.
Albin JS, Harris RS. 2010. Interactions of host APOBEC3 restriction factors with HIV-1 in vivo: implications for therapeutics. Expert Reviews in Molecular Medicine, 12: e4.
Ambrose Z, KewalRamani VN, Bieniasz PD, Hatziioannou T. 2007.HIV/AIDS: in search of an animal model. Trends in Biotechnology, 25(8):333-337.
Ambrose Z, Larsen K, Thompson J, Stevens Y, Finn E, Hu SL, Bosch ML.2001. Evidence for early local viral replication and local production of antiviral immunity upon mucosal simian-human immunodeficiency virus SHIV89.6infection in Macaca nemestrina. Journal of Virology, 75(18):8589-8596.
Baldauf HM, Pan XY, Erikson E, Schmidt S, Daddacha W, Burggraf M,Schenkova K, Ambiel I, Wabnitz G, Gramberg T, Panitz S, Flory E, Landau NR, Sertel S, Rutsch F, Lasitschka F, Kim B, Konig R, Fackler OT, Keppler OT. 2012. SAMHD1 restricts HIV-1 infection in resting CD4+T cells.Nature Medicine, 18(11): 1682-1689.
Baroncelli S, Negri DR, Michelini Z, Cara A. 2008. Macaca mulatta,fascicularis and nemestrina in AIDS vaccine development. Expert Review of Vaccines, 7(9): 1419-1434.
Batten CJ, De Rose R, Wilson KM, Agy MB, Chea S, Stratov I, Montefiori DC, Kent SJ. 2006. Comparative evaluation of simian, simian-human, and human immunodeficiency virus infections in the pigtail macaque (Macaca nemestrina) model. AIDS Research and Human Retroviruses, 22(6):580-588.
Beer BE, Brown CR, Whitted S, Goldstein S, Goeken R, Plishka R,Buckler-White A, Hirsch VM. 2005. Immunodeficiency in the absence of high viral load in pig-tailed macaques infected with Simian immunodeficiency virus SIVsun or SIVlhoest. Journal of Virology, 79(22): 14044-14056.
Belshan M, Kimata JT, Brown C, Cheng XG, McCulley A, Larsen A,Thippeshappa R, Hodara V, Giavedoni L, Hirsch V, Ratner L. 2012. Vpx is critical for SIVmne infection of pigtail macaques. Retrovirology, 9(1): 32.
Benveniste RE, Morton WR, Clark EA, Tsai CC, Ochs HD, Ward JM,
Kuller L, Knott WB, Hill RW, Gale MJ. 1988. Inoculation of baboons and macaques with simian immunodeficiency virus/Mne, a primate lentivirus closely related to human immunodeficiency virus type 2. Journal of Virology, 62(6): 2091-2101.
Blanco-Melo D, Venkatesh S, Bieniasz PD. 2012. Intrinsic cellular defenses against human immunodeficiency viruses. Immunity, 37(3): 399-411.
Bosch ML, Schmidt A, Agy MB, Kimball LE, Morton WR. 1997. Infection of Macaca nemestrina neonates with HIV-1 via different routes of inoculation. AIDS, 11(13): 1555-1563.
Bosch ML, Schmidt A, Chen JL, Florey MJ, Agy M, Morton WR. 2000.Enhanced replication of HIV-1 in vivo in pigtailed macaques (Macaca nemestrina). Journal of Medical Primatology, 29(3-4): 107-113.
Brennan G, Kozyrev Y, Kodama T, Hu SL. 2007. Novel TRIM5 isoforms expressed by Macaca nemestrina. Journal of Virology, 81(22):12210-12217.
Cao G, Liu FL, Zhang GH, Zheng YT. 2012. The primate TRIMCyp fusion genes and mechanism of restricting retroviruses replication. Zoological Research, 33(1): 99-107 [曹光, 刘丰亮, 张高红, 郑永唐. 2012. 灵长类动物中 TRIMCyp融合基因模式及对逆转录病毒复制的限制作用. 动物学研究, 33(1): 99-107]
Chiu YL, Greene WC. 2008. The APOBEC3 cytidine deaminases: an innate defensive network opposing exogenous retroviruses and endogenous retroelements. Annual Review of Immunology, 26(1): 317-353.
Couedel-Courteille A, Pretet JL, Barget N, Jacques S, Petitprez K, Tulliez M,Guillet JG, Venet A, Butor C. 2003. Delayed viral replication and CD4+T cell depletion in the rectosigmoid mucosa of macaques during primary rectal SIV infection. Virology, 316(2): 290-301.
Dai ZX, Zhang GH, Zheng YT. 2008. Advances in research of rhesus macaque MHC and its significance in animal models of AIDS. International Journal of Immunology, 31(5): 334-339. [戴正喜, 张高红, 郑永唐. 2008.猕猴MHC研究及在AIDS动物模型中的意义. 国际免疫学杂志, 31(5):334-339.]
Endsley AN, Ho RJ. 2012. Elucidation of the time course of adenosine deaminase APOBEC3G and viral infectivity factor vif in HIV-2287-infected infant macaques. Journal of Medical Primatology, 41(1): 52-59.
Gippoliti S. 2001. Notes on the taxonomy of Macaca nemestrina leonina blyth, 1863 (Primates: Cercopithecidae). Hystrix-Italian Journal of Mammalogy, 12(1): 51-54.
Goldstein S, Ourmanov I, Brown CR, Plishka R, Buckler-White A, Byrum R, Hirsch VM. 2005. Plateau levels of viremia correlate with the degree of CD4+-T-cell loss in simian immunodeficiency virus SIVagm-infected pigtailed macaques: variable pathogenicity of natural SIVagm isolates.Journal of Virology, 79(8): 5153-5162.
Groves CP. 2001. Primate Taxonomy. Washington DC: Smithsonian Institution Press, 222-224.
Hatziioannou T, Evans DT. 2012. Animal models for HIV/AIDS research.Nature Reviews Microbiology, 10(12): 852-867.
Hatziioannou T, Princiotta M, Piatak M, Yuan F, Zhang FW, Lifson JD,Bieniasz PD. 2006. Generation of simian-tropic HIV-1 by restriction factor evasion. Science, 314(5796): 95.
Hatziioannou T, Ambrose Z, Chung NPY, Piatak M, Yuan F, Trubey CM,Coalter V, Kiser R, Schneider D, Smedley J, Pung R, Gathuka M, Estes JD,Veazey RS, KewalRamani VN, Lifson JD, Bieniasz PD. 2009. A macaque model of HIV-1 infection. Proceedings of the Natlonal Academy of Sciences United States of America, 106(11): 4425-4429.
Henning T, Fakile Y, Phillips C, Sweeney E, Mitchell J, Patton D,Sturdevant G, Caldwell HD, Secor WE, Papp J, Hendry RM, McNicholl J,Kersh E. 2011. Development of a pigtail macaque model of sexually transmitted infection/HIV coinfection using Chlamydia trachomatis,Trichomonas vaginalis, and SHIVSF162P3. Journal of Medical Primatology,40(4): 214-223.
Hirsch VM, Johnson PR. 1994. Pathogenic diversity of simian immunodeficiency viruses. Virus Research, 32(2): 183-203.
Hu SL. 2005. Non-human primate models for AIDS vaccine research.Current Drug Targets Infectious Disorders, 5(2): 193-201.
Humes D, Overbaugh J. 2011. Adaptation of subtype a human immunodeficiency virus type 1 envelope to pig-tailed macaque cells.Journal of Virology, 85(9): 4409-4420.
Igarashi T, Iyengar R, Byrum RA, Buckler-White A, Dewar RL, Buckler CE,Lane HC, Kamada K, Adachi A, Martin MA. 2007. Human immunodeficiency virus type 1 derivative with 7% simian immunodeficiency virus genetic content is able to establish infections in pig-tailed macaques. Journal of Virology, 81(20): 11549-11552.
Jiang YH, Tian BP, Saifuddin M, Agy MB, Emau P, Cairns JS, Tsai CC.2009. RT-SHIV, an infectious CCR5-tropic chimeric virus suitable for evaluating HIV reverse transcriptase inhibitors in macaque models. AIDS Research and Therapy, 6(1): 23.
Joag SV, Li Z, Foresman L, Pinson DM, Raghavan R, Zhuge W, Adany I,Wang C, Jia F, Sheffer D, Ranchalis J, Watson A, Narayan O. 1997.Characterization of the pathogenic KU-SHIV model of acquired immunodeficiency syndrome in macaques. AIDS Research and Human Retroviruses, 13(8): 635-645.
Kamada K, Igarashi T, Martin MA, Khamsri B, Hatcho K, Yamashita T,Fujita M, Uchiyama T, Adachi A. 2006. Generation of HIV-1 derivatives that productively infect macaque monkey lymphoid cells. Proceedings of the National Academy of Sciences of the United States of America, 103(45):16959-16964.
Kent SJ, Woodward A, Zhao A. 1997. Human immunodeficiency virus type 1 (HIV-1)-specific T cell responses correlate with control of acute HIV-1 infection in macaques. The Journal of Infectious Diseases, 176(5):1188-1197.
Kent SJ, Corey L, Agy MB, Morton WR, McElrath MJ, Greenberg PD.1995. Cytotoxic and proliferative T cell responses in HIV-1-infected Macaca nemestrina. Journal of Clinical Investigation, 95(1): 248-256.
Kent SJ, Dale CJ, Preiss S, Mills J, Campagna D, Purcell DF. 2001.Vaccination with attenuated simian immunodeficiency virus by DNA inoculation. Journal of Virology, 75(23): 11930-11934.
Kent SJ, Dale CJ, Ranasinghe C, Stratov I, De Rose R, Chea S, Montefiori DC, Thomson S, Ramshaw IA, Coupar BE, Boyle DB, Law M, Wilson KM,Ramsay AJ. 2005. Mucosally-administered human-simian immunodeficiency virus DNA and fowlpoxvirus-based recombinant vaccines reduce acute phase viral replication in macaques following vaginal challenge with CCR5-tropic SHIVSF162P3. Vaccine, 23(42): 5009-5021.
Klatt NR, Silvestri G, Hirsch V. 2012b. Nonpathogenic simian immunodeficiency virus infections. Cold Spring Harbor Perspectives in Medicine, 2(1): a007153.
Klatt NR, Canary LA, Vanderford TH, Vinton CL, Engram JC, Dunham RM,Cronise HE, Swerczek JM, Lafont BA, Picker LJ, Silvestri G, Brenchley JM.2012a. Dynamics of simian immunodeficiency virus SIVmac239 infection in pigtail macaques. Journal of Virology, 86(2): 1203-1213.
Klatt NR, Harris LD, Vinton CL, Sung H, Briant JA, Tabb B, Morcock D,McGinty JW, Lifson JD, Lafont BA, Martin MA, Levine AD, Estes JD,Brenchley JM. 2010. Compromised gastrointestinal integrity in pigtail macaques is associated with increased microbial translocation, immune activation, and IL-17 production in the absence of SIV infection. Mucosal Immunology, 3(4): 387-398.
Kuang YQ, Tang X, Liu FL, Jiang XL, Zhang YP, Gao GX, Zheng YT. 2009.Genotyping of TRIM5 locus in northern pig-tailed macaques (Macaca leonina), a primate species susceptible to Human Immunodeficiency Virus type 1 infection. Retrovirology, 6(1): 58.
Kuller L, Schmidt A, Mack H, Durning M, Birkebak T, Reiner MT,Anderson DM, Morton WR, Agy MB. 2001. Systemic and intestinal immune responses to HIV-2287infection in Macaca nemestrina. AIDS Research and Human Retroviruses, 17(12): 1191-1204.
Kuroishi A, Saito A, Shingai Y, Shioda T, Nomaguchi M, Adachi A, Akari H,Nakayama EE. 2009. Modification of a loop sequence between alpha-helices 6 and 7 of virus capsid (CA) protein in a human immunodeficiency virus type 1 (HIV-1) derivative that has simian immunodeficiency virus (SIVmac239) vif and CA alpha-helices 4 and 5 loop improves replication in cynomolgus monkey cells. Retrovirology, 6(1):70.
Lackner AA, Veazey RS. 2007. Current concepts in AIDS pathogenesis:insights from the SIV/macaque model. Annual Review of Medicine, 58(1):461-476.
Laurén A, Vödrös D, Thorstensson R, Fenyö EM. 2006. Comparative studies on mucosal and intravenous transmission of simian immunodeficiency virus (SIVsm): evolution of coreceptor use varies with pathogenic outcome. Journal of General Virology, 87(Pt 3): 581-594.
Li MH, Zhang GH, Sun T, Zheng YT. 2007a. The value of nonhuman primate animal models in anti-HIV drug studies. Chinese Journal of New Drugs, 16(16): 1237-1242. [李明华, 张高红, 孙涛, 郑永唐. 2007a. 灵长类动物模型在抗 HIV药物研究中的应用. 中国新药杂志, 16(16):1237-1242.]
Li MH, Li SY, Xia HJ, Wang L, Wang YY, Zhang GH, Zheng YT. 2007b.Establishment of AIDS animal model with SIVmac239 infected Chinese rhesus monkey. Virologica Sinica, 22(6): 509-516.
Li PL, Chen QQ, Zhang CY. 2012. SAMHD1—A HIV-1 restriction factor derived from Myeloid lineage monocytes. Zoological Research, 33(5):537-541. [李佩璐, 陈倩倩, 张弛宇. 2012a. 髓系单核细胞来源的HIV-1限制因子—SAMHD1. 动物学研究, 33(5): 537-541.]
Li SY, Xia HJ, Dai ZX, Zhang GH, Fan B, Li MH, Wang RR, Zheng YT.2012. Dynamics and functions of CD4+CD25highregulatory T lymphocytes in Chinese rhesus macaques during the early stage of infection with SIVmac239. Archives of Virology, 157(5): 961-967.
Liao CH, Kuang YQ, Liu HL, Zheng YT, Su B. 2007. A novel fusion gene,TRIM5-Cyclophilin A in the pig-tailed macaque determines its susceptibility to HIV-1 infection. AIDS, 21(Suppl 8): S19-S26.
Looney DJ, McClure J, Kent SJ, Radaelli A, Kraus G, Schmidt A, Steffy K,Greenberg P, Hu SL, Morton WR, Wong-Staal F. 1998. A minimally replicative HIV-2 live-virus vaccine protects M. nemestrina from disease after HIV-2(287) challenge. Virology, 242(1): 150-160.
Ma JP, Xia HJ, Zhang GH, Han JB, Zhang LG, Zheng YT. 2012. Inhibitory effects of chloroquine on the activation of plasmacytoid dendritic cells in SIVmac239 infected Chinese rhesus macaques. Cellular and Molecular Immunology, 9(5): 410-416.
Mason RD, de Rose R, Seddiki N, Kelleher AD, Kent SJ. 2008. Low pre-infection levels and loss of central memory CD4+T cells may predict rapid progression in SIV-infected pigtail macaques. Virology, 381(1): 11-15.Morales JC, Melnick DJ. 1998. Phylogenetic relationships of the macaques(Cercopithecidae: Macaca), as revealed by high resolution restriction site mapping of mitochondrial ribosomal genes. Journal of Human Evoloution,34(1): 1-23.
Mussil B, Sauermann U, Motzkus D, Stahl-Hennig C, Sopper S. 2011.Increased APOBEC3G and APOBEC3F expression is associated with low viral load and prolonged survival in simian immunodeficiency virus infected rhesus monkeys. Retrovirology, 8(1): 77.
Nomaguchi M, Yokoyama M, Kono K, Nakayama EE, Shioda T, Saito A,Akari H, Yasutomi Y, Matano T, Sato H, Adachi A. 2013. Gag-CA Q110D mutation elicits TRIM5-independent enhancement of HIV-1mt replication in macaque cells. Microbes and Infection, 15(1): 56-65.
O'Neil SP, Mossman SP, Maul DH, Hoover EA. 1999. Virus threshold determines disease in SIVsmmPBj14-infected macaques. AIDS Research and Human Retroviruses, 15(2): 183-194.
Pang W, Lv LB, Wang Y, Li C, Huang DT, Lei AH, Zhang GH, Zheng YT.2013, Measurement and analysis of hematology and blood chemistry parameters in northern pigtailed macaques (Macaca leonina). Zoological Research, 34(2): 89-96. [庞伟,吕龙宝,王芸,李贵,黄东体,雷爱华,张高红,郑永唐. 北平顶猴 (Macaca leonina) 血液学和血液生化指标参考值的测定与分析. 动物学研究, 2013, 34(2): 89-96.]
Patton DL, Sweeney YT, Paul KJ. 2009. A summary of preclinical topical microbicide rectal safety and efficacy evaluations in a pigtailed macaque model. Sexually Transmitted Diseases, 36(6): 350-356.
Patton DL, Cosgrove-Sweeney YT, Rabe LK, Hillier SL. 2001. The pig-tailed macaque rectal model: microflora and chlamydial infection.Sexually Transmitted Diseases, 28(7): 363-366.
Patton DL, Sweeney YC, Tsai CC, Hillier SL. 2004. Macaca fascicularis vs.Macaca nemestrina as a model for topical microbicide safety studies.Journal of Medical Primatology, 33(2): 105-108.
Patton DL, Sweeney YT, Agnew KJ, Balkus JE, Rabe LK, Hillier SL. 2006.Development of a nonhuman primate model for Trichomonas vaginalis infection. Sexually Transmitted Diseases, 33(12): 743-746.
Polacino P, Larsen K, Galmin L, Suschak J, Kraft Z, Stamatatos L,Anderson D, Barnett SW, Pal R, Bost K, Bandivdekar AH, Miller CJ, Hu SL.2008. Differential pathogenicity of SHIV infection in pig-tailed and rhesus macaques. Journal of Medical Primatology, 37(Suppl 2): 13-23.
Pullium JK, Adams DR, Jackson E, Kim CN, Smith DK, Janssen R, Gould K, Folks TM, Butera S, Otten RA. 2001. Pig-tailed macaques infected with human immunodeficiency virus (HIV) type 2GB122 or simian/HIV89. 6p express virus in semen during primary infection: new model for genital tract shedding and transmission. Journal of Infectious Diseases, 183(7): 1023-1030.Rosenblum LL, Supriatna J, Melnick DJ. 1997. Phylogeographic analysis of pigtail macaque populations (Macaca nemestrina) inferred from mitochondrial DNA. American Journal of Physical Anthropology, 104(1):35-45.
Saito A, Nomaguchi M, Iijima S, Kuroishi A, Yoshida T, Lee YJ, Hayakawa T, Kono K, Nakayama EE, Shioda T, Yasutomi Y, Adachi A, Matano T,Akari H. 2011. Improved capacity of a monkey-tropic HIV-1 derivative to replicate in cynomolgus monkeys with minimal modifications. Microbes and Infection, 13(1): 58-64.
Shehu-Xhilaga M, Kent S, Batten J, Ellis S, Van der Meulen J, O'Bryan M,Cameron PU, Lewin SR, Hedger MP. 2007. The testis and epididymis are productively infected by SIV and SHIV in juvenile macaques during the post-acute stage of infection. Retrovirology, 4(1): 7.
Shibata R, Kawamura M, Sakai H, Hayami M, Ishimoto A, Adachi A. 1991.Generation of a chimeric human and simian immunodeficiency virus infectious to monkey peripheral blood mononuclear cells. Journal of Virology, 65(7): 3514-3520.
Smith MZ, Dale CJ, de Rose R, Stratov I, Fernandez CS, Brooks AG,Weinfurter J, Krebs K, Riek C, Watkins DI, O'Connor DH, Kent SJ. 2005.Analysis of pigtail macaque major histocompatibility complex class I molecules presenting immunodominant simian immunodeficiency virus epitopes. Journal of Virology, 79(2): 684-695.
Spear GT, Kersh E, Guenthner P, Vishwanathan SA, Gilbert D, Zariffard MR, Mirmonsef P, Landay A, Zheng L, Gillevet P. 2012. Longitudinal assessment of pigtailed macaque lower genital tract microbiota by pyrosequencing reveals dissimilarity to the genital microbiota of healthy humans. AIDS Research and Human Retroviruses, 28(10): 1244-1249.
Staprans SI, Feinberg MB. 2004. The roles of nonhuman primates in the preclinical evaluation of candidate AIDS vaccines. Expert Review of Vaccines, 3(4 Suppl): S5-S32.
Stremlau M, Owens CM, Perron MJ, Kiessling M, Autissier P, Sodroski J.2004. The cytoplasmic body component TRIM5 alpha restricts HIV-1 infection in Old World monkeys. Nature, 427(6977): 848-853.
Thippeshappa R, Polacino P, Yu Kimata MT, Siwak EB, Anderson D, Wang W, Sherwood L, Arora R, Wen M, Zhou P, Hu SL, Kimata JT. 2011. Vif substitution enables persistent infection of pig-tailed macaques by human immunodeficiency virus type 1. Journal of Virology, 85(8): 3767-3779.
Uberla K, Stahl-Hennig C, Bottiger D, Matz-Rensing K, Kaup FJ, Li J,Haseltine WA, Fleckenstein B, Hunsmann G, Oberg B. 1995. Animal model for the therapy of acquired immunodeficiency syndrome with reverse transcriptase inhibitors. Proceedings of the National Academy of Sciences of the United States of America, 92(18): 8210-8214.
Ulenga NK, Sarr AD, Thakore-Meloni S, Sankale JL, Eisen G, Kanki PJ.2008. Relationship between human immunodeficiency type 1 infection and expression of human APOBEC3G and APOBEC3F. The Journal of Infectious Diseases, 198(4): 486-492.
Van Rompay KK. 2012. The use of nonhuman primate models of HIV infection for the evaluation of antiviral strategies. AIDS Research and Human Retroviruses, 28(1): 16-35.
Vishwanathan SA, Guenthner PC, Lin CY, Dobard C, Sharma S, Adams DR,
Otten RA, Heneine W, Hendry RM, McNicholl JM, Kersh EN. 2011. High susceptibility to repeated, low-dose, vaginal SHIV exposure late in the luteal phase of the menstrual cycle of pigtail macaques. Journal of Acquired Immune Deficiency Syndromes, 57(4): 261-264.
Xia HJ, Ma JP, Zhang GH, Han JB, Wang JH, Zheng YT. 2011. Effect of plasma viremia on apoptosis and immunophenotype of dendritic cells subsets in acute SIVmac239 infection of Chinese rhesus macaques. PLoS One, 6(12): e29036.
Xia HJ, Zhang GH, Ma JP, Dai ZX, Li SY, Han JB, Zheng YT. 2010.Dendritic cell subsets dynamics and cytokine productions in SIVmac239 infected Chinese rhesus macaques. Retrovirology, 7(1): 102.
Zhang GH, Li MH, Zheng YT. 2007. Application of AIDS macaques animal model in HIV vaccine research. Zoological Research, 28(5): 556-562. [张高红, 李明华, 郑永唐. 2007. AIDS 猕猴模型在 HIV疫苗研究中的应用.动物学研究, 28(5): 556-562.]
Zhou DY, Zhang X, Li WH, Xu XN, Goonetilleke N, Yang HB, Dong T,Yan HP. 2013. Broader T cell responses directed against human immunodeficiency virus type 1 in infected Chinese individuals through blood-borne transmission in comparison with mucosal transmission. AIDS Research and Human Retroviruses, 29(1): 89-93.
Zhu L, Zhang GH, Zheng YT. 2010. Application studies of animal models in evaluating safety and efficacy of HIV-1 microbicides. Zoological Research,31(1): 66-76. [朱林, 张高红, 郑永唐. 2010. 动物模型在HIV-1杀微生物剂有效性和安全性评价中的应用. 动物学研究, 31(1): 66-76.]
- Zoological Research的其它文章
- Characterization of 12 polymorphic microsatellite markers in the Chinese tree shrew (Tupaia belangeri chinensis)
- Comparative systems biology between human and animal models based on next-generation sequencing methods
- Visuospatial properties of caudal area 7b in Macaca fascicularis
- Social rank and cortisol among female rhesus macaques (Macaca mulatta)
- 昆明动物研究所离子通道药物研发中心暑期培训通知
- 树鼩解剖数据的测定与分析

