手性糖基锌卟啉对手性氨基酸甲酯的分子识别
杨乐乐 刘 佳 李 悦 刘 坤 阮文娟
(南开大学化学学院,天津300071)
1 引言
卟啉及金属卟啉是一类广泛存在于自然界中的具有重要生物功能的配合物,如细胞色素、血红素、叶绿素1等均是金属卟啉配合物.除了Na、K、Li离子与卟啉的配位比为2:1外,几乎所有的金属离子与卟啉均为1:1配位.通常Ni(II)、Cu(II)与卟啉配位后,会降低配合物对其他配位体的结合能力,而Mg(II)、Cd(II)和Zn(II)与卟啉生成的配合物则更易与另一配位体结合,从而形成五配位的四方锥结构.Fe(II)、Co(II)和Mn(II)等金属卟啉配合物则易与两个配位体配位后形成扭曲的八面体结构.金属卟啉所具有的特殊光电性质,常被作为识别反应中的传感器,2,3在电子转移4和分子识别5,6等诸多研究领域受到广泛关注.
卟啉及其金属配合物是进行手性分子识别研究的非常具有吸引力的主体化合物,其独特的光谱性质,如核磁共振氢谱(1H NMR),紫外-可见(UVVis)光谱和圆二色(CD)光谱等可以方便地用于检测主客体之间的分子识别行为.如近年来以手性金属卟啉为主体研究其对手性氨基酸(酯)客体的分子识别行为多采用谱学方法进行.7,8金属卟啉的中心金属离子和卟啉环外修饰的各种功能基团因在分子识别中的重要作用而备受关注,其中锌卟啉是一类最常用的主体化合物.9
在过去的十年中,对以手性葡萄糖修饰的卟啉(糖基卟啉)研究有了较快的发展,研究的领域主要集中在催化氧化以及对肿瘤的光动力治疗等方面.糖基金属卟啉是一类特殊的手性卟啉,利用其手性识别作用和良好的催化性能,可开发具有高度立体选择性的不对称合成反应.Maillard等10将葡萄糖氧代四苯基卟啉应用于催化p-氯苯乙烯的环氧化反应,研究结果表明该类金属卟啉配合物对p-氯苯乙烯的催化环氧化具有较高的构型选择性和较高的收率.Couleaud等11报道了一种可作为光敏剂使用的葡萄糖基卟啉,该卟啉因含有共轭大π键及乙炔基等而具有较好的光电性质.到目前为止,对糖基卟啉的研究多侧重于其合成和分离方法等方面,12,13对其性能的研究尚未深入.因此,以糖基金属卟啉为主体,研究其分子识别功能,探讨主、客体之间的相互作用具有重要意义.
本文合成了一系列手性葡萄糖修饰的四糖基和单糖基锌卟啉配合物,采用可见(Vis)光谱和CD光谱滴定法研究了各手性糖基锌卟啉主体对一系列L/D型氨基酸甲酯类客体分子的手性识别行为.同时,以咪唑为探针分子探讨了非手性分子对Zn-A阻转异构体构象的影响.
2 实验部分
2.1 仪器、试剂与实验条件
Shimadzu UV-2450紫外-可见分光光度计(日本Shimadzu公司生产);JASCO-715型圆二色光谱仪(日本分光公司),狭缝宽度:2 nm,1 cm×1 cm石英比色皿;Mercury VX 400 MHz核磁共振仪((美国Varian公司生产),CDCl3为溶剂,四甲基硅烷(TMS)为内标;TRACE DSQ型质谱仪(美国Thermofinnigan公司生产).
吡咯、三乙胺、三氯甲烷均为分析纯试剂,使用前按试剂手册13方法处理,各L/D型氨基酸为生物纯试剂,可直接使用.
2.2合成
手性糖基卟啉及其锌金属卟啉的合成路线见示意图1和2.
2.2.1 手性糖基锌卟啉配合物的合成
在1000 mL的三颈烧瓶中加入200 mL的CH2Cl2,同时用氩气鼓吹溶液30 min,随后依次加入2.5 mmol新蒸吡咯的CH2Cl2(25 mL)溶液及2.5 mmol邻-(2,3,4,6-四乙酰基D-葡萄糖基)-水杨醛14的CH2Cl2(25 mL)溶液,在机械搅拌的同时向混合溶液中加入100µL的三氟化硼(0.5 mmol)乙醚溶液,继续用氩气再鼓吹10 min,停止氩气后将混合液在室温下反应20 h.随后向反应液中加入1.85 mmol的二氯二氰基苯醌(DDQ).微回流1 h后,向黑色的反应液中加入约10 g的硅胶,旋转蒸发浓缩.以VCH2Cl2:VCH3OH=15:1(体积比,下同)的混合液为洗脱剂,用200−300目的硅胶柱分离提纯,收集黑色带.再以VCH2Cl2:VCH3OH=90:1的混合液为洗脱剂,进行二次硅胶柱分离提纯,收集主色带,得紫色固体产物5,10,15,20-四[2-(2,3,4,6-四乙酰基葡萄糖基)-苯基]卟啉(A),15产率约为6%.
用上述方法合成的5,10,15,20-四[2-(2,3,4,6−四乙酰基D−葡萄糖基)−苯基]卟啉A是四种阻转异构体(αβαβ-A、ααββ-A、αααβ-A和αααα-A)的混合物.以VCH2Cl2:VCH3OH=100:1的混合液为洗脱剂进行硅胶柱色谱分离.待分出第一组分(αβαβ-A)后,极性溶剂比例增加,为VCH2Cl2:VCH3OH=90:1.淋洗分离出第二组分(ααββ-A)后,改用VCH2Cl2:VCH3OH=75:1淋洗,分离第三组分(αααβ-A)和第四组分(αααα-A,极少量).
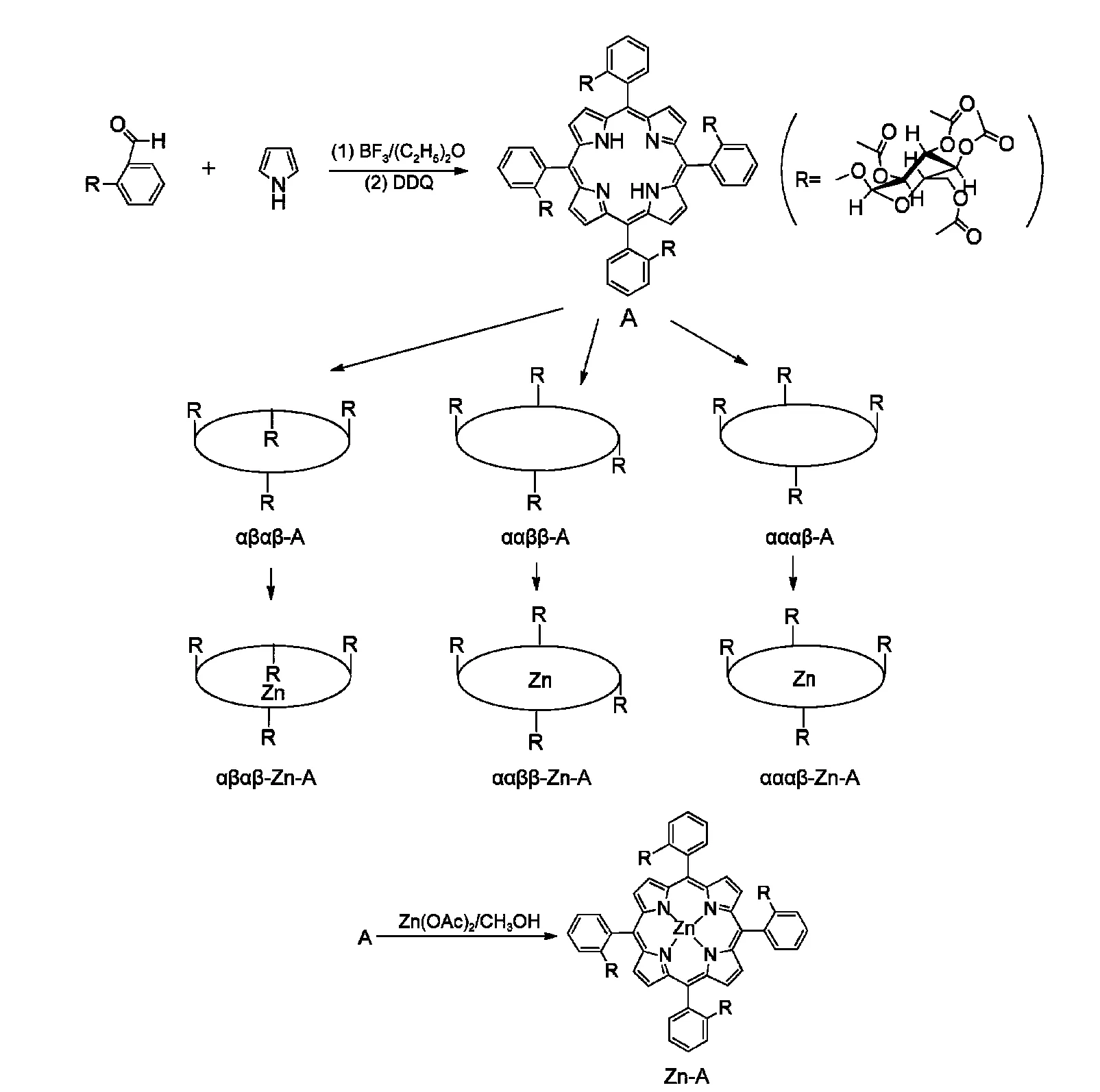
示意图1 手性糖基卟啉A及其锌卟啉Zn-A的合成路线Scheme 1 Synthesis route of tetra-glycoconjugated porphyrinsAand their zinc complexes Zn-A

示意图2 糖基卟啉B及其锌卟啉Zn-B的合成路线Scheme 2 Synthesis route of mono-glycoconjugated porphyrin B and its zinc complex Zn-B
以ααββ-A为例,合成相应锌卟啉Zn-A的方法如下:将0.05 mmol的ααββ-A溶于50 mL CHCl3,加入乙酸锌的甲醇饱和溶液10 mL,回流2 h.水洗、干燥、蒸去溶剂.粗产品以VCH2Cl2:VCH3OH=100:1为洗脱剂,用硅胶柱分离提纯,收集主色带,得桃红色固体ααββ-Zn-A.16
采用类似方法,以卟啉B17为原料,得桃红色的固体Zn-B.
(1) αβαβ-5,10,15,20-四[2-(2,3,4,6-四乙酰基葡萄糖基)-苯基]卟啉锌 (αβαβ-Zn-A,产率 55%).1H NMR δ:8.75(s,4H,pyrrole),8.60(s,4H,pyrrole),7.84(d,J=8 Hz,4H,phenyl),7.73(d,J=8 Hz,4H,phenyl),7.57(d,J=8 Hz,4H,phenyl),7.39(d,J=8 Hz,4H,phenyl),5.02−3.78(m,24H,ose),2.16−1.31(m,36H,acetyl),−0.58(s,12H,acetyl);UV-Vis(CHCl3):λmax/nm/(10−5ε/(mol−1· dm3·cm−1)):424(1.06),516(0.02),555(0.06),590(0.02);电喷雾电离质谱(ESI-MS),m/z:2061.52(100%,[M+H+]),计算值:M=2060.52.
(2) ααββ-5,10,15,20-四[2-(2,3,4,6-四乙酰基葡萄糖基)-苯基]卟啉锌(ααββ-Zn-A,产率 40%).1H NMR δ:8.84−8.62(dd,J1=40 Hz,J2=32 Hz,8H,pyrrole),7.89−7.42(m,16H,phenyl),5.57−3.81(m,24H,ose),2.19−1.30(m,45H,acetyl),−0.9(s,3H,acetyl);UV-Vis(CHCl3):λmax/nm/(10−5ε/(mol−1·dm3·cm−1)):424(1.77),515(0.02),558(0.08),594(0.02).ESI-MS,m/z:2061.52(100%,[M+H+]),计算值:M=2060.52.
(3)αααβ-5,10,15,20-四[2-(2,3,4,6-四乙酰基葡萄糖基)-苯基]卟啉锌(αααβ-Zn-A,产率 70%).1H NMR δ:8.75−8.58(m,8H,pyrrole),7.74−7.32(m,16H,phenyl),5.49−4.02(m,24H,ose),2.17−1.29(m,48H,acetyl);UV-Vis(CHCl3): λmax/nm/(10−5ε/(mol−1·dm3·cm−1)):425(1.67),516(0.01),556(0.08),594(0.01).ESI-MS,m/z:2061.52(100%,[M+H+]),计算值:M=2060.52.
(4)5-[2-(2,3,4,6-四乙酰基葡萄糖基)-苯基]卟啉锌 (Zn-B,产率40%).1H NMR δ:8.88−8.76(m,8H,pyrrole),8.32−7.44(m,16H,phenyl),4.95−3.56(m,28H,ose),1.94−0.87(m,48H,acetyl);UV-Vis(CHCl3):λmax/nm/(10−5ε/(mol−1·dm3·cm−1)):420(2.49),512(0.02),549(0.13),591(0.02);ESI-MS,m/z:1023.2(100%,[M+H+]),计算值:M=1022.25.
2.2.2 氨基酸甲酯的合成
L/D-亮氨酸甲酯(L/D-LeuOMe)、L/D-苏氨酸甲酯(L/D-ThrOMe)、L/D-缬氨酸甲酯(L/D-ValOMe)、L/D-苯丙氨酸甲酯(L/D-PheOMe)按照文献18,19报道方法合成,经质谱(MS)和1H NMR验证.氨基酸甲酯结构图见示意图3.
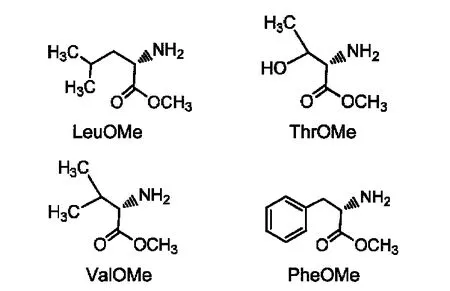
示意图3L/D-亮氨酸甲酯、L/D-苏氨酸甲酯、L/D-缬氨酸甲酯和L/D-苯丙氨酸甲酯的结构图Scheme 3 Sturctures of L/D-LeuOM,L/D-ThrOMe,L/D-ValOMe,and L/D-PheOMe
2.3 实验原理及方法
主体与客体间缔合常数K的测定采用紫外-可见光谱滴定法,体系中主客体缔合物的形成过程可表示为

式(1)中P为主体糖基锌卟啉,G为客体,则:

根据朗伯-比尔定律推导20可得:
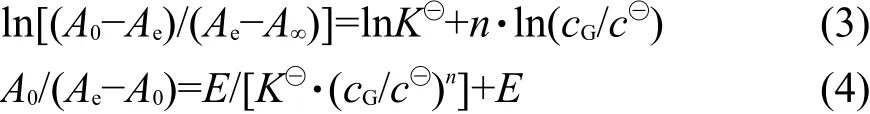
配制一系列主体锌卟啉浓度(2.0×10−5mol·dm−3)相同但客体浓度(10−3− 1.0 mol·dm−3)不同的CHCl3溶液,避光放置一夜,使主客体间能够充分反应(在制备的过程中可以发现,当在锌卟啉溶液中加入客体时,溶液颜色会立刻变色,说明主客体反应速度较快).实验使用紫外-可见分光光度计,分别在10、17、23和30°C下测定一定波长下各手性锌卟啉-氨基酸甲酯体系的平衡吸光度值.根据式(3),以ln[ ]
(A0-Ae)/(Ae-A∞)对ln(cG/c⊖)作线性回归,由直线的斜率可得n值.因为测定反应完全时的A∞易产生误差,为消除A∞的影响,在确定n后,可采用式(4),以A0/(Ae−A0)对1/(cG/c⊖)n作线性回归,即可求出缔合常数K⊖.热力学参数ΔrH⊖m、ΔrS⊖m可由vanʹt Hoff方程(5)计算得到.

2.4 圆二色光谱
配制各主体手性糖基锌卟啉溶液的浓度为2.0×10−5mol·dm−3,将不同浓度的手性LeuOMe、ThrOMe、ValOMe、PheOMe和咪唑类客体分别加入到αβαβ-Zn-A、αααβ-Zn-A等主体溶液中,并记录各体系平衡时的CD光谱.
3 结果与讨论

图1 主体αβαβ-Zn-A与L-ValOMe体系的等吸光点图Fig.1 Isosbestic point of host αβαβ-Zn-Awith L-ValOMe
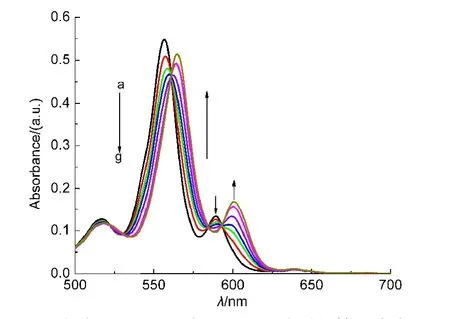
图2 主体αβαβ-Zn-A与2-MeIm体系的等吸光点图Fig.2 Isosbestic point of host αβαβ-Zn-Awith 2-MeIm
典型的手性糖基锌卟啉对氨基酸甲酯类客体和咪唑类客体反应的等吸光点图如图1、2所示.以图1为例,可以看出,随着客体L-ValOMe浓度的逐渐增加,图中555、590 nm处的吸收峰逐渐降低,561、599 nm处出现新的吸收峰,在560、582和593 nm处则有非常清晰的等吸光点.这种谱图的变化反映了主体化合物逐渐消失,新生成的缔合物逐步增加的过程.根据Gouterman的四轨道模型,21当锌卟啉的中心离子Zn(II)与L-ValOMe发生相互作用时,客体分子的电荷通过锌离子向卟啉环转移,形成更大的π电子共轭体系,同时电子占据轨道a2u(π)的能量提高,因此a2u(π)−eg(π*)跃迁的能级差减小,激发能降低,跃迁吸收谱带明显向长波方向移动,即图中555、590 nm处的谱带分别移向561、599 nm处,即发生红移.
3.1 手性糖基锌卟啉对氨基酸甲酯类客体的识别研究
3.1.1 热力学结果
根据2.3节中的式(3),确定了该主客体体系识别反应的化学计量比为1:1.各种Zn-A的阻转异构体及Zn-B与L-、D-氨基酸甲酯类客体识别反应的热力学数据见表1.表1中各识别体系的缔合常数只代表性的给出了10°C下的数据,热力学参数ΔrH⊖m、ΔrS⊖m根据10、17、23及30 °C四个温度下的缔合常数计算得到,相关系数r的范围为0.985<r<0.998.
从表1数据可知,ΔrH⊖m<0,说明该识别反应为放热反应,温度增加不利于反应的进行,缔合常数降低.而识别反应的ΔrS⊖m<0则说明主客体的缔合使体系的熵减小,混乱度降低.
相对于卟啉环周边只含有一个糖基取代基的主体配合物Zn-B而言,Zn-A的各异构体由于在各自卟啉环周边均含有四个糖基取代基,所以其空间位阻远大于Zn-B,因此Zn-A、Zn-B与手性氨基酸甲酯的缔合常数顺序为K⊖(Zn-A)<K⊖(Zn-B).
主 体 Zn-A 的 各 阻 转 异 构 体 αααβ-Zn-A、αβαβ-Zn-A和ααββ-Zn-A对氨基酸甲酯的缔合常数顺序主要受控于空间位阻效应和电子效应.22如客体PheOMe与Zn-A的各阻转异构体缔合时,主、客体的空间位阻均较大,因此Zn-A各阻转异构体与PheOMe的缔合能力最弱.对于脂肪族氨基酸酯客体,LeuOMe的烷基链长大于ValOMe和ThrOMe,供电子能力最强,缔合常数就最大;客体ValOMe与ThrOMe相比,由于两者的电子效应ValOMe>ThrOMe,而空间效应相差不大,所以在不同温度下,各阻转异构体的Zn-A与氨基酸甲酯的缔合常数间的关系为K⊖(LeuOMe)>K⊖(ValOMe)>K⊖(ThrOMe)>K⊖(PheOMe).
主体Zn-A的各阻转异构体与同一客体的缔合常数顺序为 K⊖(ααββ-Zn-A)>K⊖(αβαβ-Zn-A)>K⊖(αααβ-Zn-A),显然是主体的空间效应起了主导作用,因为各阻转异构体的Zn-A空间位阻顺序为:αααβ-Zn-A>αβαβ-Zn-A>ααββ-Zn-A.当客体与卟啉环中心的锌离子接近时,所需克服的位阻越大,缔合常数就越小.
L型和D型各氨基酸甲酯客体与Zn-B的缔合常数顺序表现为K⊖(PheOMe)>K⊖(LeuOMe)>K⊖(ValOMe)>K⊖(ThrOMe).当PheOMe与Zn-B缔合时,除了PheOMe中的氮原子与主体卟啉中心的锌离子配位作用外,还有PheOMe中的苯环与Zn-B的共轭大π体系间产生的π−π相互作用,此时的静电作用大于客体进攻主体时所需克服的空间位阻,因此PheOMe与Zn-B的结合能力最强.Zn-B与其它三类氨基酸甲酯的缔合常数,由于受电子效应和空间效应的影响,呈现出与Zn-A-氨基酸甲酯体系相同的规律,即K⊖(LeuOMe)>K⊖(ValOMe)>K⊖(ThrOMe).

表1 主体Zn-A、Zn-B与L/D型氨基酸甲酯类客体识别反应的热力学数据Table 1 Thermodynamic data for the recognition reactions of Zn-A,Zn-B,and L/D-amino acid methyl esters
3.1.2 对映选择性
对映选择性是手性主体对对映体客体选择性识别能力一个评判标准,3其定义为主体与一对对映体客体缔合常数的比值,即KL/KD或KD/KL,通常取两者之中大于1的数值.
本文所研究的各手性主体锌卟啉对L型氨基酸甲酯的缔合常数均大于对D型氨基酸甲酯的缔合常数.其中,主体ααββ-Zn-A对L型氨基酸甲酯的缔合常数比对D型氨基酸甲酯的缔合常数有明显的差异(见表2),如对ValOMe的对映选择性KL/KD值为4.75,说明ααββ-Zn-A对L型氨基酸甲酯有较好的选择性识别.图3为30 °C时ααββ-Zn-A对各L-、D-氨基酸甲酯选择性识别的示意图.
3.1.3 手性糖基卟啉与手性氨基酸甲酯识别体系的CD光谱
手性糖基卟啉与手性氨基酸甲酯识别体系的典型的CD光谱如图4所示.
图4是在相同浓度的主体αβαβ-Zn-A中分别加入等量的D/L-ValOMe所得的CD光谱.从图中可以看出,当加入D-ValOMe后,体系在418 nm处出现负的Cotton效应;而加入L-ValOMe后,在425 nm处出现正的Cotton效应,这是由于氨基酸甲酯上羰基的过渡态偶极与卟啉环的过渡态偶极(π−π*跃迁)之间的耦合作用所致.23卟啉环与氨基酸甲酯羰基这两个生色团在过渡态的能量和性质以及手性等方面的差异,导致生色基团之间的耦合作用不同,得到的CD光谱就不同.24同一对氨基酸甲酯具有相反的手性,极化方向相反,得到的CD光谱表现出较好的对称性.因此,主体αβαβ-Zn-A与L-ValOMe缔合后,主体原有的空间构象没有发生相应的变化;而主体αβαβ-Zn-A与客体D-ValOMe缔合后,主体分子原有的空间构象发生了相应的变化.

表2 主体αβαβ-Zn-A与L/D-氨基酸甲酯客体识别反应的缔合常数Table 2 Binding constants for the recognition reactions of αβαβ-Zn-Aand L/D-amino acid methyl esters
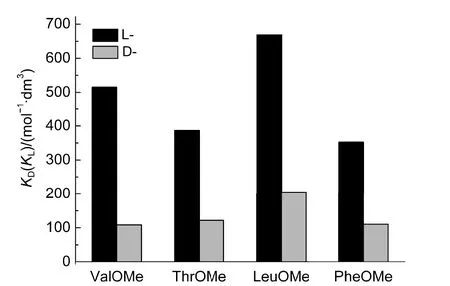
图3 30°C时主体αβαβ-Zn-A对各种L/D-氨基酸甲酯的缔合常数Fig.3 Binding constants of αβαβ-Zn-Ato different L/D-amino acid methyl esters at 30°C
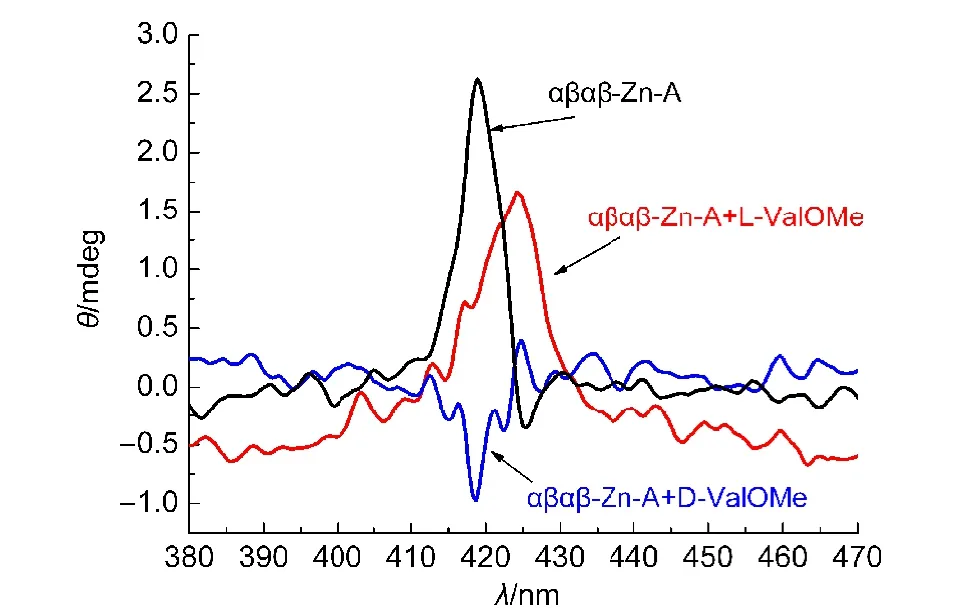
图4 主体αβαβ-Zn-A与L/D-ValOMe识别体系的CD谱图Fig.4 CD spectra of host αβαβ-Zn-Aand L/D-ValOMe
3.2 糖基锌卟啉对咪唑类客体的缔合反应研究
3.2.1 热力学结果
实验结果表明,主体Zn-A及Zn-B与咪唑(Im)、2-甲基咪唑(2-MeIm)、N-甲基咪唑(N-MeIm)及 2-乙基-4-甲基咪唑(2-Et-4-MeIm)的缔合反应的化学计量比为1:1.主客体体系的热力学数据列于表3,表中只代表性的给出了10°C下的缔合常数.
表3中ΔrH⊖m,ΔrS⊖m均为负值说明该反应为放热、熵减小过程.温度降低,体系的缔合常数K⊖增大.熵减小,体系的混乱度降低.
分析数据可知,主体Zn-A,Zn-B与咪唑类客体发生的缔合反应,受电子效应和空间位阻的影响,其缔合常数顺序为K⊖(Im)>K⊖(2-MeIm)>K⊖(NMeIm)>K⊖(2-Et-4-MeIm).Im 和 2-MeIm 相比较,2-MeIm邻位甲基的供电子作用使其电子效应较高,与主体的缔合能力较强.而咪唑环上同一位置上的取代基团体积越大,主客体缔合时的空间阻碍就越大,排斥作用就越大,25即Im的空间位阻小于2-MeIm.但由于主体本身也具有较大的取代基团使得主客体缔合时空间位阻效应大于电子效应的影响,故缔合常数顺序为K⊖(Im)>K⊖(2-MeIm);对于2-MeIm和N-MeIm,两者的电子效应2-MeIm>N-MeIm,而空间位阻相差不大,故K⊖(2-MeIm)>K⊖(N-MeIm);而2-Et-4-MeIm的空间位阻效应远大于其他客体,因此其缔合常数最小.
由于Zn-A具有比Zn-B大得多的空间位阻效应,因此Zn-B与咪唑类客体的缔合常数较高,即:K⊖(Zn-B)>K⊖(Zn-A).Zn-A的各阻转异构体与同一客体反应的缔合常数顺序为:K⊖(ααββ-Zn-A)>K⊖(αβαβ-Zn-A)>K⊖(αααβ-Zn-A).这与各阻转异构体的Zn-A与手性氨基酸甲酯缔合体系的缔合常数顺序是一致的.
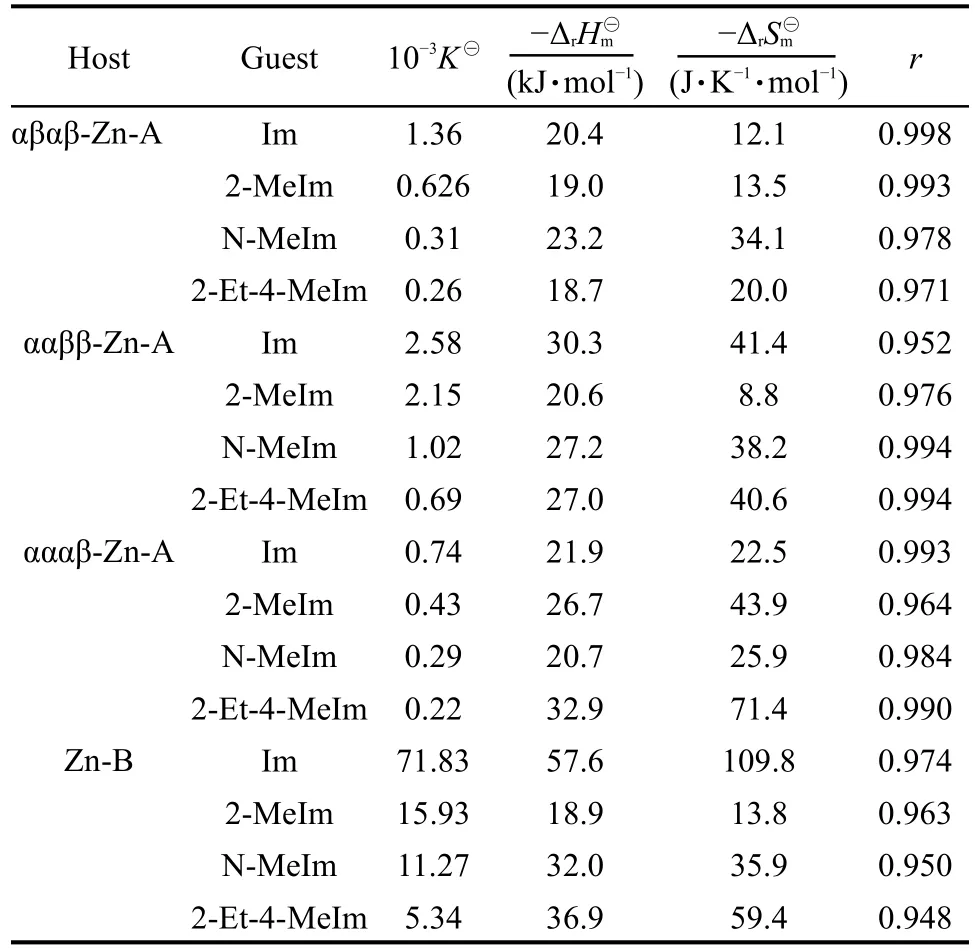
表3 主体Zn-A、Zn-B与咪唑类客体体系的热力学数据Table 3 Thermodynamic data for the reactionsof Zn-A,Zn-B,and imidazoles
3.2.2 手性糖基卟啉与咪唑类客体缔合体系的CD光谱
图5为主体αβαβ-Zn-A和αααβ-Zn-A分别与咪唑体系的CD谱图及相应紫外可见谱图的变化.
从图5(A)的CD谱图可以看出,主体αβαβ-Zn-A在419 nm处出现正的Cotton效应,在425 nm处出现负的Cotton效应.对应所给出的紫外光谱图,主体αβαβ-Zn-A在420 nm处出现最大吸收峰.逐步增加体系中咪唑的浓度时,体系的正、负Cotton效应峰不断向长波方向移动,并且正Cotton效应的信号强度逐渐减弱,负Cotton效应信号逐渐增强,最后分别在423、430 nm处呈现出一对正、负Cotton效应峰.参照对应的可见光谱可以看出,随着咪唑浓度的增加,体系的最大吸收峰发生了红移,在427 nm处出现新的吸收峰.当加入的咪唑为主体αβαβ-Zn-A的4000倍时,体系在427 nm处的吸收峰强度不再发生变化,说明主体全部转化为缔合物.因此,CD谱图中423、430 nm处呈现的一对正、负Cotton效应峰为所形成缔合物的CD信号.这也说明咪唑虽为非手性分子,但其与手性主体结合后,也可对主体的构象产生影响.
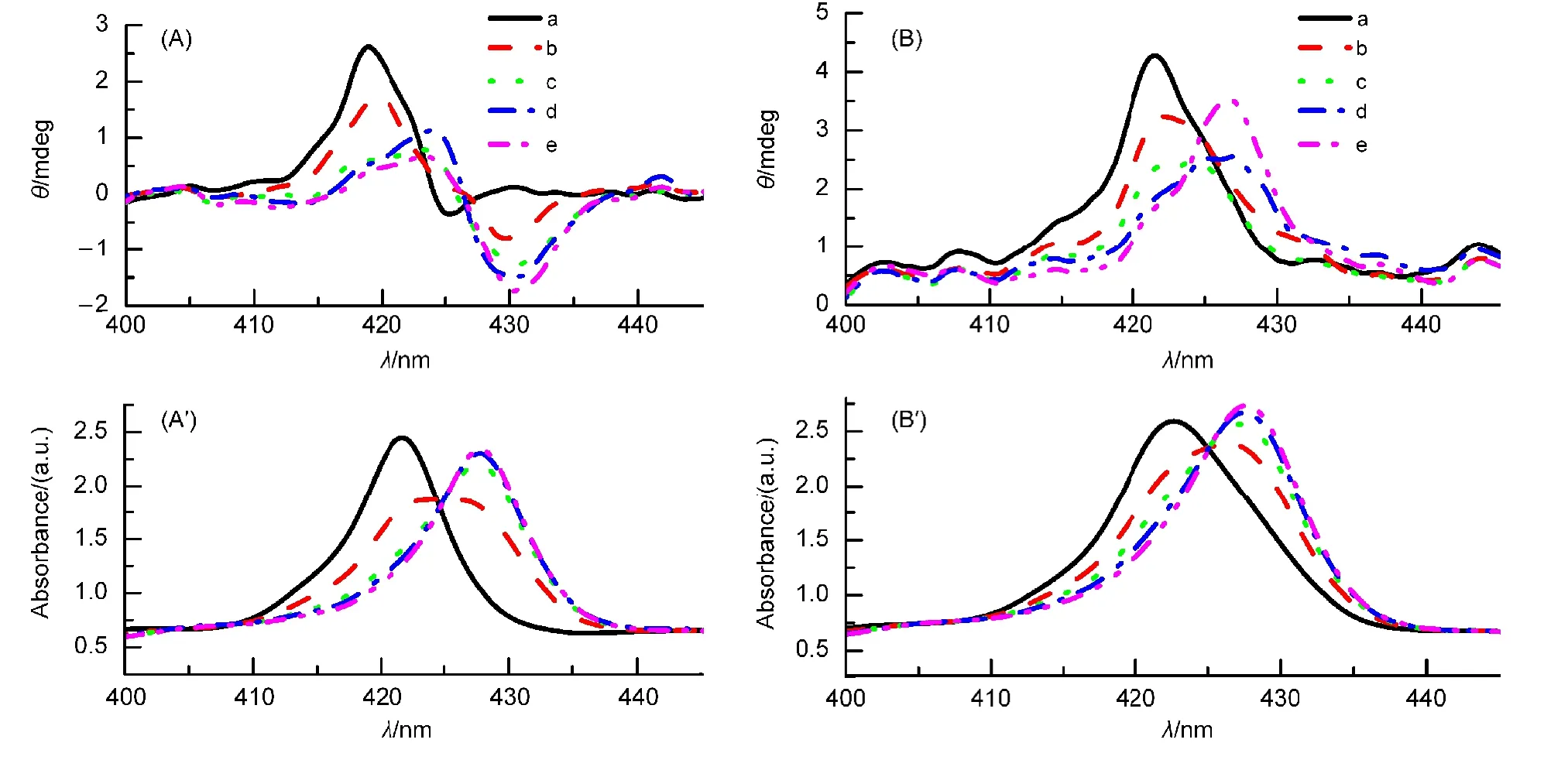
图5 不同浓度的Im与主体αβαβ-Zn-A体系(A,Aʹ)、αααβ-Zn-A体系(B,Bʹ)的CD(A,B)及相应的可见(Aʹ,Bʹ)光谱图Fig.5 CD(A,B)and Vis(Aʹ,Bʹ)spectra of host αβαβ-Zn-A(A,Aʹ)and αααβ-Zn-A(B,Bʹ)with different concentrations of Im
从图5(B)的CD谱图可以看出,主体αααβ-Zn-A只在421 nm处出现正的Cotton效应.当逐步增加客体咪唑浓度时,体系的Cotton效应峰发生红移,在427 nm处出现新的正Cotton效应,且强度减弱.参照对应的可见光谱可以看出,咪唑浓度的增加使得体系的最大吸收峰发生了红移,当加入的咪唑浓度为主体αααβ-Zn-A的4000倍时,体系在427 nm处的新的吸收峰强度不再发生变化,表明主客体全部反应生成缔合物.因此,CD谱图中427 nm处呈现的正Cotton效应为所形成的缔合物的CD信号.
4 结论
以四种糖基取代的锌卟啉化合物主体对氨基酸甲酯的手性识别性能的研究表明,四种糖基取代的锌卟啉化合物对L-型氨基酸甲酯的缔合常数均高于D型.其中ααββ-Zn-A对不同构型的氨基酸甲酯缔合常数差异最大,对映体选择性KL/KD最高可达4.75.以咪唑类分子为探针所研究的非手性分子对糖基取代的锌卟啉化合物构象的影响发现,非手性分子与手性主体结合后也可对主体的构象产生影响.
(1) Berzin,B.D.Coordination Compounds of Porphyrins and Phthalocyanines;Wiley:New York,1981;p 4.
(2) Mizutani,T.;Ema,T.;Yoshida,T.;Kuroda,Y.;Ogoshi,H.Inorg.Chem.1993,32(10),2072.doi:10.1021/ic00062a032
(3) Mizutani,T.;Ema,T.;Tomita,T.;Kuroda,Y.;Ogoshi,H.J.Am.Chem.Soc.1994,116(10),4240.doi:10.1021/ja00089a013
(4) Collman,J.P.;Rapta,M.;Bröring,M.;Raptova,L.;Schwenninger,R.;Boitrel,B.;Fu,L.;L'Her,M.J.Am.Chem.Soc.1999,121(6),1387.doi:10.1021/ja983351a
(5) Liu,Y.;Li,B.;Wada,T.;Inoue,Y.Tetrahedron 2001,57(33),7153.doi:10.1016/S0040-4020(01)00671-8
(6) Mizuno,Y.;Aida,T.;Yamaguchi,K.J.Am.Chem.Soc.2000,122(22),5278.doi:10.1021/ja000052o
(7) Collman,J.P.;Gagne,R.R.;Reed,C.;Halbert,T.R.;Lang,G.;Robinson,W.T.J.Am.Chem.Soc.1975,97(6),1427.doi:10.1021/ja00839a026
(8) Laville,I.;Pigaglio,S.;Blais,J.C.;Doz,F.;Loock,B.;Maillard,P.;Grierson,D.S.;Blais,J.J.Med.Chem.2006,49(8),2558.
(9)Wang,C.Z.;Zhu,Z.A.;Li,Y.;Chen,Y.T.;Wen,X.;Miao,F.M.;Chan,W.L.;Chan,A.S.C.New J.Chem.2001,25(6),801.doi:10.1039/b100942g
(10) Maillard,P.;Guerquin-Kern,J.L.;Momenteau,M.Tetrahedron Lett.1991,32(37),4901.doi:10.1016/S0040-4039(00)93491-9
(11) Achelle,S.;Couleaud,P.;Baldeck,P.;Teulade-Fichou,M.P.;Maillard,P.Eur.J.Org.Chem.2011,2011(7),1271.doi:10.1002/ejoc.v2011.7
(12) Li,C.;Wong,W.T.Tetrahedron Lett.2002,43(17),3217.doi:10.1016/S0040-4039(02)00497-5
(13) Perrin,D.D.;Armarego,W.L.F.;Perrin,D.R.Purification of Laboratory Chemicals,2nd ed.;Industry Press:Beijing,1987;p 126;translated by Shi,Y.[Perrin,D.D.;Armarego,W.L.F.;Perrin,D.R.实验室化学药品的提纯方法,第二版.时 雨,译.北京:化学工业出版社,1987:126.]
(14) Maillard,P.;Guerquin-Kern,J.L.;Huel,C.;Momenteau,M.J.Am.Chem.Soc.1993,58(10),2774.
(15) Maillard,P.;Vilain,S.;Huel,C.;Momenteau,M.J.Am.Chem.Soc.1994,59(10),2887.
(16) (a)Oulmi,D.;Maillard,P.;Guerquin-Kern,J.L.;Huel,C.;Momenteau,M.J.Am.Chem.Soc.1995,60(6),1554.(b)Zhang,X.H.;Jiao,Z.;Yan,W.W.;Ruan,W.J.;Zhu,Z.A.Acta Phys.-Chim.Sin.2010,26(3),701. [张晓红,矫 志,闫伟伟,阮文娟,朱志昂.物理化学学报,2010,26(3),701.]doi:10.3866/PKU.WHXB20100306
(17) Tomé,J.P.C.;Neves,M.G.P.M.S.;Tomé,A.C.;Cavaleiro,J.A.S.;Mendonca,A.F.;Pegado,I.N.;Duarte,R.;Valdeira,M.L.Bioorg.Med.Chem.2005,13(12),3878.doi:10.1016/j.bmc.2005.04.015
(18) Liang,Q.F.;Liu,J.J.;Chen,J.Tetrahedron Lett.2011,52(31),3987.doi:10.1016/j.tetlet.2011.05.081
(19) Zhou,Y.;Zhao,M.;Wu,Y.;Li,C.;Wu,J.;Zheng,M.;Peng,L.;Peng,S.Bioorg.Med.Chem.2010,18(6),2165.doi:10.1016/j.bmc.2010.01.075
(20) Ruan,W.J.;Liu,T.;Zhu,Z.A.Acta.Chim.Sin.2003,61,1000.[阮文娟,刘 涛,朱志昂.化学学报,2003,61,1000.]
(21) (a)Gouterman,M.J.Am.Chem.Soc.1959,30(5),1139.(b)Nappa,M.;Valentine,J.S.J.Am.Chem.Soc.1978,100(16),5075.
(22) Wang,S.J.;Zang,N.;Ruan,W.J.;Zhu,Z.A.Acta Phys.-Chim.Sin.2008,24(3),507.[王树军,臧 娜,阮文娟,朱志昂.物理化学学报,2008,24(3),507.]doi:10.3866/PKU.WHXB20080328
(23) Ogoshi,H.;Mizutani,T.Accounts Chem.Res.1998,31(2),81.doi:10.1021/ar9603165
(24) Zhang,X.H.;Guo,H.R.;Jiao,Z.;Yan,W.W.;Ruan,W.J.;Zhu,Z.A.Acta Phys.-Chim.Sin.2011,27,774. [张晓红,郭洪瑞,矫 志,闫伟伟,阮文娟,朱志昂.物理化学学报,2011,27,774.]doi:10.3866/PKU.WHXB20110432
(25) Wang,S.J.;Luo,D.B.;Ruan,W.J.;Zhu,Z.A.;Ma,Y.Acta Phys.-Chim.Sin.2005,21(8),834. [王树军,罗代兵,阮文娟,朱志昂,马 毅.物理化学学报,2005,21(8),834.]doi:10.3866/PKU.WHXB20050803

