在不同营养水平日粮中添加益生菌对肉鸡抗氧化功能、黏膜免疫及回肠菌群的影响
唐志刚 温 超 王 恬 周岩民
(南京农业大学动物科技学院,南京 210095)
随着生活水平的提高,畜产品质量受到广泛关注,饲料所带来的畜产品安全越来越受到重视。为了提高畜产品质量,人们越来越倾向于无污染、无残留的饲料添加剂。作为替代抗生素的一种新型绿色添加剂,益生菌能提高家禽生产性能,使饲料利用率提高 3.9%~ 32.2%[1-2],尤其养殖环境不太理想的情况下效果更佳;同时,益生菌可调节肠道的微生态平衡,提高免疫力,增强机体对内、外环境不良刺激的抵抗能力[3]。但畜禽养殖中,益生菌的促生长、促免疫作用受诸多因素影响,应用效果差异较大。因此,全面认识微生态系统对营养代谢和免疫功能的调控作用就显得十分重要。目前,有关益生菌的试验研究大多集中于常规日粮,而在低营养水平日粮中添加益生菌对动物抗氧化功能、黏膜免疫影响的研究则鲜见报道。本试验通过在不同营养水平日粮中添加益生菌,研究其对肉鸡免疫器官指数、抗氧化功能、肠黏膜免疫及肠道菌群的影响,评估益生菌在宿主内的免疫效应并探究其机理,为研发抗生素替代品和节约饲料资源提供理论根据。
1 材料与方法
1.1 试验材料
益生菌由北京九州互联农牧有限公司提供,以枯草芽孢杆菌为主要菌种,并包含地衣芽孢杆菌和乳酸杆菌等,产品活菌总数大于1.0×1010CFU/g。
1.2 试验动物及日粮
1日龄AA肉鸡由安徽和威集团提供,试验为期42 d,其中1~21 d为试验前期,22~42 d为试验后期。试验日粮参照NRC(1994)《家禽的营养需要量》配制(表1)。
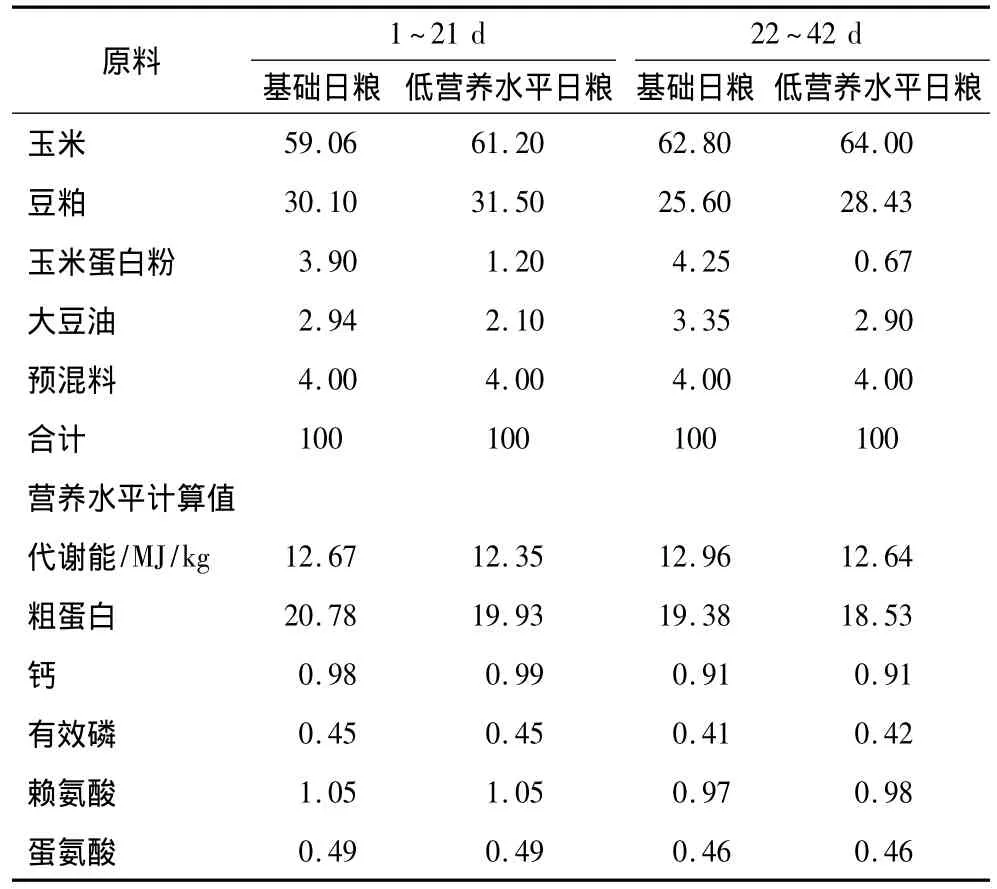
表1 日粮的组成及营养水平(风干基础)/%
1.3 试验设计与饲养管理
试验采用2×2双因素随机区组设计,选用1日龄肉鸡320只,随机分成4组,每组10个重复,每个重复8只鸡,分别饲喂以下4种日粮:
正对照组(NC):基础日粮;
负对照组(LC):低能低蛋白日粮,使基础日粮前后期的代谢能均降低320 kJ/kg,粗蛋白均降低0.85%;
试验1组(NP):基础日粮+0.01%益生菌,其日粮活菌总数大于1.0×106CFU/g;
试验2组(LP):低能低蛋白日粮+0.01%益生菌,其日粮活菌总数大于1.0×106CFU/g。
试验鸡于室内同一环境下采用层叠笼饲养,每笼为一重复,24 h光照,每天喂料2次,自由采食和饮水,以重复为单位每天记录饲料饲喂量和剩余量,每天清洗饮水器和料槽1次。免疫接种及疾病预防、消毒按常规方法进行。
1.4 样品采集与测定
在试验的第21天和第42天,每组随机选取8只中等大小的公鸡屠宰,放血致死后迅速剖开腹腔,取脾脏、胸腺、法氏囊并称重,计算各器官指数。器官指数=器官重/鸡活体重。
采集血液置于离心管中,待血清析出后,在低温离心机中以3 000 r/min离心15 min,取上清液(血清)分装,测定血清丙二醛(MDA)、总超氧化物歧化酶(T-SOD)和总抗氧化能力(T-AOC)。取十二指肠和空肠前半段,用眼科剪纵向剖开,清除表层食糜后再用载玻片刮取黏膜,将部分黏膜用4℃生理盐水10倍体积稀释后匀浆,4℃离心20 min(4 000 r/min),取上清液分装,测定黏膜匀浆液的MDA、TSOD和T-AOC。血液和肠黏膜MDA、T-SOD和T-AOC所用试剂盒由南京建成生物工程研究提供。
黏膜免疫球蛋白G(IgG)用竞争性放射免疫分析技术测定(试剂盒由潍坊三维生物工程集团有限公司所提供)。黏膜分泌性免疫球蛋白A(SIgA)采用竞争性放射免疫分析技术测定(试剂盒由原子高科股份有限公司所提供)。
1.5 肠道菌群的测定
分别于试验的第21天和第42天时,每组随机选取4只中等大小的公鸡屠宰,无菌条件下取回肠内容物0.5 g左右,用无菌生理盐水进行10倍梯度稀释;采用平板菌落计数法,大肠杆菌使用麦康凯琼脂培养基37℃有氧培养24 h后进行菌落计数;乳酸杆菌使用MRS琼脂培养基37℃有氧培养48 h后进行菌落计数,结果以每克肠道内容物中细菌个数的对数lg(CFU/g)表示。
1.6 数据处理
试验数据采用SPSS16.0软件GLM模型进行两因子方差分析,模型主效应包括日粮的营养水平(N/L)、益生菌不添加或添加(C/P)以及二者的互作,用Duncan进行多重比较,结果以“平均值±标准误”(X±SE)表示。
2 结果
2.1 不同营养水平日粮中添加益生菌对肉鸡免疫器官指数的影响
由表2可知,益生菌能极显著提高21 d肉鸡的胸腺指数(P<0.01),显著提高21 d脾脏指数和法氏囊指数(P<0.05),对42 d的脾脏指数、胸腺指数和法氏囊指数均没有显著影响(P>0.05);日粮营养水平及其与益生菌的互作对21 d和42 d的脾脏指数、胸腺指数和法氏囊指数均没有显著影响(P>0.05)。
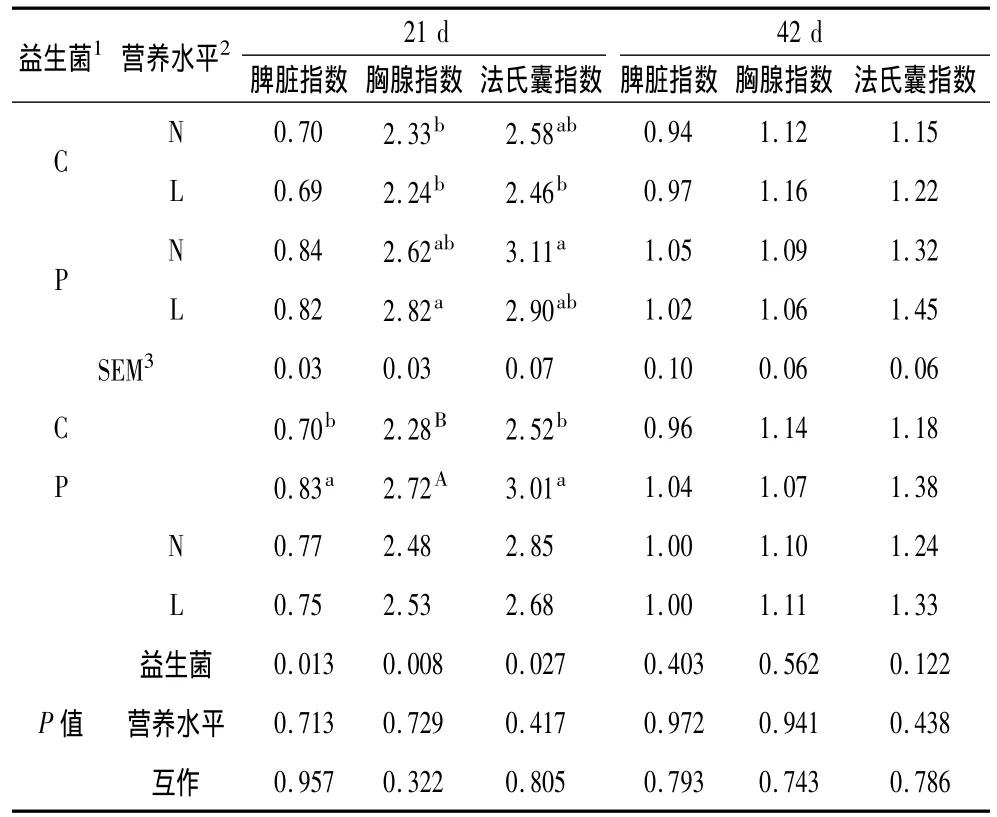
表2 不同营养水平日粮中添加益生菌对免疫器官指数的影响/g/kg
2.2 不同营养水平日粮中添加益生菌对血清抗氧化性能的影响
由表3可知,益生菌能提高肉鸡前期血清TSOD的活性(P<0.05),降低肉鸡前期血清MDA的含量(P<0.01),能提高后期血清T-SOD和 TAOC活性(P<0.01),降低后期 MDA的含量(P<0.05);日粮营养水平对血清前、后期的 T-SOD、MDA和T-AOC均无显著影响(P>0.05);益生菌和日粮营养水平的互作对血清前期抗氧化功能无显著影响(P >0.05),对后期 T -SOD(P=0.094)和T-AOC(P=0.060)有提高趋势,对后期MDA无显著改变(P >0.05)。
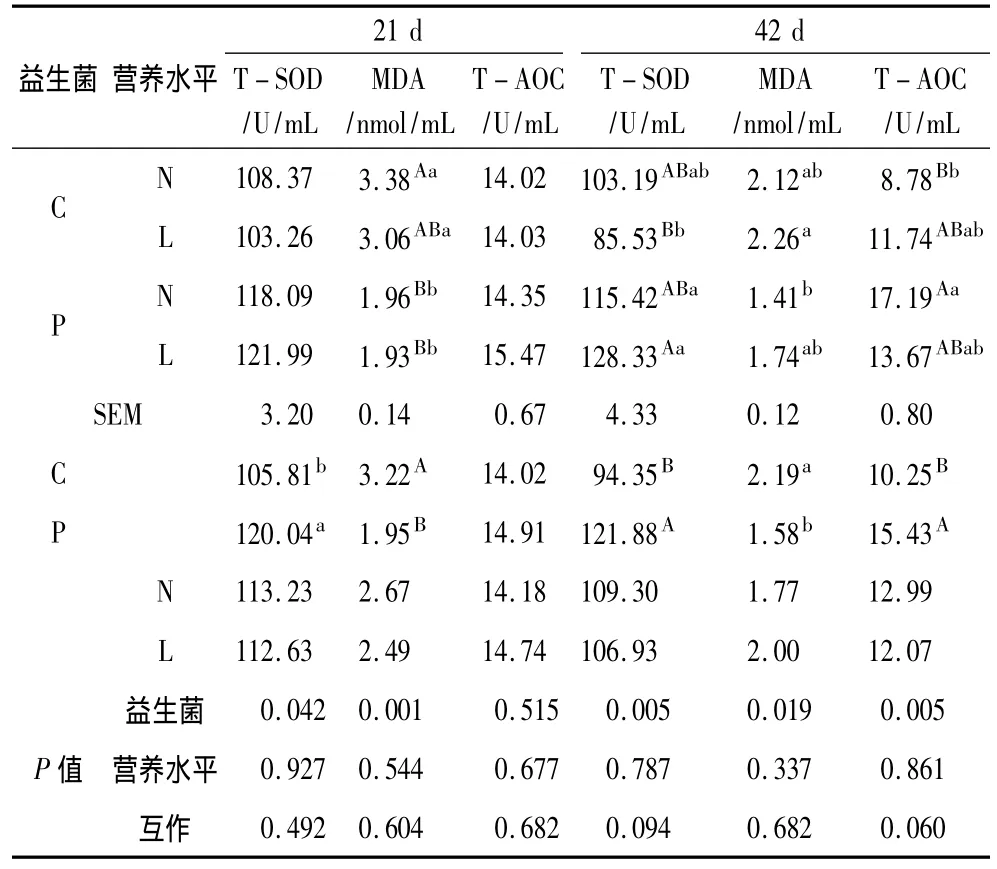
表3 不同营养水平日粮中添加益生菌对血清抗氧化功能的影响
2.3 不同营养水平日粮中添加益生菌对黏膜抗氧化性能、免疫功能的影响
由表4可知,益生菌能显著提高黏膜21 d的TSOD活性(P<0.05),对21 d黏膜MDA含量也有一定降低趋势(P=0.057),能显著降低42 d黏膜MDA含量(P<0.05),对T-SOD和T-AOC没有显著影响(P>0.05);日粮营养水平对21 d、42 d黏膜抗氧化性能没有显著影响(P>0.05);益生菌和营养水平的互作对黏膜抗氧化影响不大(P>0.05)。
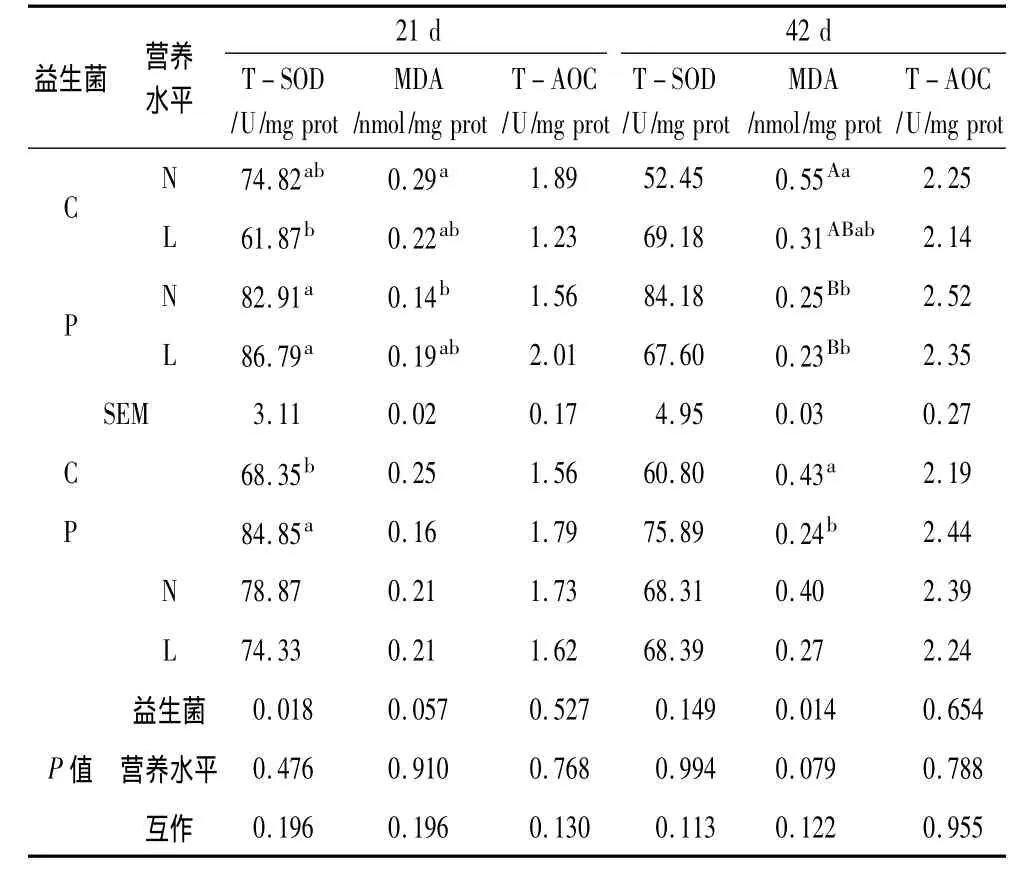
表4 不同营养水平日粮中添加益生菌对黏膜抗氧化功能的影响
益生菌对饲喂不同营养水平日粮肉鸡黏膜IgG和SIgA的影响见表5。益生菌可显著提高21 d黏膜IgG的含量(P<0.05),对21 d黏膜SIgA含量没有影响(P>0.05),显著提高42 d黏膜IgG和SIgA含量(P<0.01或P<0.05);日粮营养水平对肉鸡前后期的黏膜IgG和SIgA均没有显著影响(P>0.05)。
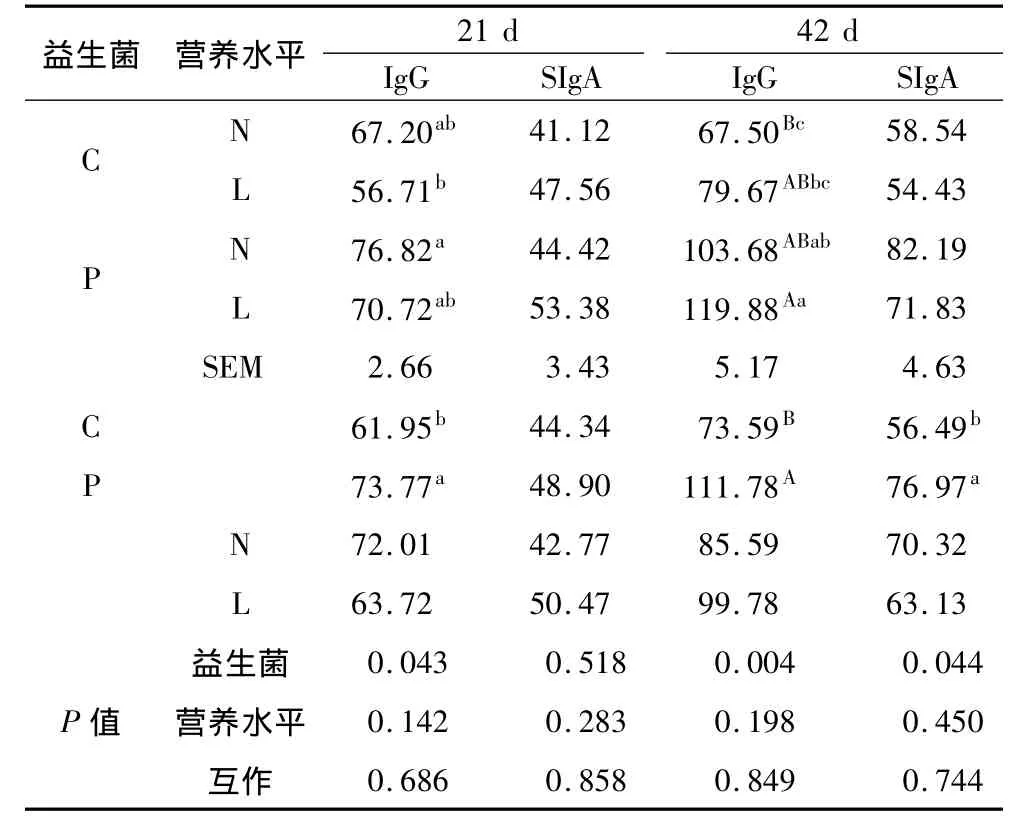
表5 不同营养水平日粮中添加益生菌对肉鸡黏膜免疫的影响/ng/mg prot
2.4 不同营养水平日粮中添加益生菌对肉鸡回肠菌群的影响
如表6所示,益生菌能降低21 d、42 d回肠大肠杆菌数量(P<0.05),提高21 d回肠乳酸杆菌的数量(P<0.001),对42 d回肠乳酸杆菌数量没有显著影响(P>0.05);日粮营养水平对21 d回肠乳酸杆菌数量有显著影响(P<0.05),对21 d大肠杆菌没有显著影响(P>0.05),对42 d大肠杆菌、乳酸杆菌数量均没有影响(P>0.05);益生菌和日粮营养水平的互作对21 d、42 d回肠菌群均没有显著影响(P>0.05)。

表6 益生菌在不同营养水平下对肉鸡肠道菌群的影响/lg(CFU/g)
3 讨论
3.1 不同营养水平日粮中添加益生菌对肉鸡免疫器官指数的影响
胸腺、法氏囊和脾脏作为肉鸡最重要的免疫器官,其发育状态和机能强弱直接影响家禽的免疫机能[4-5]。益生菌能促进胸腺、法氏囊等免疫器官的生长发育,提高动物对外界刺激和疾病的抵抗力[6]。赵希彦[7]研究表明,添加0.2%芽孢杆菌制剂使21 d肉鸡的脾脏指数、法氏囊指数显著提高。本试验结果表明,在不同营养水平下添加益生菌,特别是低营养水平日粮中,肉鸡前期胸腺指数、脾脏指数和法氏囊指数均有所提高,对肉鸡后期的免疫器官指数没有影响,这表明添加益生菌后,可适当降低日粮营养水平,在保证动物正常生长的同时,可促进肉鸡前期的免疫器官发育,完善肉仔鸡免疫系统。而肉鸡后期自身的免疫功能已健全,应对外界刺激的能力增强,添加益生菌对对肉鸡后期免疫器官指数无明显效果。
3.2 不同营养水平下日粮中添加益生菌对血清抗氧化性能的影响
机体的抗氧化体系是由酶促和非酶促抗氧化体系共同维持的,酶促抗氧化体系主要包括谷胱甘肽过氧化物酶、谷胱甘肽还原酶、超氧化物歧化酶以及过氧化氢酶等,它们可以有效清除O-、H2O2、ROOH等中的活性氧并终止自由基链式反应。血液SOD活性、MDA含量以及T-AOC是反映机体抗氧化能力的重要指标。本试验研究表明,在低营养水平下添加益生菌,都能提高血液T-SOD的活性,降低血液MDA的含量,对T-AOC也有一定提高,这与段颖等[8]、杨家军等[9]在蛋鸡和小鼠中的研究报道一致,提示益生菌能增强机体抗氧化能力,减少过氧化物对机体的损伤。
3.3 不同营养水平下日粮中添加益生菌对肉鸡肠道黏膜抗氧化和免疫的影响
肠道黏膜处于沟通机体内外环境的重要位置,黏膜的完整性是维持肠道正常功能的重要保证,对保护肠道具有重要意义。MDA可与蛋白质、核酸(DNA、RNA)和磷脂等含有氨基的物质交联,引起黏膜或细胞损伤。黏膜中的SOD能够消除超氧阴离子的毒性,保护黏膜和肠壁细胞免受损伤[10]。有研究表明,益生菌能产生多种抗氧化酶,如超氧化物歧化酶[11]、含锰过氧化氢酶[12]、谷胱甘肽过氧化物酶[13]等,可清除黏膜自由基,防止过氧化反应损害肠道黏膜。本试验表明,在不同营养水平下添加益生菌能提高肉鸡黏膜的T-SOD活性,降低黏膜的MDA含量,增强总抗氧化能力,减少脂质过氧化反应。这提示益生菌能增加黏膜抗氧化能力的作用,保护肠道黏膜,维持肠道正常功能,从而促进动物健康生长。
肠道黏膜中IgG和SIgA可以加强肠道细胞吞噬作用,,是防御病菌在肠道黏膜黏附和定植的第一道防线[14-15]。益生菌可在肠道黏附定植,发挥特异性免疫作用活化相关淋巴组织,使SIgA生物合成增加,提高黏膜免疫功能[16]。Vinderola 等[17]用瑞士乳杆菌灌喂小白鼠发现,小肠中SIgA浆细胞量有所增加,提示益生菌能增强黏膜免疫功能。本试验中,在不同营养水平日粮中添加益生菌,能提高21 d肉鸡肠道黏膜中的IgG和42 d黏膜SIgA水平,这表明益生菌能增强肉鸡的黏膜免疫功能,其作用机理可能是:益生菌及其分泌物可作为抗原发挥免疫佐剂作用,活化肠黏膜内的微皱褶细胞和派伊氏淋巴结,与肠道上皮细胞及黏膜固有层免疫细胞相互作用,诱导肠道局部免疫反应,从而增强机体的体液免疫能力,防止致病菌或毒素在体内造成损害[18-19]。
3.4 不同营养水平下日粮中添加益生菌对肠道菌群的影响
肠道消化系统对营养物质的消化、吸收能力部分依赖于肠道中微生物分布的种类和数量。肠道中微生物的种类和数量决定了营养物质的代谢范围和程度,它们与宿主的健康、疾病有着极其密切的联系。当肠道微生态系统受到环境变化、采食、应激等因素的影响,其有益菌衍生的有益作用不能满足动物的生长要求,导致肠道功能发生紊乱,引起疾病的发生。而添加益生菌能有效调节肠道微生物区系的种类,促进肠道有益菌增殖,同时可与有害微生物进行竞争,维持和调整肠道微生态平衡[20-21]。孙瑞锋等[22]研究表明,添加枯草芽孢杆菌可降低21 d大肠杆菌和沙门氏菌的数量,增加乳酸杆菌数量,从而调节肉鸡肠道微生态环境。本试验中,在不同营养水平日粮中添加益生菌能极显著提高21 d肉鸡回肠的乳酸杆菌数量,降低21 d、42 d回肠大肠杆菌数量,但日粮营养水平则对肠道菌群影响不大,这提示益生菌在低营养水平日粮中也能发挥其抑制病原微生物、促进有益菌增殖的作用,其可能机制是:益生菌与肠道有益菌协同,通过有氧发酵,维持肠道的厌氧环境,从而排斥有害菌;益生菌在代谢过程中产生一些抗菌物质,能直接杀灭致病菌[23];益生菌能清除肠道内的毒性胺、硫化物、酚类和吲哚等,减少有害菌的代谢底物。但益生菌抑制有害菌、促进有益菌增殖的具体作用机理及其与机体有益菌的协同效应尚需更深入的探究。
4 结论
4.1 益生菌在不同营养水平下均能改善肉鸡的免疫功能和抗氧化性能,促进有益菌的增殖。
4.2 在低营养水平下添加益生菌能促进肉鸡前期的免疫器官生长和发育,促进肠黏膜免疫球蛋白分泌,极显著促进21 d回肠乳酸杆菌的增殖,抑制大肠杆菌增殖。
[1]Willis W L,Isikhuemhen O S,Ibrahim S A.Performance assessment of broiler chickens given mushroom extract alone or in combination with probiotics[J].Poultry Science,2007,86:1856-1860
[2]安永义.活菌制剂的作用及研究应用[J].饲料研究,1995(8):2-4
[3]Rial RD.The role of probiotic cultures in the control of gastrointestinal health[J].Journal of Nutrition,2000,130:396 -420
[4]Kogut M H,Pishko E J,Kaspers B,et al.Modulation of functional activities of chicken heterophils by recombinant chicken IFN - γ[J].Journal of Interferon&Cytokine Research,2001,21(2):85-92
[5]王世若.现代动物免疫学[M].长春:吉林科学出版社,1996
[6]司振书,牛钟相,王安波.益生素对鸡免疫性能的影响[J].山东农业大学学报:自然科学版,2007,38(2):230-233
[7]赵希彦.芽孢杆菌制剂对肉仔鸡生产性能和免疫力的影响[J].中国饲料,2009(11):37-39
[8]段颖,赵玉鑫,潘翠玲,等.富硒益生菌对蛋鸡抗氧化能力和肠道菌群及消化酶活性的影响[J].南京农业大学学报,2010,33(2):68 -72
[9]杨家军,黄克和,赵治平,等.富硒益生菌对小鼠生长、抗氧化力和肠道菌群的影响[J].食品科学,2009,30(1):242-245
[10]Holdom M D,Lechenne B,Hay R J,et al.Production and characterization of recombinant aspergillus fumigatus Cu,Zn superoxide dismutase and its recognition by immune human sera[J].Journal of Clinical Microbiology,2000,38(2):558-562
[11]刘建欣,郑昌学.现代免疫学——免疫的细胞和分子基础[M].北京:清华大学出版社,2002
[12]Bruno - barcena J,Andrus J,Libby SL,et al.Expression of a heterologous manganese superoxide dismutase gene in intestinal lactobacilli provides protection against hydrogen peroxide toxicity[J].Applied and Environmental Microbiology,2004,70:4702 -4710
[13]Rochat T,Gratadoux J,Gruss A,et al.Production of a heterologous nonheme catalase by Lactobacillus casei:an efficient tool for removal of H2O2and protection of Lactobacillus bulgaricus from oxidative stress in milk[J].Applied and Environmental Microbiology,2006,72:5143 -5149
[14]Serrano L M,Molenaar D,Wels M,et al.Thioredoxin reductase is a key factor in the oxidative stress response of Lactobacillus plantarum WCFS1[J].Microbial Cell Factories,2007,6:1 -14.
[15]武金宝,王继德,张亚历.肠黏膜屏障研究进展[J].世界华人消化杂志,2003,11(5):619 -623
[16]Ouwehand A,Isolauri E,Salminen S.The role of the intestinal microflora for the development of the immune system in early childhood[J].European Journal of Nutrition,2002,41(Supplement 1):32-37
[17]Vinderola G,Matar C.Milk fermented by Lactobacillus helveticus R389 and its non-bacterial fraction confer enhanced protection against Salmonella enteritisdis serovar Ty-phimurium infection in mice[J].Immunobiology,2007,212(2):107-118
[18]Vinderola G,Matar C,Perdigon G.Role of intestinal epithelial cells in immune effects mediated by gram-positive probiotic bacteria:Involvement of toll- like receptors[J].Clinical and Diagnostic Laboratory Immunology,2005,12(9):1075-1084
[19]Fujiwara S,Hashiba H,Hirota T,et al.Proteinaceous factor(s)in culture supernatant fluids of bifidobacteria which prevents the binding of enterotoxigenic Escherichia coli to gangliotetraosylceramide[J].Applied and Environmental Microbiology,1997,63:506 -512
[20]Fuller R,Gibson GR.Modification of the intestinal microflora using probiotics and prebiotics[J].Scandinavian Journal of Gastroenterology,1997,32:28 -31
[21]Jin L Z.Adhesion of Lactobacillus isolates to intestinal epithelial cell of chicken[J].Letters in Applied Microbiology,1996,22(3):229
[22]孙瑞锋,步长英,李同树.菊糖和枯草芽孢杆菌对肉鸡肠道菌群数量及排泄物氨气散发量的影响[J].华北农学报,2008,23(增刊):252 -256
[23]陈华,郑之明,余增亮.枯草芽孢杆菌JA脂肽类及挥发性物质抑菌效应的研究[J].微生物学通报,2008,35(1):1-4.
——中国益生菌信息与技术交流平台

