铁离子螯合亲和层析分离抗氧化活性核桃肽
吕 莹 刘 静 陈湘宁
(农产品有害微生物及农残安全检测与控制北京市重点实验室北京农学院食品科学与工程学院,北京 102206)
核桃是我国重要的林产品,目前核桃除鲜食外,深加工主要集中在生产核桃乳或核桃油。核桃榨油后剩下的核桃粕中含有大量的核桃蛋白,约占核桃粕重量的50%左右,有研究表明,从核桃粕中提取核桃蛋白进行体外酶解后得到的核桃肽具有抗氧化活性[1]。
体内金属离子如铜和铁离子均含有未配对电子,是产生自由基的重要来源。因此,食物成分若能结合体内的铜和铁离子,阻断自由基的产生,即能有效地抗氧化。近年来的研究表明,蛋白质及其体外酶解得到的肽段均具有金属离子螯合能力,如牛奶来源的酪蛋白磷酸肽、鸡蛋黄磷酸肽、大豆肽和肉类因子(meat factor)等[2-7],其肽段氨基酸侧链中富含的羧基或磷酸基团上的氧、精氨酸或组氨酸的氨基能提供电子对与金属离子螯合。核桃蛋白中谷氨酸、天冬氨酸和精氨酸的含量较高,分别为20.19%、10%和13.22%[8],具有与金属离子螯合的可能性。但目前有关核桃肽抗氧化活性的研究多集中在核桃蛋白酶解条件优化、酶解工艺的确定上,而有关核桃肽的金属离子螯合能力与其抗氧化活性的相关性鲜见报道。
金属离子螯合亲合层析(Immobilized Metal Affinity Chromatography,IMAC)是一种有效的分离具有金属离子螯合能力的蛋白质或肽的手段[9-10]。可以将金属离子螯合能力不同的肽段分开,广泛用于肽段的分离。Lund等[11]采用该技术从奶酪中鉴定了不同的磷酸丝氨酸含量的水溶性磷酸肽。Storcksdieck等[6]也采用该技术分离了肌肉组织中低分子质量的铁结合肽。因此,本研究采用铁离子螯合亲和层析技术分离具有不同铁结合能力的核桃肽,考察其抗氧化活性,解析核桃肽的铁结合能力和抗氧化活性之间的关系,为明确核桃肽的抗氧化机理提供理论基础,也为核桃深加工技术提供科学依据。
1 材料与方法
1.1 材料
低温脱脂核桃粕:河北省石家庄京丸有限公司;中性蛋白酶:北京诺维信生物技术有限公司;IDASephorose-6B:北京本元正阳基因技术股份有限公司;其他化学品均为分析纯。
1.2 试验仪器
PP-25 pH计:德国赛多利斯;FD-1C-50冷冻干燥机:北京博医康实验仪器有限公司;LXJ-ⅡB离心机:上海安亭科学仪器厂;UV-1800紫外-可见分光光度计:日本岛津公司;SHJ-A水浴锅:安坛市华锋仪器有限公司。
1.3 样品制备
低温脱脂核桃粕溶于水,用5 mol/L的NaOH调节至 pH 8.0,室温提取 1.5 h,料液比为 10:1。提取后离心(3 000×g,20 min)。上清液用5 mol/L HCl调节至 pH4.5,室温静置 0.5 h,离心(3 000 × g,20 min)。沉淀用水洗2遍后用蒸馏水溶解并调至pH7.0。中性蛋白酶添加到核桃蛋白溶液中(蛋白质含量为20 g/L;酶∶底物 =5∶100),50 ℃酶解60 min。酶解结束后沸水浴灭酶5 min。冷却到室温,离心(3 000×g,20 min)收集上清液即为核桃肽溶液,真空冷冻干燥得到冻干粉备用。
1.4 金属离子螯合亲和层析
IDA -Sepharose 6B(25 mL)装在直径2.6 cm、长度10 cm的柱中,加入40 mL 0.2 mol/L FeCl3螯合铁离子30 min(铁螯合量为(93.5±2.2)μmol/mL湿胶,(467.6±3.6)μmol/g干胶)。柱子经过8~9倍床体积的去离子水清洗,以除去不结合在介质上的铁离子。再用0.05 mol/L pH 4.0的醋酸-醋酸钠(NaAC-HAC)缓冲液洗柱子5~6倍床体积,除去非特异性结合的铁。柱子用不同的平衡缓冲液平衡。核桃肽冻干粉20 mg溶解在1 mL平衡缓冲溶液,上样,静止30 min使样品充分结合在亲和层析介质上。采用平衡缓冲液洗脱,并将这部分收集的液体命名为未吸附的组分。结合到铁柱上的核桃肽分别采用不同的洗脱剂洗脱,收集洗脱液。洗脱过程流速为1 mL/min,每5 min收集1管,并在220 nm下测定其吸光值,温度为室温。
柱子的再生:5~10倍柱床体积的0.05 mol/L的EDTA洗柱,后用纯净水流洗5~10个柱床体积,流速为1 mL/min。
1.5 不同pH平衡缓冲液对核桃肽吸附能力的影响
核桃肽吸附试验所用的缓冲液:(A)缓冲液为0.05 mol/L 的 NaAC - HAC、pH 5.5;(B)0.05 mol/L的2-吗啉乙磺酸[(2-(4-Morpholino)ethanesulfonic acid,MES)],用 NaOH 调整到 pH 6.0;(C)0.05 mol/L 的 Tris- HCl、pH 7.5。
1.6 不同洗脱剂对吸附到亲和层析柱上核桃肽洗脱效果的影响
使用的洗脱缓冲液为:(D)0.02 mol/L磷酸氢二钠(Na2HPO4);(E)0.02 mol/L磷酸二氢钠(NaH2PO4);(F)0.02 mol/L 的咪唑;(G)0.02 mol/L的谷氨酸钠;(H)0.02 mol/L的丙二酸。
1.7 核桃肽抗氧化活性的测定
1.7.1 总还原能力的测定
核桃肽样品液2 mL,加入2 moL/L pH 6.6的磷酸盐缓冲溶液混合,再加入2 mL 1%的铁氰化钾充分混合。混合物在50℃下加热20 min。再加入2 mL 10%的TCA,混合。混合物离心(3 000×g,10 min)。取上层清液2 mL加入2 ml蒸馏水和0.4 mL、0.1%的FeCl3,三者充分混合。反应10 min后,于700 nm下测定吸光值。以蒸馏水作为对照,核桃肽的还原能力以U(样品的吸光值-对照的吸光值)表示[12]。
1.7.2 2,2-联氮 -二(3-乙基 -苯并噻唑 -6-磺酸)二铵盐(ABTS)自由基清除活性
将ABTS溶液配制成终浓度为7 mmol/L的溶液,加入2.45 nmol/L的过硫酸盐混合,混合液在室温暗处放置12~16 h。反应前,将ABTS溶液用0.2 mol/L、pH 7.4的磷酸钠缓冲液稀释,使其在734 nm处的吸光值为 0.7~0.02。在 40μL的样本液(1 mg/mL)中加入4 mL ABTS稀释液,漩涡振荡器混合30 s,于暗处放置6 min。在734 nm下测定其吸光值,以蒸馏水为对照。核桃肽清除ABTS自由基的活性以 U(1 -A样品/A水)表示[13]。
1.8 肽含量的测定
按Lowry等[14]方法分析,肽含量以蛋白含量计,以牛血清白蛋白(BSA)作标准。
1.9 统计分析
所有的试验结果均以平均数±标准差(Means±SD)形式表示,n=3以方差分析ANOVA来检测平均值之间的差异,以P﹤0.05为差异显著。统计分析使用OriginPro 7.5软件包。
2 结果和讨论
2.1 不同pH的平衡缓冲液和洗脱剂对核桃肽在铁离子亲和层析柱上吸附行为的影响
为了明确核桃肽和铁的相互作用、分离不同铁结合能力的肽段,比较了不同pH的平衡缓冲液和洗脱剂对核桃肽在铁离子亲和层析柱上的吸附行为。
平衡缓冲溶液的pH值对核桃肽在铁亲和层析柱上吸附能力的影响如图1所示。
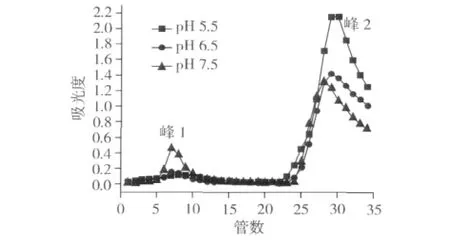
图1 不同pH条件下核桃肽在铁亲和层析柱上的吸附行为
图1中峰1为未吸附到铁亲和层析柱上的核桃肽,而峰2为吸附到亲和层析柱上并用洗脱剂洗脱下来的核桃肽组分。当用pH 5.5的NaAC-HAC缓冲液平衡柱子时,峰1所占比例很小,大部分的核桃肽吸附到层析柱上。而与pH 5.5的条件相比,当平衡缓冲液的pH分别升高到6.5和7.5时,峰1组分逐渐提高,而峰2的量明显下降。说明随着pH的增加,未吸附到层析柱上的核桃肽量逐渐增加,吸附的肽组分减少,相应的核桃肽与铁的亲和力下降。这一结果与Zachariou等[15]发现蛋白质在固定Fe3+的介质上的吸附情况具有pH依赖性一致。通常情况下蛋白质的谷氨酸、天冬氨酸的羧基、丝氨酸的磷酸基团、及组氨酸的氨基参与铁结合。核桃蛋白中谷氨酸和天冬氨酸的质量分数约为15%~20%、丝氨酸的质量分数约为4%[8,16]。谷氨酸和天冬氨酸的等电点分别为2.77和3.2,在 pH 5.5的条件下,天冬氨酸和谷氨酸的羧基电离与铁螯合。而当pH升高到6.5时,溶液中羟基与羧基竞争结合铁,随着pH上升到7.5,核桃肽在铁柱上的结合能力下降。核桃蛋白中组氨酸的含量约为7%[16],组氨酸的等电点为7.6,在pH 5.5的条件下不会离子化与铁结合,因此在该条件下,核桃肽中谷氨酸和天冬氨酸的羧基和丝氨酸的磷酸基团可能参与的铁的结合,而组氨酸的作用不明显。
为了有效地分离铁结合核桃肽,研究其铁结合能力与抗氧化活性之间的关系,进一步对洗脱剂进行选择。图2显示了当平衡缓冲液固定为pH 5.5的NaAC-HAC缓冲液,采用不同洗脱剂洗脱吸附到铁亲和层析柱上的核桃肽时,肽段的解析行为。其中,采用Na2HPO4洗脱的核桃肽的量要高于NaH2PO4作为洗脱剂的肽量,磷酸二氢钠又高于咪唑,而谷氨酸钠几乎不具有洗脱与铁柱结合的核桃肽的能力。
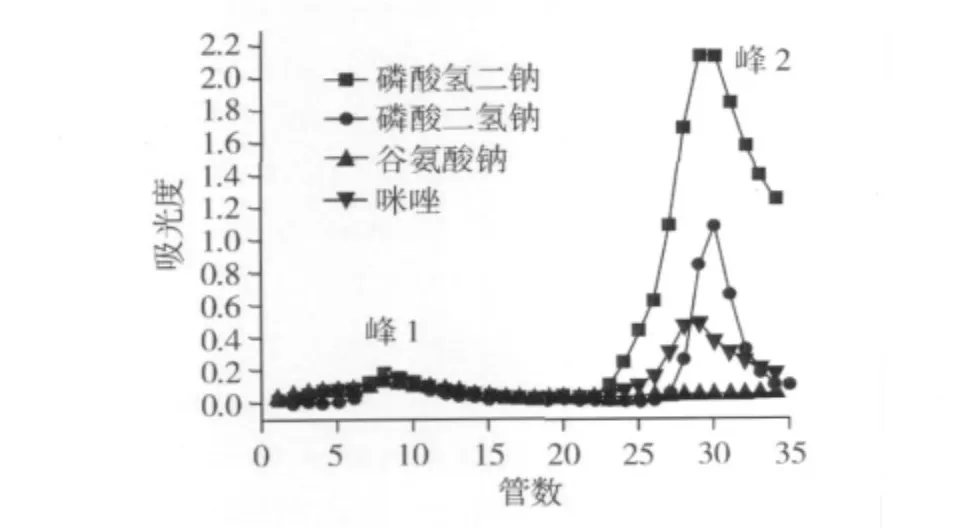
图2 不同洗脱剂洗脱吸附到铁亲和层析柱上的核桃肽
同样含有磷酸基团,但磷酸氢二钠的洗脱能力好于磷酸二氢钠,说明碱性条件跟有利于破坏核桃肽和铁之间的相互作用;而主要用于分离以组氨酸的氨基与肽段螯合的咪唑从柱上洗脱的核桃肽量较少,这一结果也说明在同样的碱性下条件,磷酸基团可以减少核桃肽和铁之间的相互作用,意味着核桃肽和铁之间的结合位点可能大部分是羧基,而组氨酸的作用次之。另外,本试验中采用丙二酸作为洗脱剂,但丙二酸将铁从柱上分离,因此不能用来洗脱样品。
2.2 铁离子螯合亲和层析分离核桃肽
根据上述结果,pH 5.5的NaAC-HAC缓冲液作为平衡缓冲液,0.02 mol/L的磷酸氢二钠作为洗脱剂进行铁结合核桃肽的分离。为了获得更多的铁结合能力不同的核桃肽组分,分别采用0.01mol/L和0.02 mol/L的磷酸氢二钠进行阶段洗脱,可以得到2个峰。如图3所示,经过分离,得到了不能吸附到铁柱上的、没有铁结合能力的峰1(F1),和具有铁螯合能力,且结合能力逐渐增强的峰2(F2)和峰3(F3)。金属离子螯合亲和层析技术广泛用于金属离子螯合蛋白质和肽段的分离。Lund等[17]采用该技术从奶酪中鉴定了不同的磷酸丝氨酸含量的水溶性磷酸肽。Storcksdieck等[6]也采用该技术分离了肌肉组织中低分子量的铁结合肽。因此,本研究采用铁离子亲和层析柱分离不同铁结合能力的核桃肽组分是可行的。
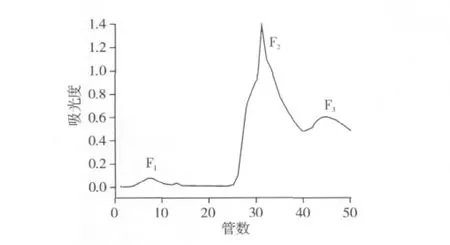
图3 铁亲和层析柱分离不同铁结合能力的核桃肽
2.3 核桃肽抗氧化活性及其与铁结合能力的关系
收集F1、F2和F3组分,采用Folin-酚法测定3个组分的肽含量,分别为F1:(63.04±0.53)mg/mL;F2:(56.46 ±1.24)mg/mL;F3:(11.21 ±0.01)mg/mL。3种组分的比例大致为6∶5∶1(表1)。采用总还原能力和ABTS自由基清除能力2个方法测定3个峰核桃肽的抗氧化活性,结果如表1所示。F3的总还原能力为(0.66 ±0.06)U/mg,显著高于 F1(0.07 ±0.01)U/mg和 F2(0.43 ±0.08)U/mg(P <0.05);F3清除 ABTS自由基的能力为(1.41±0.20)U/mg,显著高于 F1(0.49 ±0.12)U/mg和 F2(1.03 ±0.03)U/mg(P<0.05)。也即,三个组分的核桃肽,无论是总还原力还是ABTS自由基清除的能力,均为F3>F2>F1(P<0.05)。根据前面的结果,这三个峰铁结合能力的顺序也为F3>F2>F1。总结这两个结果不难发现,铁结合能力越强的核桃肽,其还原能力和清除ABTS自由基的能力也越强,抗氧化活性越高。
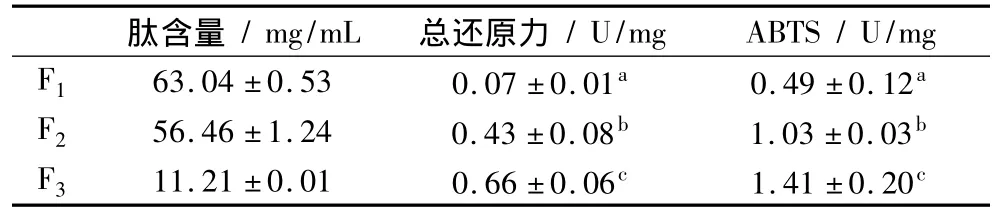
表1 铁亲和层析柱分离的核桃肽组分的肽含量和抗氧化活性
采用铜离子结合的亲和层析柱考察鹰嘴豆和向日葵蛋白酶解物的抗氧化活性时发现,结合铜离子的肽段具有抗氧化活性[17-18],进一步的分析表明,肽段中富含组氨酸。通过研究发现,核桃蛋白质酶解物具有与铁螯合的能力,且铁结合能力越强抗氧化活性越高。机体内的金属离子如:铁和铜离子易生成自由基,引起一系列氧化损伤。近年来的研究表明,食物中具有结合金属离子的能力的成分如:植酸、酚酸等,能够阻止自由基的产生,从而起到抗氧化的作用[19-20]。因此,综合上述研究结果,核桃蛋白酶解物的抗氧化活性与其结合金属离子的能力有关。
3 结论
通过研究发现,核桃肽在酸性条件(pH 5.5)下与铁的结合能力最强,随着pH逐渐升高,结合能力下降。磷酸氢二钠对吸附到铁亲和层析柱上核桃肽的洗脱效果最好,通过阶段洗脱,可以得到不同铁结合能力的核桃肽。对其进行抗氧化活性分析发现铁结合能力强的核桃肽抗氧化活性高。因此,本研究通过分析核桃肽和铁之间的相互作用,确定分离核桃肽的条件,分析了核桃肽的铁结合能力和抗氧化活性的关系,为阐明核桃肽的抗氧化机理提供理论基础。
[1]许慧娇,郝艳宾,齐建勋,等.核桃蛋白酶解物体外抗氧化及降血压活性研究[J].农产品加工,2009,10:38-42
[2]Jiang B,Mine Y.Phosphopeptides derived from hen egg yolk phosvitin:effect of molecular size on calcium-binding properties[J]. Bioscience Biotechnology and Biochemistry,2001,65:1187-1190
[3]Sato R,Noguchi T,Naito H.Casein phosphopeptides(CPP)enhances calcium absorption from the ligated segment of rat small intestine[J].Journal of Nutritional Science and Vitaminology,1986,32(1):67-76
[4]Bao X L,Lv Y,Yang B C,et al.A study of the soluble complexes formed during calcium binding by soybean protein hydrolysates[J].Journal of Food Science,2008,73:117 -122
[5]Lv Y,Liu Q,Bao X,et al.Identification and Characteristics of Iron-Chelating Peptides from Soybean Protein Hydrolysates Using IMAC -Fe3+[J].Journal of Agricultural and Food Chemistry,2009,57:4593 -4597
[6]Storcksdieck S,Bonsmann G,Hurrell RE.Iron-binding properties,amino acid composition,and structure of muscle tissue peptides from in vitro digestion of different meat sources[J].Journal of Food Science,2007,72(1):s19 -s29
[7]Swain J H,Tabatabai L B,Reddy M B.Histidine content of low-molecular-weight beef proteins influences nonheme iron bioavailability in Caco - 2 cells[J].Journal of Nutrition,2002,132:245-251
[8]王翼平,李亚南,马建伟.山核桃仁中主要营养成分的研究[J].食品科学,1998(19):44-46
[9]Porath J,Olin B.Immobilized metal ion affinity adsorption and immobilized metal ion affinity chromatography of biomaterials:Serum protein affinities for gel-immobilized iron and nickel ions[J].Biochemistry,1983,22:1621 - 1630
[10]Lin F Y,Chen W Y,Huang S Y,Selective separation of caseinphosphopeptides through immobilized metal ion affinity chromatography:effect of pH values,salt concentrations and degree of phosphorylation[J].Bioprocess Engineering,2000,23:467-471
[11]Lund M,Ardo Y.Purification and identification of watersoluble phosphopeptides from cheese using Fe(Ⅲ)affinity chromatography and mass spectrometry[J].Journal of Agricultural Food Chemistry,2004,52:6616 -6622
[12]Hwang J Y,Shyu Y S,Wang Y T,et al.Antioxidative properties of protein hydrolysate from defatted peanut kernels treated with esperase[J].LWT - Food Science and Technology 2010,43:285-290
[13]Zhu L,Chen J,Tang X,et al.Reducing,radical scavenging,and chelation properties of in vitro digests of alcalasetreated zein hydrolysate[J].Journal of Agricultural Food and Chemistry,2008,56:2714 -2721
[14]Lowry O H,Rosebrough N J,Farr A L,et al.Protein measurement with the folin phenol reagent[J].Journal of Biological Chemistry,1951,193(1):265 -275
[15]Zachariou M,Hearn MTW.Protein selectivity in immobilized metal affinity chromatography based on the surface accessibility of aspartic and glutamic acid residues[J].Journal of Protein Chemistry,1995,14:419 -430
[16]刘力,龚宁,夏国华,等.山核桃种仁蛋白质及氨基酸成分含量的变异分析林业科学研究[J].2006,19(3):376-378
[17]Megías M,Pedroche J,Yust M M,et al.Affinity purification of copper chelating peptides from chickpea protein hydrolysates.Journal of Agricultural Food and Chemistry[J].2007,55:3349-3954
[18]Megías M,Pedroche J,Yust M M,et al.Production of copper-chelating peptides after hydrolysis of sunflower proteins with pepsin and pancreatin[J].LWT - Food Science and Technology,2008,41:1973 -1977
[19]Graf E,Eaton J W,Antioxidant functions of phytic acid.Free Radical[J].Biology and Medicine,1990,8:61 -69
[20]Seeram N P,Aviram M,Zhang Y,et al.Comparison of antioxidant potency of commonly consumed polyphenol-rich beverages in the United States[J].Journal of Agricultural Food and Chemistry,2008,56:1415-1422.

