前列腺素E1对脑梗死后神经干细胞增殖和迁移的影响☆
吉章阁张素平凌莉黄惠鸿何锐王慕真邓婉青吴文法
侧脑室室管膜下区(subventricular zone,SVZ区)和海马齿状回颗粒下层是成年哺乳动物中枢神经系统内神经干细胞的两个主要分布区域[1-3]。众多研究表明,脑梗死可诱导以上两个区域的内源性神经干细胞增殖,并向梗死灶迁移和分化,这可能有助于脑梗死后神经功能的改善[4]。近来研究发现,前列腺素E1对局灶性脑缺血大鼠模型有神经保护作用,但具体机制尚不清楚[5],目前尚无前列腺素E1对脑卒中后神经再生影响的报道。本研究观察前列腺素E1对大鼠脑梗死后内源性神经干细胞增殖、迁移和神经功能的影响。
1 材料和方法
1.1 实验动物分组和脑梗死模型制作成年雄性Sprague Dawley大鼠(广东省医用实验动物中心提供,合格证号:0109973,0109552)随机分为3组,前列腺素E1组、溶剂对照组和假手术组,每组12只。前列腺素E1组和溶剂对照组按Chen等[6]方法制作大鼠右侧大脑中动脉皮层支闭塞(middle cerebral artery occlusion,MCAO)模型。假手术组只开颅暴露不结扎血管。
1.2 前列腺素E1静脉注射及5-溴脱氧尿嘧啶核苷(BrdU)腹腔注射 MCAO术后24 h起,前列腺素E1组经尾静脉注射前列腺素E1(北京泰德制药,批号:2192S,10 µg·kg-1·d-1,溶于0.5mL生理盐水),每天1次,连续6d;溶剂对照组尾静脉注射等量等疗程的生理盐水;假手术组不予尾静脉注射。处死前3 d起3组大鼠经腹腔注射BrdU(50 mg/kg,Sigma),每天2次,连续3 d。
1.3 神经功能评分 MCAO或假手术后7 d、14 d,各组大鼠采用Bederson评分系统[7]行神经功能评分。
1.4 灌注、取材及制片术后7d、14d,3组大鼠行腹腔麻醉后经升主动脉依次灌注4℃肝素化生理盐水(250IU/mL)和4%多聚甲醛,然后开颅取脑。脑组织后固定6 h后置于梯度蔗糖溶液中脱水。恒温冰冻切片机(LEICA CM1900,Germany)切片,片厚10μm。晾干后置于-80℃冰箱保存。
1.5 脑梗死体积测定各组大鼠的相对脑梗死体积按Swanson等方法[8]采用Hematein and Eosin(H&E)染色法计算,以梗死体积占梗死对侧大脑组织的相对百分比表示。
1.6 免疫荧光检测切片复温后,依次浸泡于37℃2 mol/L盐酸30 min、室温0.1 mol/L硼酸溶液(pH=8.5)10 min,0.01 mol/L PBS漂洗3次,血清封闭1 h后加一抗:小鼠抗大鼠BrdU(1:800,Sigma-Aldrich,USA)/山羊抗大鼠 doublecortin(DCX,1:200,Santa Cluz,USA),4 ℃孵育过夜。0.01 mol/L PBS洗涤3次后滴加二抗:驴抗小鼠Alexa Flour 596(1:300,Invitrogen,USA)/驴抗山羊Alexa Flour 488(1:200,Invitrogen,USA),室温孵育1.5h后封片。荧光显微镜(Olympus BX51,Japan)采集图像,用NIH Image 1.46 for Windows进行图像分析。
1.7 统计学处理 采用SPSS for Windows 17.0进行统计分析,等级资料用Mann-Whitney U非参数检验,计量资料用SNK法比较多组间两两差异性。检验水准α=0.05。
2 结果
2.1 神经功能评分 MCAO术后7d、14d,前列腺素E1组与同时点溶剂对照组比较[中位数(25%,75%)表示],分别为 1.5(1.0,2.0)、2.0(2.0,3.0)(U=37,P=0.032);0.5(0,1.0)、1.0(1.0,2.0)(U=28,P=0.003)。
2.2 脑梗死体积测定 H&E染色显示,MCAO术后大鼠的脑梗死灶位于右侧颞顶叶皮质;术后各时间点,前列腺素E1组脑梗死体积与溶剂对照组比较差异无统计学意义。假手术组未见脑梗死灶。
2.3 SVZ区及梗死灶周细胞增殖免疫荧光检测发现,MCAO或假手术后7 d、14 d,各组大鼠手术侧及对侧SVZ区均存在BrdU+标记的新增殖细胞,其中前列腺素E1组和溶剂对照组以梗死侧SVZ区显著,假手术组两侧无显著差别。前列腺素E1组梗死侧SVZ区及梗死灶周BrdU+细胞数均显著高于同时点溶剂对照组及假手术组(表1,P<0.05)。此外,前列腺素E1组和溶剂对照组梗死侧SVZ区的细胞增殖在MCAO术后7d最显著,14d时下降。
2.4 手术侧SVZ区内源性神经干细胞的增殖术后7d、14d,免疫荧光检测发现,前列腺素E1组梗死侧SVZ区BrdU+/DCX+细胞数显著高于同时点溶剂对照组及假手术组,溶剂对照组及假手术对照组手术同侧SVZ区BrdU+/DCX+细胞数之间比较差异亦具有统计学意义(图1)。
2.5 内源性神经干细胞的迁移 MCAO术后7d、14d,前列腺素E1组、溶剂对照组均可见较多的BrdU+/DCX+细胞自梗死侧SVZ区前角沿胼胝体向梗死灶周皮层迁移,形态上呈现为“链状”迁移流,其中大多数BrdU+/DCX+细胞表现为典型的迁移细胞形态,即呈细长的细胞核和双极细胞体。而MCAO术后7d,前列腺素E1组与溶剂对照组比较,迁移流中BrdU+/DCX+细胞更多(图1),BrdU+/DCX+细胞迁移距离更远(图2)。
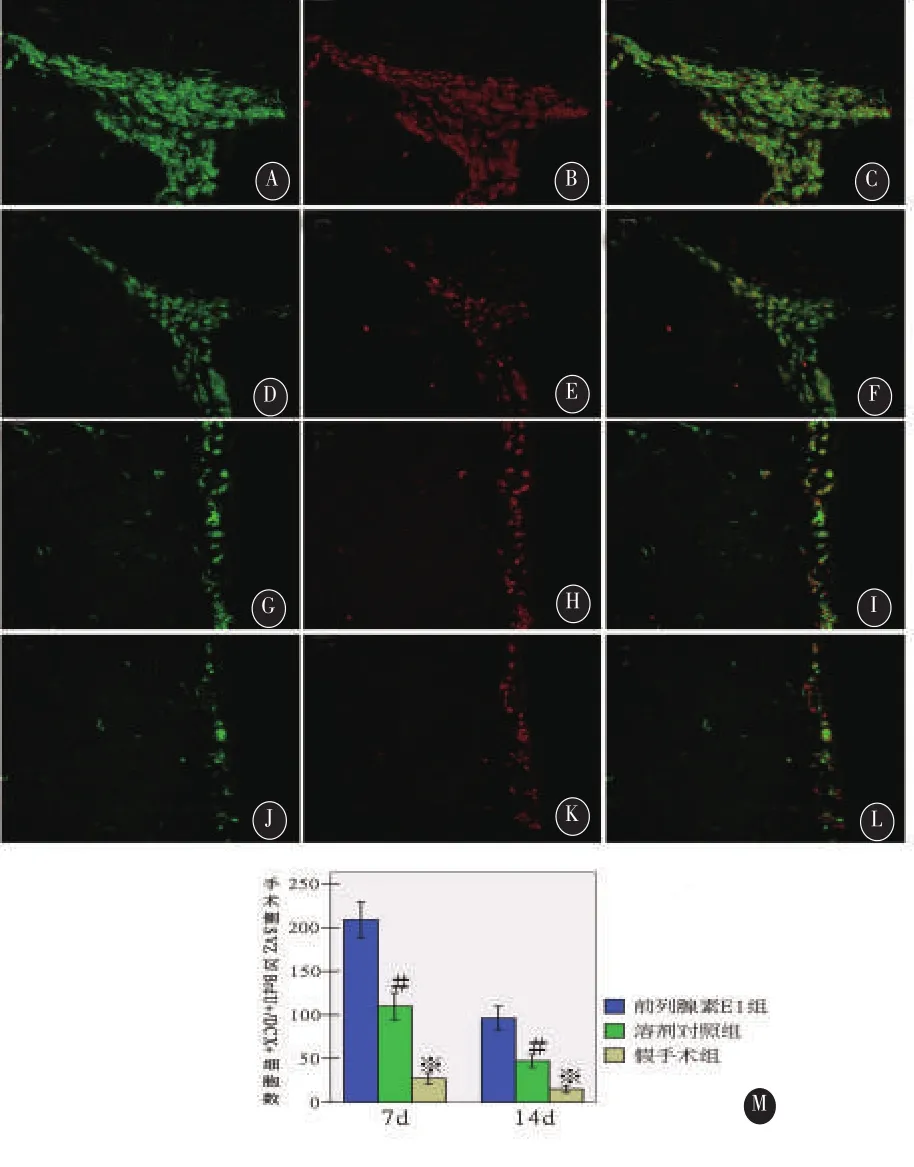
图1 前列腺素E1促进脑梗死后梗死同侧SVZ区BrdU+/DCX+标记的神经干细胞增殖和迁移。注:A、D为MCAO术后7d前列腺素E1组、溶剂对照组梗死同侧SVZ区前角DCX+细胞,G、J为同时点两组梗死同侧SVZ区外侧壁DCX+细胞;B、E为同时点两组梗死同侧SVZ区BrdU+细胞,H、K为同时点两组梗死同侧SVZ区外侧壁BrdU+细胞;C、F为同时点两组梗死同侧SVZ区DCX+/BrdU+细胞;I、L为同时点两组梗死同侧SVZ区外侧壁BrdU+/DCX+细胞。M为术后7d、14d前列腺素E1组、溶剂对照组和假手术组大鼠手术侧SVZ区DCX+/BrdU+细胞数的误差限直条图,#为前列腺素E1组与同时点溶剂对照组比较,均P<0.05;※为前列腺素E1组与同时点假手术组比较,均P<0.05。标尺为500µm。
表1 各组大鼠术后不同时点梗死灶周及手术侧SVZ区BrdU+细胞数(±s)

表1 各组大鼠术后不同时点梗死灶周及手术侧SVZ区BrdU+细胞数(±s)
注:1)MCAO或假手术后7d、14d,前列腺素E1组与同时点溶剂对照组比较,均P<0.05;2)MCAO或假手术后7d、14d,前列腺素E1组与同时点假手术组比较,均P<0.05。
分组前列腺素E1组溶剂对照组假手术组n 6 6 6梗死灶周SVZ区7d 349.7±9.21)2)203.5±12.2 53.8±8.4 14d 203.4±13.31)2)136.7±11.8 27.2±6.2 7d 380.3±14.31)2)251.3±9.5 50.3±5.4 14d 230.2±10.11)2)126.2±8.8 24.3±6.3

图2 前列腺素E1促进脑梗死后梗死同侧SVZ区BrdU+/DCX+标记的神经干细胞呈链状形态迁移。注:A、B、C分别为MCAO术后7d前列腺素E1组梗死同侧SVZ区前角DCX+细胞、BrdU+细胞和BrdU+/DCX+细胞,呈链状迁移形态。D、E、F分别为术后7d溶剂对照组梗死灶同侧SVZ区前角DCX+细胞、BrdU+细胞、BrdU+/DCX+细胞。G为MCAO术后7d前列腺素E1组和溶剂对照组梗死同侧SVZ区BrdU+/DCX+细胞迁移距离的误差限直条图,#为MCAO术后7d前列腺素E1组与溶剂对照组比较,P<0.05。标尺为250µm。
3 讨论
前列腺素E1(prostaglandinum E1,PGE1)是前列腺素的一种亚型,具有舒张血管、抑制血小板聚集、稳定细胞膜和抗炎作用,主要用于治疗周围血管疾病、脑缺血、心肌缺血和肝脏缺血等缺血性疾病[9]。前列腺素E1治疗可抑制脑缺血大鼠脑皮层内基质金属蛋白酶-2和基质金属蛋白酶-3表达,具有神经保护作用[10];近来Sheng[9]等报道前列腺素E1治疗可增加大鼠脑缺血后热休克蛋白70、热休克蛋白60和Bcl-2蛋白表达,拮抗神经细胞凋亡,减少脑梗死体积,改善神经功能缺损[5]。本研究发现,MCAO术后7d、14d,前列腺素E1组较溶剂对照组神经功能评分明显降低,提示前列腺素E1可改善神经功能缺损,对缺血性脑卒中具有神经保护作用,与以上研究结论相符。而脑梗死体积两组比较差异无统计学意义,与Sheng等[5]的研究结论不同,这可能与两项研究前列腺素E1用药起始时间和剂量差异有关。
近年来,受益于神经干细胞分子标志物(DCX等)、DNA复制标志物(BrdU)等神经再生检测方法的创新[11],众多研究已证实脑卒中、脑外伤等中枢神经系统损伤可诱导成年哺乳类动物脑内神经干细胞增殖,这可能对中枢神经系统损伤具有修复作用[12-13],其中有线栓法诱导的大鼠脑梗死模型研究报道,MCAO术后7d在梗死同侧SVZ区可见大量神经干细胞增殖并沿胼胝体向梗死灶周迁移[14]。DCX是未成熟的神经干细胞或成神经细胞的标记物[1],BrdU+/DCX+细胞则提示为新增殖的未成熟的神经干细胞或成神经细胞[1,15]。我们利用BrdU+/DCX+免疫荧光双标检测发现,在MCAO术后7d、14d,前列腺素E1组和溶剂对照组大鼠梗死灶周BrdU标记的新增殖细胞以及梗死侧SVZ区BrdU+/DCX+标记的新增殖神经干细胞均明显多于假手术后的对照组,再次证明脑梗死能诱导SVZ区神经干细胞增殖和梗死灶周细胞增殖;而前列腺素E1治疗组SVZ区BrdU+/DCX+标记的新增殖神经干细胞与同时点溶剂对照组相比亦明显增多(图1),提示前列腺素E1可促进脑梗死后SVZ区神经干细胞增殖,这可能有助于脑卒中后神经功能恢复。此外,在MCAO术后各时点,前列腺素E1组和溶剂对照组大鼠梗死侧BrdU+/DCX+标记的新增殖神经干细胞主要集中在梗死侧SVZ区前角和侧壁区域,提示SVZ区可能是脑梗死后内源性神经干细胞增殖并向梗死灶周迁移的起始地。形态学方面,我们发现前列腺素E1组和溶剂对照组梗死侧SVZ区内BrdU+/DCX+细胞首先向SVZ区前角部位集中,然后自前角呈链状形态沿胼胝体向梗死灶周迁移,且越远离SVZ区前角迁移流中的BrdU+/DCX+细胞越少(图2);而在MCAO术后7d,与溶剂对照组相比,前列腺素E1组链状迁移流中BrdU+/DCX+细胞迁移距离更远(图2),这提示前列腺素E1治疗可促进SVZ来源的神经干细胞向梗死灶周迁移,可能有助于脑梗死后受损脑组织的神经重塑和修复,进而改善受损的神经功能。近来有研究报道在大鼠局灶性皮层脑梗死后1周,可见大量新生的、未成熟的神经干细胞迁移至距离SVZ区1~4 mm不等的梗死灶周皮质,提示新增殖的神经母细胞可能自SVZ区跨越纹状体迁移至皮质损伤部位[16],这与我们研究观察到的神经干细胞迁移形态相符。亦有研究报道,人类缺血性脑卒中后梗死灶周亦可见类似的长距离的神经母细胞迁移[17],但卒中后未成熟神经母细胞迁移的具体分子机制尚不清楚[18],近来有研究报道SDF-1α/CXCR4信号传导通路可能在指导神经干细胞迁移过程中发挥重要作用[1,4]。
总之,本研究结果提示,前列腺素E1治疗促进大鼠脑皮质梗死后SVZ区神经干细胞的增殖和迁移,并改善缺血性脑卒中后神经功能缺损,但其具体分子生物学机制还有待进一步研究。
[1]Barkho BZ,Zhao X.Adult neural stem cells:response to stroke injury and potential for therapeutic applications[J].Curr Stem Cell Res Ther,2011,6(4):327-338.
[2]刘辉,杨树源,张建宁.神经干细胞移植对颅脑损伤大脑脑皮层的保护作用[J].中国神经精神疾病杂志,2010,36(6):335-338.
[3]隋敏秀,张志珺,郭怡菁,等.Notch1信号系统在氟西汀上调大鼠海马神经再生中的作用[J].中国神经精神疾病杂志,2011,37(5):285-289.
[4]Leker RR,Lasri V,Chernoguz D.Growth factors improve neurogenesis and outcome after focal cerebral ischemia[J].Neural Transm,2009,116(11):1397-1402.
[5]Sheng R,Zhang LS,Han R,et al.Combined prostaglandin E1 and lithium exert pitent neuroprotection in a rat model of ischeamia[J].Acta Pharmacol Sin,2011,32(3):303-310.
[6]Chen ST,Hsu CY,Hogan EL,et al.A model of focal ischemic stroke in the rat:reproducible cxtensive cortical infarction[J].Stroke,1986,17(4):738-743.
[7]Bederson JB,Pitts LH,Tsuji M,et al.Rat middle cerebral artery occlusion:evaluation of the model and development of a neurologic examination[J].Stroke,1986,17(4):472-476.
[8]Swanson RA,Morton MT,Tsao-Wu G,et al.A seiautomated method for measuring brain infarct volume[J].J Cereb Blood flow Metab,1990,10(2):290-293.
[9]Schror K,Hohlfeld T.Mechanisms of anti-ischemic action of prostaglandin E1 in peripheral arterial occlusive disease[J].J Vasa,2004,33(3):119-124.
[10]包翠芳,魏嘉,梁佳,等.前列地尔对局灶性脑缺血模型大鼠大脑皮层基质金属蛋白酶2和基质金属蛋白酶9表达的影响[J].中国药房,2012,17(23);1577-1579.
[11]Ohira K.Injury-induced neurogenesis in the mammalian forebrain[J].Cell Mlol Life Sci,2011,68(10):1645-1656.
[12]Kojima T,Hirota Y,Ema M,et al.Subventricular zone-derived neural progenitor cells migrate along a blood vessel scaffold toward the post-stroke striatum[J].Stem Cells,2010,28(3):545-554.
[13]Yamashita T,Ninomiya M,Hernandez AP,et al.Subventricular zone-derived neuroblasts migrate and differentiate into mature neuronsin the post-stroke adult striatum[J].J Neurosci,2006,26(24):6627-6636.
[14]Kernie SG,Parent JM.Forebrain neurogenesis after focal ischemicand traumatic brain injury[J].Neurobiol Dis,2010,37(2):267-274.
[15]LEE SH,Kim YJ,Lee KM.Ischemic preconditioning enhances neurogenesis in the subventricular zone[J].Neuroscience,2007,146(3):1020-1231.
[16]Tsai PT,Ohab JJ,Kertesz N,et al.A critical role of erythropoietin receptor in neurogenesis and post-stroke recovery[J].J Neurosci,2006,26(4):1269-1274.
[17]Jim K,Wang X,Xie L,et al.Evidence for stroke-induced neurogenesis in the human brain[J].Proc Natl Acad Sci USA,2006,103(35):13198-13202.
[18]Ohab JJ,Fleming S,Blesch A,et al.A neurovascular niche for neurogenesis after stroke[J].J Neurosci,2006,26(50):13007-13016.

