肺黏液表皮样癌一例并文献复习
俞志钢,刘 文,李 伟,马占东
黏液表皮样癌(Mucoepidermoid carcinoma,MEC)是常见于腮腺的恶性肿瘤,发生于肺部的MEC 较为罕见[1],仅占肺部恶性肿瘤的 0.19%[2],其起源于肺叶气管、支气管黏膜分泌腺。因其占位性病变的缘故,很容易被临床医师误诊为其他病变;同时因MEC中黏液细胞成分所占比例、恶性程度也不同,因而病理医师的正确诊断有助于临床医生选择合理的治疗方案。现就我院收治的1例肺MEC报告如下。
1 临床资料
男,39岁。主因出现胸闷、胸痛、咳嗽、咳痰15 d,来我院就诊。胸部CT示:左肺下叶见局部弥漫状、结节状较均匀密度阴影,考虑为肿物,良性肿瘤可能性大。临床先行将肿物并附带小块肺组织切除做术中冰冻定性。术中冰冻提示:考虑肺组织局部上皮细胞重度非典型增生,不排除恶性肿瘤的可能,待石蜡进一步确诊。行肺叶切除及多组织淋巴结清扫术,共找到22枚淋巴结,送病理科待检。组织标本经10%的中性甲醛溶液固定,常规脱水,石蜡包埋,4 μm 厚切片,行 HE、PAS、AB-PAS 及免疫组化染色。所选用的抗体 CK、CK7、CEA、EMA、CK5/6、P63、S-100、Ki67、CK8/18 等均购自福州迈新生物科技开发公司。辅助化疗,但效果不明显。半年后复发,至今仍在治疗,进一步随访。
2 结果
2.1 肉眼观察 切除肺叶组织1块,大小13 cm×6 cm×6 cm,沿支气管切开,距支气管断端0.3 cm处见灰白色肿物1个,为5.0 cm×4.0 cm×3.5 cm,切面实性,灰白灰黑色,质硬,无包膜,肿物与肺组织边界不清,呈浸润性生长,局灶见散在囊状。
2.2 镜检 肿瘤由局部囊性区和弥漫实性区构成,囊性区瘤细胞部分呈柱状、立方状的黏液样上皮细胞,有的有纤毛、排列呈规则或不规则的大小不等的腺腔状,黏液性上皮细胞连续表皮样细胞并伴明显增生,局灶黏液区域可见瘤细胞漂浮,局部可伴出血表现;实性区肿瘤细胞以表皮样细胞、中间型细胞为主,黏液细胞较少,细胞中等偏大,圆形、多角形,偶尔可见成熟的鳞状细胞,胞浆嗜酸性,红染,局灶表皮样细胞增生呈小片状、无角化现象,核圆形或卵圆形、居中,可见核仁,见图1A。瘤细胞可见明显异型性,核分裂象及坏死灶易见,间质纤维性增生,局部区域偶见皮脂腺样分化的细胞。
2.3 免疫组化染色及特殊染色 CK(+)、CK7(+)、CEA(+)、EMA(+)、CK5/6(+)、P63(+)、Ki67(<5%)+、S-100(-)、CK8/18(-),见图1B;部分细胞及小囊腔内AB-PAS、PAS阳性,见图1C。
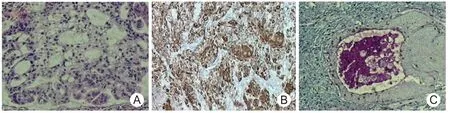
图1 肺黏液表皮样癌病理表现
2.4 病理诊断 (左全肺)MEC,切缘未见癌组织,支气管断端未见癌组织,支气管见癌组织浸润,肺被膜未受累;(支气管旁、隆突下、主动脉旁、下肺韧带旁、气管上)淋巴结见癌组织转移(13/13、3/3、3/3、1/1、1/2)。
3 讨论
3.1 MEC病理特征及分类 MEC是涎腺常见的一种恶性肿瘤,常见于腮腺,后来有报道显示肺、支气管及乳腺等部位也可发生[3]。肺原发性MEC起源于支气管黏膜下腺体的导管上皮,多为支气管内的恶性肿瘤,其发病率较低,4~78岁均有发生,近半数发生在30岁以下,且发病年龄比肺癌要早,发病率与性别无关,约占原发性恶性肿瘤的0.1% ~0.2%[4]。肺MEC在组织病理学上的表现与发生于腮腺的MEC基本一致,尽管本例肿物发生于一侧肺叶内,但在肿瘤局部区域仍可找到肿瘤细胞与细支气管柱状黏液细胞的移行区域,这对肿瘤的起源有重要意义。显微镜下观察可见3种细胞,即表皮样细胞、黏液腺细胞和分化较差的间质细胞。表皮样细胞间可见细胞间桥,但无角化不全,部分细胞呈透明样改变,个别病例内见灶状嗜酸性化生。黏液腺细胞可排列成腺腔样结构,细胞内可见黏液颗粒,细胞外可见大量黏液,其黏液含量远比腺样囊性癌要多。分化较差的间质细胞量少。将MEC分为低度恶性型(高分化)和高度恶性型(低分化)两类:低度恶性型者占MEC的75% ~80%,大体为球形,灰白灰黄色,肿瘤相对较小,包膜可有可无,界限清楚,切面呈灰白或灰黑色,多为结节分叶状,见多少不等的小囊腔,并含黏液。黏液细胞呈柱状或立方状,且常形成大小不等的腺腔,表皮细胞上可有黏液细胞覆盖、也可夹杂于表皮细胞间,鳞状细胞呈圆形或多边形,过渡型细胞较少,可形成不规则的小片状。上述各种细胞分化好,异型性不明显,核分裂象及坏死灶不常见。而高度恶性型者大体无包膜,界限不清,呈浸润性生长,切面灰白色,质硬,不分叶,可见散在小囊腔,主要为中间型细胞、表皮细胞和过渡型细胞,黏液细胞少。有的可见充满黏液的囊腔,或有单个黏液细胞散在。瘤细胞异型性明显,有明显核分裂象及坏死灶,实性区多,囊腔少,并见周围明显的浸润。肿瘤分化低时可做免疫组化及特殊染色等辅助方法以确诊及鉴别诊断。
3.2 鉴别诊断
3.2.1 实性黏液细胞腺癌:两者均含有黏液细胞,但实性黏液癌是腺癌,主要由分化不等的黏液细胞构成,很少或几乎不形成腺管,间质为中等量纤维组织,与肺组织分界清楚。癌细胞分化好者呈印戒状,核较小偏位,胞浆内充满黏液,呈半透明状,PAS染色呈强阳性;分化差者,细胞较小,核居中,胞浆内含有黏液不明显;分化中等者,细胞中等大小,核居中或稍偏位。这些癌细胞相互过渡,无明显分界。核分裂象不多见。MEC中CK7、CK5/6为阳性,实性黏液细胞腺癌CK5/6为阴性,有助于鉴别二者。
3.2.2 黏液腺癌:尽管两者都含有黏液细胞,且分泌AB及PAS染色阳性的黏液,很容易与高分化的MEC相混淆。可是黏液腺癌既不含表皮样细胞和中间型细胞也不含鳞状细胞及过渡型细胞,其主要由黏液细胞形成大小不一、形状各异的腺样结构,腺管上皮细胞呈柱状、胞浆较清晰,核位于基底部,腺腔内充满黏液,或在邻近间质内见有黏液湖形成。癌组织间质较少,或中等量。而MEC常位于支气管黏膜下,呈浸润性生长,在黏液腺周围存在着多少不等的表皮细胞或中间型细胞及过渡型细胞。
3.2.3 腺样囊性癌:该病是支气管较常见的涎腺型肿瘤,尤其是实性腺样囊腺癌,可有局灶性筛状、管状结构及黏液分泌,与MEC较难鉴别。腺样囊性癌的肿瘤组织由腺上皮和肌上皮细胞构成,均较小,核深染,细胞异型性不明显,排列呈小梁状、实性条索、腺管样或筛状结构,且管腔或筛孔内常见嗜酸或嗜碱性黏液,肿瘤间质可有黏液样变性。免疫组化显示:MEC中CK7阳性,肌上皮P63阳性,而腺样囊性癌中P63为阴性有助于区别两者。
3.2.4 腺鳞癌:此病主要与高度恶性的MEC鉴别。腺鳞癌多位于肺外周部,既有腺癌的成分又有鳞癌的成分,但并不在同一细胞巢中出现,一般也不会出现在表皮细胞间穿插散在黏液细胞以及表皮细胞围绕黏液腺体生长的现象。鳞癌成分可见角化珠形成,其中一种成分最少要占整个肿瘤成分的10%,当腺癌成分形成实性巢团伴有黏液成分时,在诊断上很容易与高度恶性MEC混淆,文献报道部分病例无法完全区分两者[5]。最后应注意的是,如果见有明显角化的表皮细胞,可首先考虑为腺鳞癌。
3.3 治疗 肺MEC的治疗以手术切除为最有效的治疗方法,低度恶性的肺MEC局部侵袭及转移罕见,手术彻底切除,预后良好,也有资料显示,单独放或化疗均具有明显效果[6]。且发生于儿童及年轻成人的肺MEC大多数都是低度恶性的,极少数为高度恶性[7]。高度恶性的肺MEC比较罕见,其癌组织侵袭性大,并可发生远距离转移,因而预后不佳[8]。近年来,靶向治疗开始应用于高度恶性的肺MEC,期待它有更显著的疗效[9]。
[1]Leon Barnes J W,Eveson J W,Reichart P,et al.World Health Organization classification of tumours.Pathology and genetics oftumours of head and neck[M].Lyon:IARC Press,2005:209-281.
[2]刘顺林.肺黏液表皮样癌三例分析[J].新医学杂志,2011,42(4):266-267.
[3]熊汉真,刘少颜,江庆萍.一例肺黏液表皮样癌临床病理观察并文献复习[J].海南医学杂志,2010,21(4):34-36.
[4]高阳,陈胜喜,罗万俊,等.肺黏液表皮样癌的临床研究[J].中南大学学报:医学版,2008,33(11):1047-1049.
[5]Brassesco M S,Valera E T,Lira R C,et al.Mucoepidermoid carcinoma of the lung arising at the primary site of a bronchogenic cyst:clinical,cytogenetic,and molecular findings[J].Pediatr Blood Cancer,2011,56(2):311-313.
[6]顾伟勇,刘伟,何妙侠,等.肺黏液表皮样癌12例临床病理分析[J].临床与实验病理学杂志,2011,27(10):1067-1069.
[7]于长海,尹静,刘颖,等.肺黏液表皮样癌的外科治疗与预后分析[J].临床肺科杂志,2010,15(3):342-343.
[8]宋丽,范理宏.非小细胞肺癌综合治疗现状[J].临床肺科杂志,2009,14(1):83-84.
[9]阮军忠,韩呜,支修益.原发性肺部低度恶性肿瘤的临床特点和外科治疗[J].结核病与胸部肿瘤,2002,5(4):254-258.

