颞叶起源的多形性黄色星形细胞瘤的临床特征
吕超漆松涛 杨开军徐波涛王克万王洪筱
多形性黄色星形细胞瘤(Pleomorphic xanthoastrocytoma,PXA)是一种少见的低度恶性颅内胶质源性肿瘤,好发于颞叶,与癫痫外科关系密切,药物治疗效果常不理想。本文回顾了2004年1月至2012年1月在我科治疗并经病理证实的9例颞叶PXA病例,对其临床资料和随访结果进行分析,报道如下。
1 资料与方法
1.1 一般资料 病例入选标准:①术前影像检查提示存在颞叶占位;②有明显的症状或体征,保守治疗无效,在我科开颅行肿瘤切除术;③能够配合完成病史询问和体格检查;④术后病理证实为PXA或者APXA;⑤术后随访时间不少于1年。病例排除标准:①存在颞叶以外的病变区域;②既往接受开颅手术者。按此标准回顾2004年1月至2012年1月在我科接受手术治疗并最终诊断为颞叶PXA或APXA的病例,共纳入9例。其中男5例,女4例;术后病理诊断提示8例PXA(WHO II级),1例APXA(WHO III级)。
1.2 方法 使用我院电子病历系统检索自2004年1月至2012年1月在我科接受手术治疗并最终诊断为颞叶PXA或APXA的病例,重点搜集患者起病年龄、病程、疾病发作形式、发作频率、术前口服抗癫痫药物情况以及治疗效果;通过电子影像系统搜集相关病例的检查影像(T1WI、T2WI、FLAIR序列以及增强影像)、显微病理照片(HE染色以及免疫组化染色);随访资料来源于我科患者资料库,对患者手术半年后癫痫控制情况、服药情况、复查影像、药物减量及停用时间等资料进行整理。
1.3 手术方式及术后处理 手术选择翼点入路,术中暴露颞叶皮层后以栅格电极行术中皮层脑电监测,确定致痫灶是否与病变区吻合。若病灶累及颞叶前2/3或以上,则行标准前颞叶切除;如病灶累及海马、杏仁核等结构,则一并切除。根据术中快速冰冻病理结果确定是否需要扩大切除。手术结束后在禁食期间予静脉持续泵注丙戊酸钠(0.8g/d),可以进食后逐渐过渡至口服卡马西平(0.1g,3次/d)继续抗癫痫治疗,至少2年。根据术后病理结果决定是否进行辅助性放化疗。
1.4 疗效随访及手术预后判定 术后随访1~7年,包括癫痫发作情况(手术半年后)、抗癫痫药物使用情况以及术后肿瘤是否复发等。手术后癫痫控制评价参考2001年ILAE推荐的标准[1]。
2 结果
2.1 临床特点 9例患者均以部分性癫痫发作为临床表现,发作形式包括简单部分性发作1例,复杂部分性发作5例,继发全面性发作3例。起病年龄7~52岁,中位起病年龄17岁。病程1d至5年,中位病程1.5年。发作频率1次/月~180次/月。2例患者术前曾口服抗癫痫药物,其中1例口服丙戊酸钠(0.4g,2次/日;服用13个月)、1例口服卡马西平(0.1g,3次/日;服用8个月),2例患者服药均不能有效控制癫痫发作。
2.2 术前影像及脑电检查结果 影像提示的病灶呈类圆形或不规则形态,4例可见同侧侧脑室额角受压,颅内中线结构轻度移位(图1 A)。病灶范围最小者1.5cm×1.8cm×1.3cm,最大者4.8cm×4.5cm×3.7cm。CT多表现为边界清楚的不均质低密度或等密度病变(图1 A),无钙化,多数瘤周伴有轻度水肿。MRI影像上病灶边界清楚,伴囊性变,7例伴有典型的壁结节形成(图1 B),肿瘤周边有轻至中度水肿;T1WI呈低信号-等信号的混杂影像(图1 B),T2WI呈等信号-高信号混杂影像(图1 C),FLAIR序列影像表现为瘤壁和瘤周水肿带不均质高信号(图1 D),病灶增强不显著或表仅瘤壁强化(图1 E~F)。
发作间期头皮脑电背景节律以9~10Hz,30~60µV的α波为主,间有16~22Hz,10~15µV的β波,病变侧颞区频发中-高波幅尖波(图2 A);发作前可见病变侧颞区爆发连续尖波,随后全导爆发尖波,伴随大量肌电干扰(图2 B);亚临床发作期可见病变侧颞区爆发连续慢活动,杂有尖波(图2 C)。
2.3 治疗与预后 9例患者中7例行标准前颞叶切除,其中5例一并切除病变侧海马、杏仁核等结构;2例仅行颞叶占位切除。全部患者达到镜下肿瘤全切除。术中1例肿瘤边界清晰,其余8例边界模糊但尚可辨认,肿瘤无包膜,血供不丰富,全部病例不同程度的向周边脑实质浸润。3例患者术后出现颅内感染,无永久性严重并发症。对1例病理呈间变性改变的患者行术后行辅助放疗。术后随访结果1级7例,2级2例,无3~6级病例;6例患者已停用抗癫痫药物,2例患者正在减量(0.1g,隔日3次);已停药患者术后服药2~4年不等,中位术后服药时间2.33年;所有病例术后肿瘤无复发。
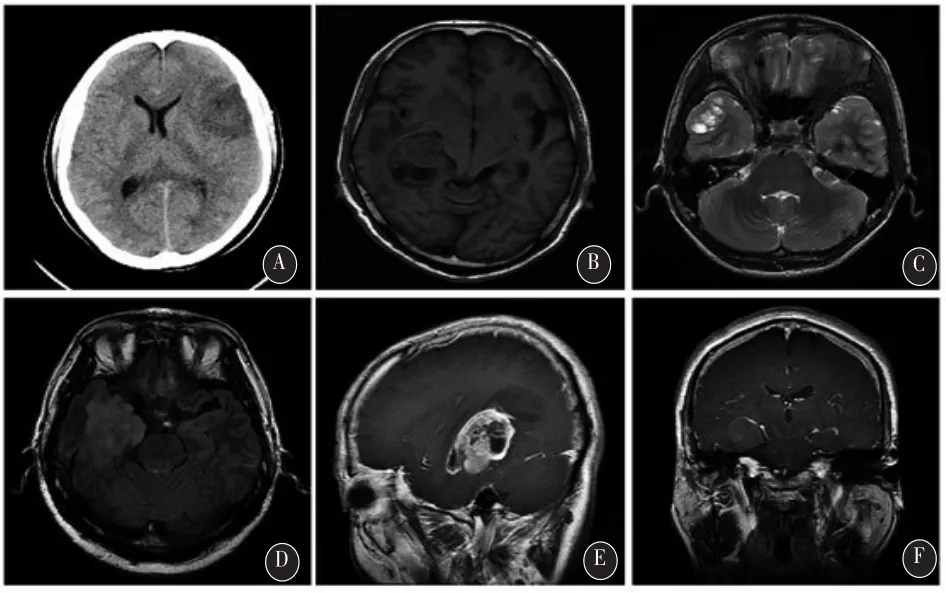
图1 PXA的影像学表现。
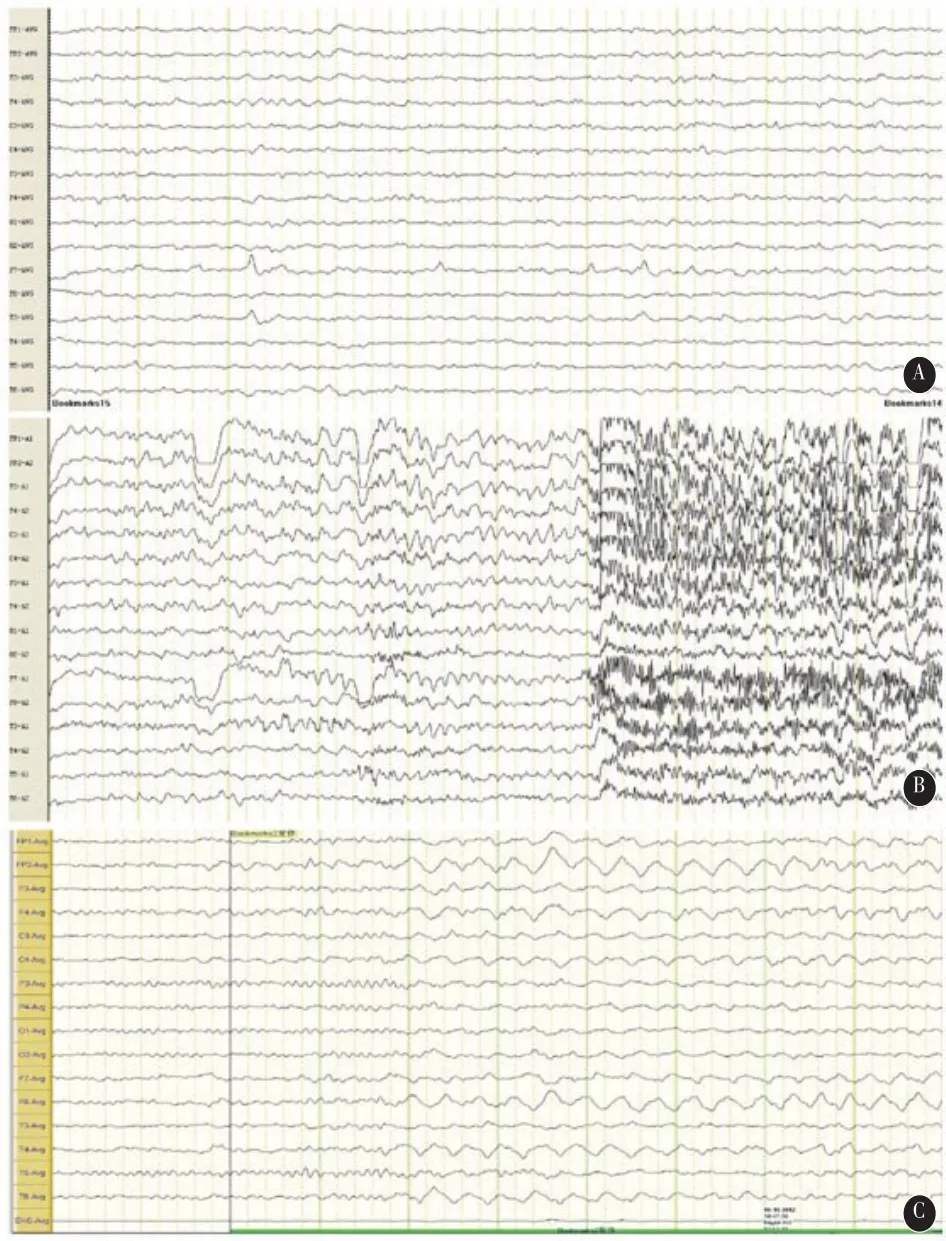
图2 PXA的脑电图表现。
2.4 病理学结果 8例多形性黄色星形细胞瘤,WHO II级;1例间变性多形性黄色星形细胞瘤,WHO III级。肿瘤剖面呈灰白或灰红色,鱼肉状,部分囊变区含有清亮的淡黄色囊液。7例以多形性细胞为主(图3 A),可见瘤样改变的多核巨细胞,胞浆呈泡沫样外观(图3 B);2例以梭形细胞为主(图 3 C);1 例可见核分裂相(图3 D),无坏死;8例可见典型的嗜酸性小体;9例均有淋巴细胞浸润。免疫组化病理提示全部病例GFAP(++)(图3 E)、S-100(+~++),Ki-67<3%(图 3 F),部分病例P53(+)、CD68(+)、oligo-2(+)。
3 讨论
3.1 PXA临床特征 PXA与癫痫外科的关系十分密切,虽然发生率不足全部星形细胞瘤的1%[2],但PXA相关的癫痫在颅内肿瘤所致癫痫中的比例可达到3.9%~6.9%[3]。PXA好发于儿童和青少年,平均起病年龄轻,疾病分布无性别差异。发生部位有明显的倾向性,好发于幕上皮质,尤其是颞叶皮质。约70%~80%患者以癫痫发作为首发症状[5],而发生于颞叶者几乎全部以癫痫起病,复杂部分性发作是最常见的发作形式[3-5],抗癫痫药物治疗效果较差,常需要外科干预以控制或缓解癫痫的发作。这些特点与本组病例临床资料相一致。
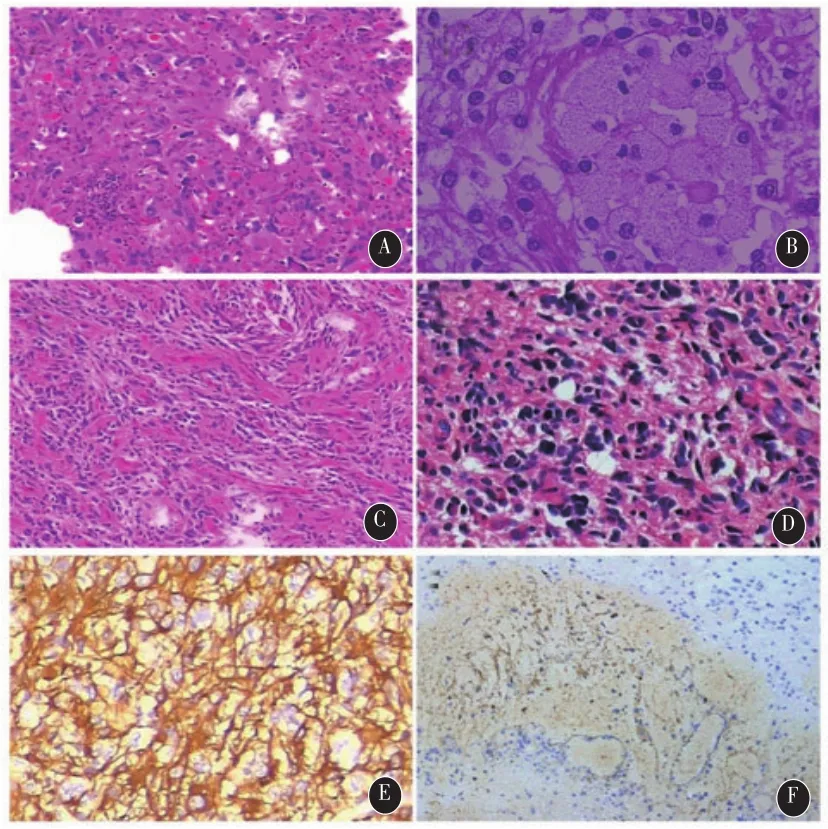
图3 PXA的镜下病理改变和免疫组化染色。
3.2 PXA影像、病理特征 发生于颞叶的PXA与发生于颅内其他部位的PXA的影像学表现相似,囊性变伴附壁结节是最典型的影像学表现[6-8]。PXA生长缓慢,甚至在一定时期内可呈静止性状态。瘤周水肿轻,乏血供性表现均提示PXA恶性程度不高,但部分PXA表现出占位推挤效应,提示其仍具有恶性肿瘤的特征。典型的PXA病理表现为肿瘤细胞弥漫分布或呈梭状排列,细胞多形性明显,可见单核或多核的瘤巨细胞,胞浆丰富嗜酸性,核深染,乏核分裂相,但APXA中可见核分裂,胞浆含有透明蛋白物质和脂滴呈泡沫细胞样,可见嗜酸性小体,伴淋巴细胞浸润,APXA中可伴局部组织坏死等表现。免疫组化GFAP(+),S-100(+)提示PXA来源于软脑膜下星形细胞[9],但部分细胞NeuN、MAP-2、NF和Syn表达阳性,有学者认为其可能来源于多潜能干细胞或神经胶质祖细胞[8]。
3.3 PXA的手术治疗方式 颞叶PXA进行手术切除是控制癫痫发作的有效方法。目前公认的意见是应尽量争取病灶全切除,而是否进行病灶扩大切除则较有争议。本组病例中有7例经术中皮层脑电证实存在病灶区域外皮层痫样放电区,这种现象在颞叶癫痫患者,尤其是病程超过1年的病例中较常见,因此术中皮层脑电监测对于病变区域外致痫灶的发现、决定手术切除范围和保证手术效果十分重要。术中扩大切除的指征包括:①术中快速冰冻病理提示III级或以上的星形细胞瘤;②术中皮层脑电监测提示存在病变区域外致痫灶;③累及前颞叶2/3或以上。对于存在继发全身性发作的病例,根据术中脑电监测结果决定是否一并切除颞叶内侧结构。
3.4 PXA预后 PXA相关的癫痫手术治疗效果和预后较好,尤其是发生于颞叶的PXA,Wallace等[3]研究也得出类似的结论。PXA患者术后患者5年和10年的总体生存率分别达80%和70%以上,无瘤生存率则分别为达49%~72%和61%[4,5]。本研究中9例患者最长随访时间达7年,其中1例APXA患者随访5年,7例患者癫痫发作完全缓解,2例仅有先兆发作,所有病例未观察到肿瘤复发。术后卡马西平初始治疗剂量为0.1g,3次/d,术后癫痫控制效果明显优于术前(术前仅1例服用卡马西平,0.1g,3次/d),所有患者(包括6例停药患者)未再出现癫痫临床发作。
3.5 PXA和APXA的辅助治疗 初诊PXA是否应进行术后辅助性放疗尚无确定的说法。Rao等[4]的研究中,7例仅行肿瘤大部分切除而未进行辅助性放疗的患者中,6例在1年之内复发,这提示术后辅助性放疗可能对于未达肿瘤全切除患者有一定的临床意义。尽管有病例报道PXA完全切除后出现复发和进展[10],但对于达到肿瘤全切除的PXA患者,是否需要术后辅助放疗仍值得探究。Perkins等[5]对214例PXA患者进行回顾性分析发现首次手术能够达到病灶全切除的病例,不需要术后辅助的放疗,预后仍然较好,这与我们的研究结果类似,我们认为对于术中达到完全切除的WHO II病例,可以不给于辅助放疗,但长期随访和复查是必要的;对于APXA,仍需按照高级别星形细胞瘤进行必要的术后辅助放疗以获得良好的预后。
[1]Wieser HG,Blume WT,Fish D,et al.ILAE Commission Report.Proposal for a new classification of outcome with respect to epileptic seizures following epilepsy surgery[J].Epilepsia,2001,42(2):282-286.
[2]Giannini C,Paulus W,Louis DN,et al.Pleomorphic xanthoastrocytoma.In:Louis DN,Ohgaki H,Wiestler OD,Cavene WK,editors.World Health Organization classification of tumours.WHO classification of tumours of the central nervous system[M].4th ed.Lyon:IARC Press,2007:22-24.
[3]Wallace DJ,Byrne RW,Ruban D,et al.Temporal lobe pleomorphic xanthoastrocytoma and chronic epilepsy:long-term surgical outcomes[J].Clin Neurol Neurosurg,2011,113(10):918-922.
[4]Rao AA,Laack NN,Giannini C,et al.Pleomorphic xanthoastrocytoma in children and adolescents[J].Pediatr Blood Cancer,2010,55(2):290-294.
[5]Perkins SM,Mitra N,Fei W,et al.Patterns of care and outcomes of patients with pleomorphic xanthoastrocytoma:a SEER analysis[J].Neurooncol,2012,110(1):99-104.
[6]余深平,贺李,庄晓曌,等.脑多形性黄色瘤型星形细胞的临床与MRI特征分析[J].中国神经精神疾病杂志,2009,35(8):467-470.
[7]Yang WQ,Huang B,Liang CH.Pleomorphic xanthoastrocytoma in the lateral ventricle with extensive subarachnoid dissemination:report of a case and review of the literature[J].Chin Med J(Engl),2012,125(2):396-399.
[8]Sugita Y,Irie K,Ohshima K,et al.Pleomorphic xanthoastrocytoma as a component of a temporal lobe cystic ganglioglioma:a case report.Brain Tumor Pathol,2009,26(1):31-36.
[9]Hirose T,Ishizawa K,Sugiyama K,et al.Pleomorphic xanthoastrocytoma:a comparative pathological study between conventional and anaplastic types[J].Histopathology,2008,52(2):183-193.
[10]Alexiou GA,Moschovi M,Stefanaki K,et al.Malignant progression of a pleomorphic xanthoastrocytoma in a child[J].Neuropediatrics,2010,41(2):69-71.

