烟曲霉在不同温度和营养条件下的生长特性初探
张晋卿 刘伟 谭静文 万喆 李若瑜
(北京大学第一医院皮肤性病科 北京大学真菌与真菌病研究中心 皮肤病分子诊断北京市重点实验室,北京 100034)
侵袭性曲霉病 (invasive aspergillosis,IA)是一种严重威胁生命的疾病,在白血病和骨髓移植受者等免疫受损机体中病死率超过90%[1]。烟曲霉是引起IA的最主要致病菌,约占90%[2],目前其对人体的致病机制尚不清楚[3-4]。无论是在外界环境中还是进入机体内,烟曲霉都面临生存环境的变化,这些变化统称为应激[5-6],其中生存环境温度的变化是烟曲霉面临的最基本的应激。温度是影响微生物生长的重要因素之一,不同物种对环境温度变化具有不同的适应能力[7]。烟曲霉被认为是一种耐热真菌,这种特性使其对环境变化的抵抗力更强。有研究发现,在30~42℃间,烟曲霉都能较好的生长[8],此外,在对肥料发酵的研究中发现,烟曲霉能抵御60~80℃高温[9]。但是,对于烟曲霉耐受高温的程度在以往研究中并没有确切的描述。
本研究通过测定烟曲霉在不同温度下的生长曲线及其在更高温度下的存活率,确定烟曲霉的最适生长温度、最高生长温度及致死温度,从而对烟曲霉耐高温生长的生理学特性有更准确的认识。
1 材料和方法
1.1 材料
菌株来源 烟曲霉AF293(分离自1例IA患者,美国德克萨斯大学MD安德森癌症中心Dimitrios P.Kontoyiannis教授惠赠)和DAL(法国巴斯德研究院Jean-Paul Latgé教授惠赠)均为基因组测序菌株。实验开始前菌株在马铃薯葡萄糖琼脂培养基 (Potato Dextrose Agar Medium,PDA.Difco Laboratories,Detroit,USA)上37℃活化 5 ~7 d。
1.2 方法
不同培养基对烟曲霉生长的影响 取37℃生长5~7 d的烟曲霉孢子,用0.1%Tween80缓冲液制成菌悬液,用血细胞计数板调整孢子浓度为1×106cells/mL。继续用0.1%Tween80缓冲液稀释孢子,使终浓度为2×104cells/mL。配制2倍浓度酵母浸膏 (yeast extract medium,YG)、酵母氮源基础 (yeast nitrogen base,YNB;Difco Laboratories,Amsterdam,The Netherlands)和曲霉基础 (minimal medium,MM)液体培养基,加入96孔板,每孔100 μL。加入上述菌悬液100 μL/孔,使每孔中孢子浓度为 1 × 104cells/mL[10]。对 照 组 加 入 0.1%Tween80缓冲液100 μL/孔。实验组及对照组均设8孔重复。将96孔板放入37℃温箱,间隔一定时间用吸收光酶标仪 (BioTek,美国)测量405 nm吸光度,连续测量96 h,绘制生长曲线。实验在相同条件下重复3次。如果两菌株间数据无统计学差异,则合并数据绘制生长曲线;如果二者之间具有统计学差异,则分别绘制生长曲线。
温度对烟曲霉生长的影响 生长曲线法:方法同上,温度设定以菌株获得最快生长的温度为基础并参考文献中报道的烟曲霉能够生长的最高温度[8-9],如果菌株在此温度仍能生长,则升高温度2℃,直至获得斜率最低的生长曲线,对应的温度为菌株最高生长温度。菌落计数法:取37℃生长5~7 d的烟曲霉孢子,用0.1%Tween80缓冲液制成菌悬液,用血细胞计数板调整孢子浓度为1×106cells/mL。连续稀释孢子浓度为1×103cells/mL。取100 μL菌悬液均匀涂布于酵母浸膏固体培养基(yeast extract agar medium,YAG)上,给予不同温度刺激 (65℃,70℃)一定时间后 (0 min,15 min,30 min,45 min,60 min,75 min,90 min,105 min,120 min,150 min及180 min),将平皿转移至37℃温箱继续孵育20~24 h,计数菌落个数并绘制活力曲线,最终确定烟曲霉的致死温度。每次实验在同一条件下设三个平行对照,实验在相同条件下重复3次。如果两菌株间数据无统计学差异,则合并数据绘制活力曲线;如果二者之间具有统计学差异,则分别绘制活力曲线。
1.3 统计学处理
采用SPSS 13.0统计软件进行统计学分析。两菌株间差异采用独立样本t检验进行比较,P<0.05为差异具有统计学意义。
2 结 果
2.1 YG是测定烟曲霉生长曲线的最适宜培养基
烟曲霉在YG培养基中生长最快,对数生长期约开始于12~20 h,到约60 h时进入第二生长过渡期;在YNB培养基中菌株直到约60 h时才进入对数生长期,但进入此期后生长速度较快;在MM培养基中,菌株生长最慢 (见图1)。
2.2 烟曲霉温度生长曲线的确定
根据上述结果,YG培养基最适宜用来观察温度对烟曲霉生长的影响。由烟曲霉在不同温度下的生长曲线可知,在YG培养基中,37℃是烟曲霉的最适宜生长温度,52℃为其最高生长温度,当温度为54℃时,菌株无可见生长 (见图2a,2b)。随着温度的升高,菌株的生长速度逐渐减慢,但两株烟曲霉菌株对高温的反应不完全一致。烟曲霉AF293在48℃时较37℃生长明显缓慢,96 h时菌株仍未进入第二生长过渡期 (见图2a);而烟曲霉DAL虽然在48℃时较37℃更晚进入对数生长期,但进入对数生长期后生长速度较快,且与37℃菌株几乎同时进入第二生长过渡期 (见图2b)。
此外我们还发现,虽然烟曲霉在高于52℃的环境下几乎无可见生长,但仍然保持活力,在54℃孵育96 h后转入37℃,菌株能获得与孵育在37℃的菌株一样的生长。
2.3 烟曲霉致死温度的确定
当两株烟曲霉菌株的孢子在65℃下刺激的时间<60 min时,仍有80%以上的孢子能形成菌落;当刺激时间为75 min时,有约50%的孢子能形成菌落;而当刺激180 min后,所有孢子都无法形成菌落,菌株不可逆失活。70℃刺激使孢子失活的时间更短,刺激120 min后,菌株即不可逆失活 (见图3)。
3 讨 论
丝状真菌的生长可分为5个阶段,分别是静止期、第一过渡期、对数生长期、第二过渡期及稳定期。在第一过渡期时,孢子开始肿胀发芽,但菌丝延长不明显,生长曲线较平滑,表现出缓慢上升趋势;当处于对数生长期时,菌丝生长速度最快,生长曲线达到最大斜率;当处于第二过渡期时,菌丝延伸速度下降,生长曲线斜率下降,再次变得平滑[10]。生长曲线能够直观的反映出丝状真菌的生长情况,因此,我们应用生长曲线法评价烟曲霉的生长状况。我们选用了三种研究曲霉生理特性时较常用的培养基:YG培养基营养丰富,除了必需成分外,还含有微量元素和维生素,特别利于菌株生长;MM培养基成分与察氏培养基类似,但严格限定了pH值,在研究不同营养成分、不同酸碱环境对菌株生长的影响时可以精确改变营养条件;YNB培养基中无碳源,可以用来研究菌株对不同碳源的利用情况。在我们的研究中发现,相同温度下,YG培养基中测得的生长曲线能更完整的反映出烟曲霉的生长周期,最适宜用来观察温度对烟曲霉生长的影响。
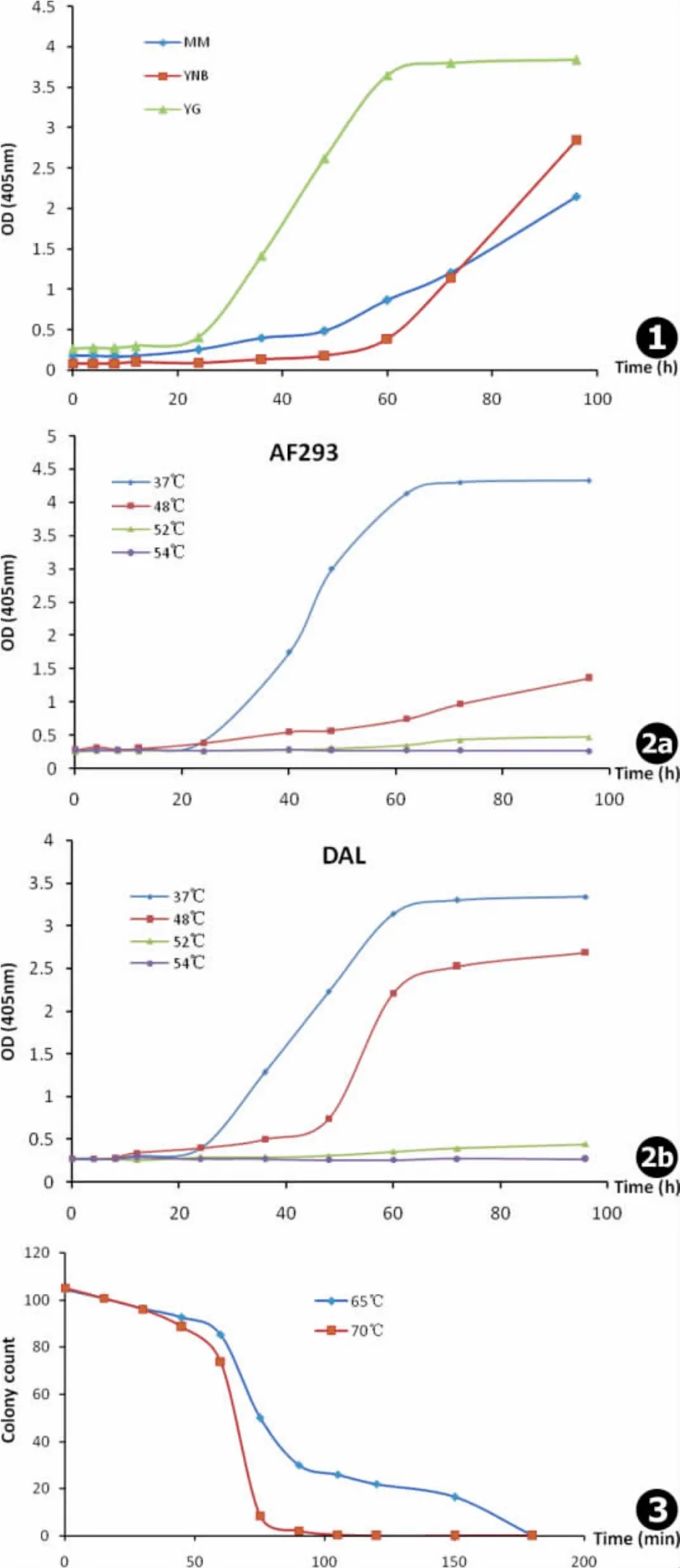
图1 两株烟曲霉菌株在不同培养基中的生长曲线(MM.曲霉基础培养基,YNB.酵母氮源基础培养基,YG.酵母浸膏培养基) 图2 烟曲霉在不同温度下的生长曲线:a.AF293,b.DAL 图3 两株烟曲霉菌株在高温下的活力曲线Fig.1 The growth curves of Aspergillus fumigatus in different nutrient media(MM.minimal medium,YNB.yeast nitrogen base medium,YG.yeast extract medium) Fig.2 The growth curves of Aspergillus fumigatus at different temperatures Fig.3 Colony counts of Aspergillus fumigatus at high temperatures
虽然研究普遍认为烟曲霉是一种耐热真菌,但对其耐受高温的程度,并没有确切的描述。我们发现,在YG培养基中,烟曲霉的最适宜生长温度为37℃,在此温度下其生长最好。这也是烟曲霉容易感染人体的一个重要原因。当温度达到48℃时,烟曲霉的生长受到一定程度的抑制,但在不同菌株中情况并不完全一致:在AF293中观察到,菌株的生长受到明显的抑制,第一生长过渡期延长,菌株进入对数生长期时间延长,生长曲线斜率较37℃明显下降;而在DAL中却观察到,虽然菌株第一生长过渡期延长,但进入对数生长期后,菌株的生长并未减缓。当温度达到52℃时,两株烟曲霉菌株均表现出明显的生长受抑,生长曲线斜率最小。以往关于真菌对温度耐受的研究中,多集中于30℃到37℃或42℃的温度改变引起的转录水平或蛋白水平的变化[11]。由于烟曲霉是一种耐热真菌,研究发现30~37℃的温度改变不足以引起其与毒力相关的基因表达发生改变[12]。因此,其后对烟曲霉热休克反应的研究多将刺激温度选为48℃[13-14]。但是我们发现,烟曲霉菌株在48℃时仍具有良好的生长能力,并且不同的菌株对48℃的反应不完全一致;当温度达到52℃时,两株烟曲霉才表现出明显的生长受抑。该结果提示,在烟曲霉对高温耐受的研究中,应该选择52℃作为刺激条件。
既往研究认为烟曲霉能够耐受肥堆的高温发酵阶段[9],但其致死温度不清楚。因此,本研究还测定了烟曲霉菌株的致死温度;致死温度指一定条件下和一定时间内杀死微生物的最低温度[15]。我们发现,65℃持续刺激180 min或70℃刺激120 min可完全杀死烟曲霉。由于高于70℃的温度会使固体培养基熔化,因此我们无法得到高于70℃时烟曲霉的致死条件。这有待于在将来的研究中改进实验方法以阐明。
本研究中得到的烟曲霉最适生长温度、最高生长温度及致死温度虽然具有一定的代表性,但仍需在未来研究中扩大样本量以验证;我们的结果也提示,无论是以标准菌株还是临床菌株为研究对象,都需要预先了解该菌株的生理特性,以合理选择实验条件。
[1]Brakhage AA.Systemic fungal infections caused byAspergillusspecies:epidemiology,infection process and virulence determinants[J].Curr Drug Targets,2005,6(8):875-886.
[2]Messer SA,Jones RN,Fritsche TR.International surveillance ofCandidaspp.andAspergillusspp.:report from the SENTRY Antimicrobial Surveillance Program(2003)[J].J Clin Microbiol,2006,44(5):1782-1787.
[3]Ana Abad,Jimena Victoria Ferna 'ndez-Molina,Joseba Bikandi et al.What makesAspergillus fumigatusa successful pathogen?Genes and molecules involved in invasive aspergillosis[J].Rev Iberoam Micol,2010,27(4):155-182.
[4]Alp S,Arikan S.Investigation of extracellular elastase,acid proteinase and phospholipase activities as putative virulence factors in clinical isolates ofAspergillusspecies[J].J Basic Microbiol,2008,48(5):331-337.
[5]Ikner A,Shiozaki K.Yeast signaling pathways in the oxidative stress response[J].Mutat Res,2005,569(1-2):13-27.
[6]Hartmann T,Sasse C,Schedler A,et al.Shaping the fungal adaptome--stress responses ofAspergillus fumigatus[J].Int J Med Microbiol,2011,301(5):408-416.
[7]Lambrecht SC,Loik ME,Inouye DW,et al.Reproductive and physiological responses to simulated climate warming for four subalpine species[J].New Phytol,2007,173(1):121-134.
[8]Beffa T,Staib F,Lott Fischer J,et al.Mycological control and surveillance of biological waste and compost[J].Med Mycol,1998,36(Suppl 1):137-145.
[9]Ryckeboer J,Mergaert J,Coosemans J,et al.Microbiological aspects of biowaste during composting in a monitored compost bin [J].J Appl Microbiol,2003,94(1):127-137.
[10]Meletiadis J,Meis JF,Mouton JW,et al.Analysis of growth characteristics of filamentous fungi in different nutrient media[J].J Clin Microbiol,2001,39(2):478-484.
[11]Morano KA,Grant CM,Moye-Rowley WS.The response to heat shock and oxidative stress inSaccharomyces cerevisiae[J].Genetics,2012,190(4):1157-1195.
[12]Nierman WC,Pain A,Anderson MJ,et al.Genomic sequence of the pathogenic and allergenic filamentous fungusAspergillus fumigatus[J].Nature,2005,438(7071):1151-1156.
[13]Do JH,Yamaguchi R,Miyano S.Exploring temporal transcription regulation structure ofAspergillus fumigatusin heat shock by state space model[J].BMC Genomics,2009,10:306.http://www.biomedcentral.com/1471-2164/10/306.
[14]Albrecht D,Guthke R,Brakhage AA,et al.Integrative analysis of the heat shock response inAspergillus fumigatus[J].BMC Genomics,2010,11:32.http://www.biomedcentral.com/1471-2164/11/32.
[15] 周德庆.微生物学教程[M].第2版.北京:高等教育出版社,2002:406.

