手术创伤对成年鼠和老年鼠海马区炎性因子表达的影响
曹学照 刘 芳 马 虹 (中国医科大学附属第一医院麻醉科,辽宁 沈阳 000)
手术和麻醉后,很多老年患者出现认知功能下降,被称之为术后认知功能障碍(POCD)。许多病理生理机制已用于解释POCD的可能机制,但确切的机制仍不明确。手术创伤、麻醉和应激可导致患者术前非特异性炎症反应。炎性因子在手术和创伤引起的炎症反应中起到重要作用。本研究拟探讨手术创伤对海马区炎性因子表达的影响。
1 材料与方法
1.1 成年鼠和老年鼠手术创伤模型的建立 雄性成年SD大鼠(3~6月龄)和老年SD大鼠(18~20月龄)分别随机分为对照组(12只)、麻醉组(36只)和手术组(36只)。所有实验动物都维持室温23℃,黑白周期12 h轮转,给与充足的食物和水。所有动物都在这样的环境熟悉7~10 d。对照组SD大鼠不做特殊处理。麻醉组实验动物单纯接受1.5%~2%异氟烷麻醉,行气管插管和机械通气。手术组SD大鼠行肝部分切除术。具体步骤:手术切口处备皮、消毒,在上腹部正中线做一小切口,游离切除左侧肝脏,伤口用0.25%布比卡因浸润,然后用缝线缝合,所有手术步骤均无菌操作。实验鼠在术后1、3、7 d检测海马区白介素(IL)-1β,IL-6和肿瘤坏死因子(TNF)-α mRNA和蛋白表达变化。
1.2 逆转录聚合酶链反应(RT-PCR)检测大鼠术后1、3、7 d海马区炎性因子mRNA的表达
1.2.1 引物设计 应用引物设计软件Primer 5.0设计PCR引物,由大连Takara公司合成引物序列(见表1)。
1.2.2 两步法RT-PCR (1)反转录为cDNA:cDNA的合成主要利用TaKaRa RNA PCR Kit(AMV)Ver.3.0试剂盒合成。(2)PCR 反应:反应体系为 40 μl(5 × 缓冲液10 μl,dNTP 4 μl,上游引物0.5μl,下游引物0.5 μl,Taq聚合酶0.25μl,ddH2O28.75 μl,cDNA 产物 2 μl)。反应条件:退火温度按各引物要求变化,其余反应条件相同。(3)PCR产物检测:PCR反应结束后,用5 μl PCR产物和1 μl GeneFinderTM染料混合,上样至2%琼脂糖凝胶,以100 bp DNA Ladder Marker(TaKaRa,中国)作为DNA片段长度标记,150 V电压下电泳45 min,利用凝胶成像系统,确定是否扩增出目的条带。mRNA的量由特异性基因mRNA和β-actin mRNA的比值来表示。
1.3 免疫蛋白印迹杂交测定IL-1β、IL-6、TNF-α蛋白表达分别裂解各组细胞,收集上清,测定蛋白质浓度,然后按每个电泳孔道加入50 μg蛋白混合样品进行聚丙烯酰胺凝胶电泳,转膜。先后加入一抗(IL-1β、IL-6、TNF-α)和二抗(羊抗兔单克隆抗体)进行杂交。然后进行酶标染色显色,应用图像分析软件分析各电泳条带的蛋白含量。
1.4 统计学方法 计量资料组间比较行两因素方差分析,Student t检验。所得数据以±s表示。
2 结果
2.1 手术创伤对海马区炎性因子mRNA表达的影响 两因素方差分析海马区炎性因子 mRNA的表达显示,时间(P<0.001)和年龄(P<0.001)在IL-1β,IL-6和 TNF-α mRNA上有统计学差异(表2),成年鼠和老年鼠海马区 IL-1β,IL-6和TNF-α mRNA在基础水平存在统计学差异(P=0.041,P=0.012和P=0.035),蛋白水平无统计学差异。单纯麻醉因素没有明显改变成年鼠和老年鼠海马区炎性因子的表达。成年鼠海马区IL-1β和 IL-6 mRNA仅在手术后第1天(P<0.001)明显增高,但老年鼠海马区IL-1β和IL-6 mRNA增多持续到手术后3 d(P<0.001)(表2)。TNF-α mRNA仅在老年鼠手术后1 d(P<0.001)明显增加,在成年鼠没有明显改变(P=0.095)(表2)。这些结果证明手术创伤可明显增加海马区炎性因子的表达,这种改变尤其在老年鼠明显,老年鼠海马区炎性因子表达上调更明显,持续时间更长。见图1。
2.2 手术创伤对海马区炎性因子蛋白表达的影响 利用两因素方差分析海马区炎性因子蛋白的表达显示,时间(P<0.001)和年龄(P<0.001)在IL-1β,IL-6和 TNF-α蛋白上有统计学差异(表3),成年鼠和老年鼠海马区IL-1β,IL-6和TNF-α mRNA蛋白在基础水平无统计学差异。IL-1β和 IL-6蛋白仅老年鼠在术后第1天表达增加(P<0.01;P<0.05),第3天无统计学差异。TNF-α蛋白在成年和老年鼠术后无统计学差异。见图1。
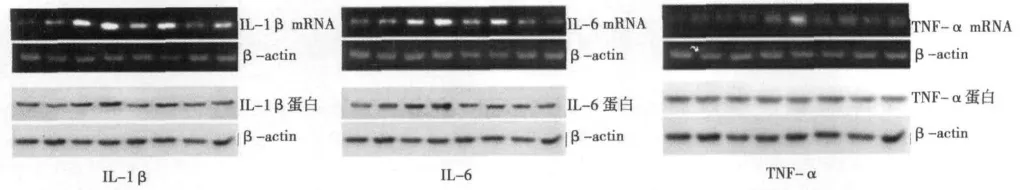
图1 手术创伤对海马区炎性因子蛋白表达

表1 各引物序列及扩增长度
表2 手术创伤对海马区炎性因子mRNA表达(±s,n=12)

表2 手术创伤对海马区炎性因子mRNA表达(±s,n=12)
与成年鼠比较:1)P<0.05;与各自年龄段对照组比较:2)P<0.001
1.39±0.63 1.04±0.23老年 1.26±0.201) 5.73±0.652) 3.73±0.502) 1.26±0.21 IL-6 成年 0.98±0.23 2.29±0.342) 1.285±0.14 1.08±0.24老年 1.22±0.221) 3.43±0.252) 2.25±0.152) 1.16±0.21 TNF-α 成年 0.58±0.12 0.80±0.21 0.64±0.11 0.570.09老年 0.79±0.111) 1.28±0.142)P1 P3 P7 IL-1β 成年 1.01±0.25 3.13±0.852)对照组0.87±0.08 0.74±0.10
表3 手术创伤对海马区炎性因子mRNA表达(±s,n=12)
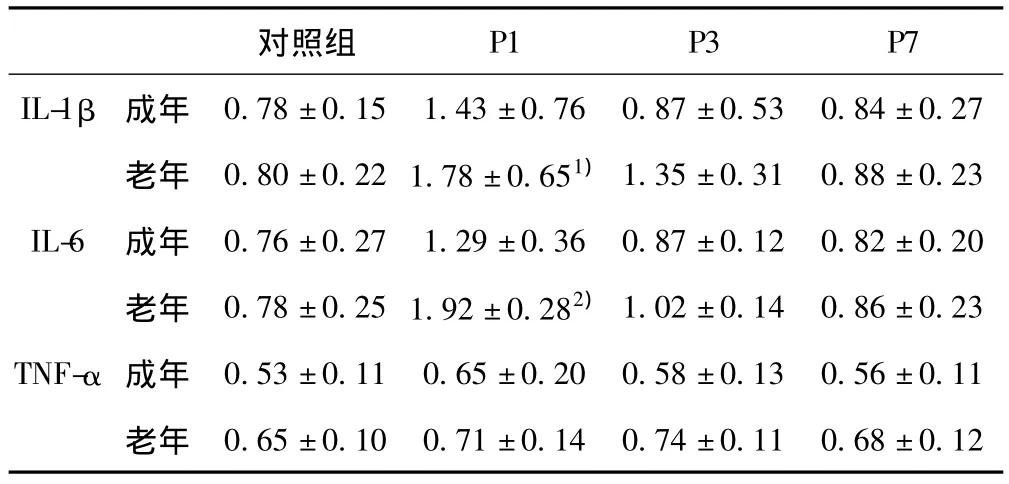
表3 手术创伤对海马区炎性因子mRNA表达(±s,n=12)
与成年鼠比较:1)P<0.05;与各自年龄段对照组比较:2)P<0.001
0.78±0.15 1.43±0.76 0.87±0.53 0.84±0.27老年 0.80±0.22 1.78±0.651)1.35±0.31 0.88±0.23 IL-6 成年 0.76±0.27 1.29±0.36 0.87±0.12 0.82±0.20老年 0.78±0.25 1.92±0.282)1.02±0.14 0.86±0.23 TNF-α 成年 0.53±0.11 0.65±0.20 0.58±0.13 0.56±0.11老年P1 P3 P7 IL-1β 成年对照组0.65±0.10 0.71±0.14 0.74±0.11 0.68±0.12
3 讨论
本实验探讨了手术创伤对成年鼠和老年鼠海马区炎性因子表达的影响。实验证实手术创伤引起了成年鼠和老年鼠海马区IL-1β,IL-6和TNF-α表达的增加。与成年鼠相比,老年鼠海马区炎性因子表达更强烈,持续时间更长。炎性因子表达变化与实验鼠认知功能障碍变化相一致。炎性因子可能介导了实验鼠术后认知功能障碍。许多病理生理机制已用于解释POCD的可能机制,但确切机制仍不明确。已有报道手术创伤、麻醉和应激可导致患者术前非特异性炎症反应〔1〕。炎性因子在手术和创伤引起的炎症反应中起到重要作用。以前的动物实验显示通过注射脂多糖(LPS)激活外周免疫系统可引起外周和中枢神经系统炎症,如IL-1,IL-6,TNF-α,这些炎性因子可通过直接或者间接的机制影响认知功能〔2〕。海马区激活的胶质细胞释放的炎性因子可导致记忆和学习能力的下降,以及长时程增强(LTP)的破坏。与年龄相关的胶质细胞活性的改变可加剧老年患者炎症反应的程度〔3〕,所以老年人术后容易出现认知功能障碍。与成年鼠相比,激活中枢神经免疫系统,老年鼠更容易发生神经炎症反应和认知功能破坏〔4〕。
炎性因子就如同一把双刃剑,它既能保护神经功能,但过量或者长期表达也能起到破坏作用。实验已经证明中枢神经系统大量炎性因子表达可导致运动协调功能和认知功能的破坏〔5〕。海马区是脑内炎性因子受体表达的聚居区,似乎对过量的或者慢性炎性因子表达更敏感〔6〕。在正常生理情况下,炎性因子在中枢神经系统不存在。但在病理状态下表达迅速升高。炎性因子可结合中枢神经系统相应的受体,激活小胶质细胞和血管内皮细胞,引起一系列的炎症反应和其他效应〔6〕。
阻滞脑内炎性因子受体可以改善因激活外周免疫系统引起的行为学抑制。文献证实外源性的IL-1β能够引起免疫反应和认知功能破坏,但侧脑室注射IL-1β受体拮抗剂可改善破坏的认知功能,给予IL-6受体拮抗剂能延长LTP,改善空间记忆能力和改善由于LPS引起的行为学抑制〔7〕。这些研究证实了炎性因子在调节行为学和认知功能方面的重要作用。
综上所述,手术创伤引起了成年鼠和老年鼠海马区炎性因子表达增加,加上我们前期试验已经证实手术创伤引起了成年鼠和老年鼠空间学习记忆能力的损害,炎性因子可能介导了实验鼠术后认知功能障碍。
1 Barrientos RM,Higgins EA,Biedenkapp JC,et al.Peripheral infection and aging interact to impair hippocampal memory consolidation〔J〕.Neurobiol Aging,2006;27(5):723-32.
2 Thomson LM,Sutherland RJ.Systemic administration of lipopolysaccharide and interleukin-1beta have different effects on memory consolidation〔J〕.Brain Res Bull,2005;67(1):24-9.
3 Godbout JP,Johnson RW.Age and neuroinflammation:a lifetime of psychoneuroimmune consequences〔J〕.Neurol Clin,2006;24(3):521-38.
4 Chen J,Buchanan JB,Sparkman NL,et al.Neuroinflammation and disruption in working memory in aged mice after acute stimulation of the peripheral innate immune system〔J〕.Brain Behav Immun,2008;22(3):301-11.
5 Griffin WS,Liu L,Li Y,et al.Interleukin-1 mediates Alzheimer and Lewy body pathologies〔J〕.J Neuroinflammation,2006;3(5):5-14.
6 Parnet P,Kelley KW,Bluthe RM,et al.Expression and regulation of interleukin-1 receptors in the brain:role in cytokines-induced sickness behavior〔J〕.J Neuroimmunol,2002;125(1):5-14.
7 Johnson JD,O'Connor KA,Watkins LR,et al.The role of IL-1beta in stress-induced sensitization of pro-inflammatory cytokine and corticosterone responses〔J〕.Neuroscience,2004;127(3):569-77.

