大鼠羊膜上皮细胞的生物学特性
段现花 王德广 欧阳长杰 曲德伟 (徐州医学院解剖学教研室,江苏 徐州 221002)
羊膜上皮细胞(AECs)起源于胚胎发育时期的胚泡内细胞团〔1,2〕,是将来发育形成胎儿的部分。人受精8 d内细胞团分化成上胚层和下胚层,AECs源于上胚层〔3〕,也有研究表明胚胎干细胞源于内细胞团〔4〕。研究证实,大鼠AECs有趋向上胚层、中胚层和下胚层细胞分化的潜能〔5,6〕,因此大鼠 AECs作为再生医学细胞资源参与疾病治疗已受到广泛关注〔7〕。本研究通过免疫组化和流式细胞仪技术对分离、培养的羊膜干细胞进行鉴定,为细胞移植治疗脊髓损伤提供优良的种子细胞〔8〕。
1 材料与方法
1.1 材料 无特殊病原体(SPF)孕14~16 d的SD大鼠,由徐州医学院动物中心提供。无菌采集羊膜标本。实验中对动物的操作严格参照中华人民共和国科学技术部颁布的《关于善待实验动物指导性意见》中有关规定执行。DMEM/F-12(Gbibo公司),胎牛血清(FBS,杭州四季青),0.25%胰蛋白酶、小鼠nestin抗体、小鼠 β-Ⅲ-tublin抗体、小鼠胶原纤维酸性蛋白(GFAP)抗体、山羊抗小鼠IgG和青霉素-链霉素溶液(PS)(碧云天公司),CD29和CD44抗体(北京博奥森生物技术有限公司)。
1.2 AECs的分离与培养 采用机械法剥离胎盘羊膜组织,用预冷磷酸盐缓冲液(PBS)反复漂洗,除尽表面血迹,于含有适量基础培养基的培养皿中剪碎羊膜至1 mm3左右,转移组织悬液于50 ml离心管中,加入0.25%胰蛋白酶溶液,37℃均匀消化15 min,用含有10%血清的完全培养基终止消化,400目不锈钢滤网过滤,收集单细胞悬液于离心管中,1 200 r/min离心5 min,加入含有10%FBS的完全培养基重悬细胞,用台盘蓝计数细胞密度,以1×106的细胞密度接种于25 ml的培养瓶中,置于37℃、饱和湿度、5%CO2培养箱中培养。1次/3 d换液,1 w后待细胞长满瓶底的90%时进行传代,取第2~3代的细胞进行免疫细胞化学和流式细胞分析。
1.3 大鼠AECs的鉴定
1.3.1 免疫荧光细胞化学 多聚赖氨酸包被爬片的12孔板,取2~3代的rAECs用0.25%胰酶消化、传代,然后接种,细胞达到70%融合时,吸除培养基,用37℃预热PBS漂洗3次,预冷4%多聚甲醛室温固定15 min,PBS漂洗3次,5 min/次,用0.3%Triton-X100室温下孵育15 min,PBS漂洗3次,用含有10%FBS的PBS室温下封闭40 min。吸出后直接加入nestin、β-Ⅲ-tublin或 GFAP抗体,37℃孵育30 min后移入4℃冰箱过夜,次日用PBS漂洗3次,避光条件下加入异硫氰酸荧光素(FITC)标记的羊抗小鼠IgG二抗,37℃孵育2 h,PBS漂洗3次,然后用hochest33258孵育15 min,PBS漂洗3次,荧光显微镜观察并拍照。阴性对照组用PBS代替一抗。
1.3.2 流式细胞术检测细胞表面抗原 用0.25%胰酶消化收集2~3代rAECs于50 ml离心管中,1 200 r/min离心5 min,吸除上清,用适量的PBS漂洗细胞,调整细胞密度为1×106/ml分装于3个10 ml离心管中,1 200 r/min离心5 min,吸除上清,每管加入100 μl PBS重悬细胞,避光条件下加入荧光标记单抗CD29-FITC和 CD44-PE 各 20 μl,对照组加入等量 PBS,混匀,37℃避光孵育30 min后1 200 r/min离心5 min,吸除上清后用PBS漂洗细胞2次并离心,每管加入200~400 μl PBS,混匀,移入流式管中,用流式细胞仪检测细胞表面抗原的表达情况。
2 结果
2.1 大鼠AECs的生长及增殖特点 原代培养1 d后,有少量细胞贴壁;第3天以后,贴壁细胞逐渐增多,形态多为扁平不规则的多角形或梭形,胞体大,胞核呈分裂相。培养1 w后,细胞贴壁牢靠,生长较为旺盛,细胞呈铺路石样紧密排列,汇合度达90%以上时,进行传代培养。传代后的细胞较原代易于贴壁,增殖速度加快。六代以后的细胞增殖逐渐减慢,胞体变大呈扁平样。见图1。
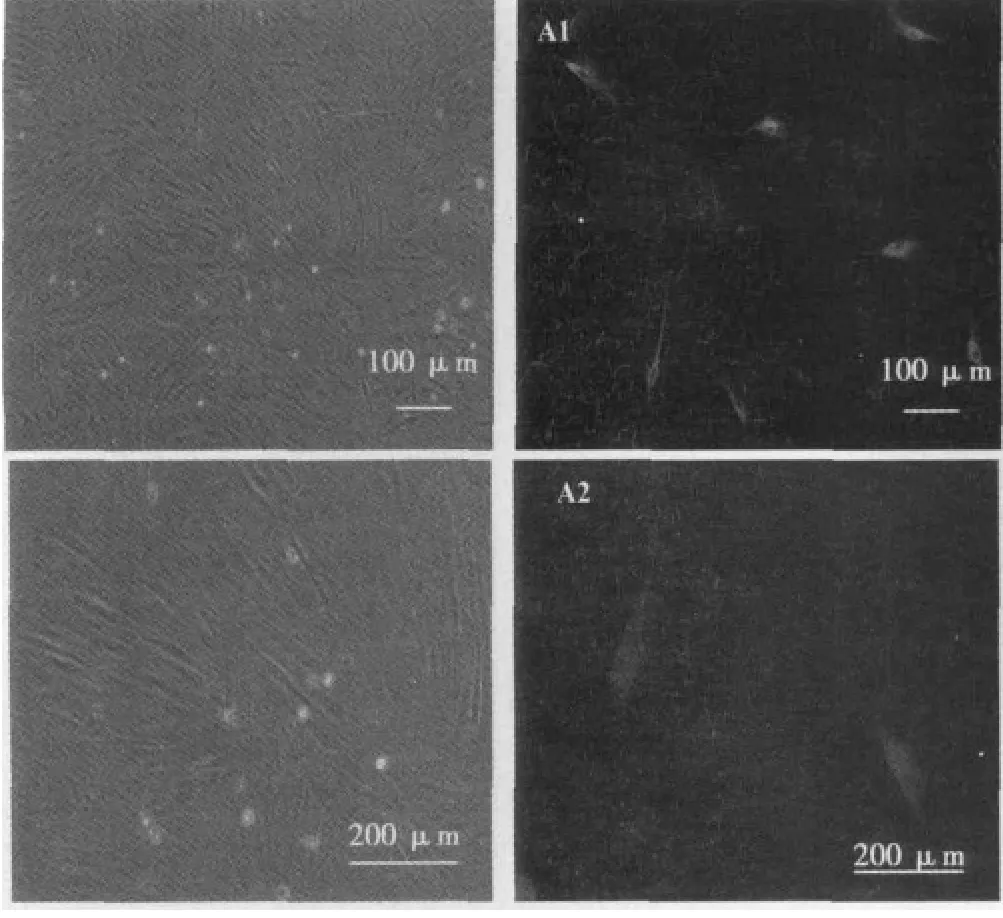
图1 培养3 d原代AECs
2.2 大鼠羊膜上皮细胞的免疫细胞化学特征 免疫荧光检测结果显示,培养的细胞不同程度的表达nestin,但不表达β-Ⅲ-tublin和GFAP。见图2。
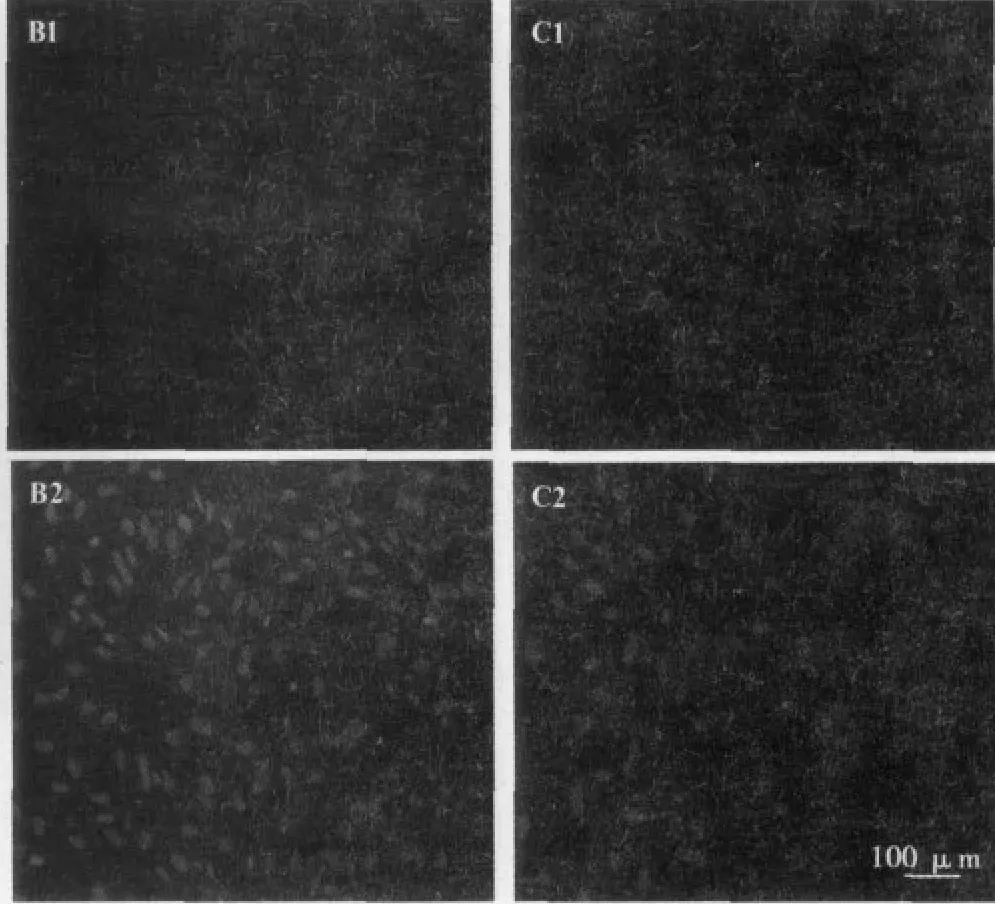
图2 大鼠羊膜上皮细胞的免疫荧光染色
2.3 细胞表面抗原检测结果 流式细胞仪检测结果显示,AECs高表达骨髓间充质干细胞表面标记蛋白 CD29达到94.31%,CD44高达99.98%。
3 讨论
目前的研究证实,大鼠AECs表达胚胎干细胞的部分多能性表面抗原以及细胞内分子标志。在体外经过特定条件诱导下能向三个胚层细胞类型分化〔4,9〕,其中向神经外胚层细胞方向分化的研究比较多〔10〕。此外,由于AECs组织来源丰富,较少引起医学伦理学争议,已成为了一种有潜力的再生医学干细胞来源。
巢蛋白nestin是普遍用来鉴定神经干细胞及神经前体细胞的蛋白〔5,11〕,但也有相关报道巢蛋白在大鼠间充质干细胞和人肝干细胞中表达〔12〕。β-Ⅲ-tublin是在神经元分化过程中检测到的蛋白,表达于未成熟神经元中〔5〕。GFAP是在成熟星形胶质细胞中特异表达的蛋白〔8〕。免疫细胞化学检测结果表明AECs表达nestin,具备干细胞特性。β-Ⅲ-tublin和GFAP的阴性表达说明羊膜干细胞在培养过程中没有向神经元或星形胶质细胞分化。但是提取大鼠定向诱导的AECs总RNA〔13〕,其中有β-Ⅲ-tublin以及GFAP的基因表达,这说明AECs可定向诱导分化为神经元的潜能。研究表明AECs表达间充质干细胞表面抗原CD29和CD44〔9〕,但是不表达造血干细胞标记物CD34,本实验结果与之一致。
依此看来,AECs可以作为干细胞资源参与再生医学的研究,并有望参与神经系统疾病临床治疗。之前已有关于AECs治疗脊髓损伤的研究报道〔14〕,但其治疗效果并不理想。目前基因修饰的细胞移植治疗脊髓损伤越来越受到学者们的关注。olig-2是一种bHLH转录因子,对于少突胶质细胞的发生及其形成中枢神经系统髓鞘发挥重要作用〔15〕。有研究报道转染olig-2的神经干细胞能有效改善脊髓损伤后的髓鞘形成〔16〕。基于大鼠AECs的分离培养及鉴定已经成熟,而且具有优越的干细胞特性,因此接下来将进行olig-2基因修饰AECs的研究,为脊髓损伤的细胞移植治疗奠定基础。
1 Barbati A,Grazia Mameli M,Sidoni A,et al.Amniotic membrane:separation of amniotic mesoderm from amniotic epithelium and isolation of their respective mesenchymal stromal and epithelial cells〔J〕.Curr Protoc Stem Cell Biol,2012;1(8):1-15.
2 Miki T,Strom SC.Amnion-derived pluripotent/multipotent stem cells〔J〕.Stem Cell Rev,2006;2(2):133-42.
3 Okawa H,Okuda O,Arai H,et al.Amniotic epithelial cells transform into neuron-like cells in the ischemic brain〔J〕.Neuroreport,2001;12(18):4003-7.
4 Biswas A,Hutchins R.Embryonic stem cells〔J〕.Stem Cells Devel,2007;16(2):213-21.
5 Shinya M,Komuro H,Saihara R,et al.Neural differentiation potential of rat amniotic epithelial cells〔J〕.Fetal Pediat Pathol,2010;29(3):133-4.
6 Diaz-Prado S,Muinos-Lopez E,Hermida-Gomez T,et al.Human amniotic membrane as an alternative source of stem cells for regenerative medicine〔J〕.Differentiation,2011;81(3):162-71.
7 Toda A,Okabe M,Yoshida T,et al.The potential of amniotic membrane/amnion-derived cells for regeneration of various tissues〔J〕.J Pharmacol Sci,2007;105(3):215-28.
8 Conejo NM,Gonzalez H,Cimadevilla JM,et al.Influence of gonadal steroids on the glial fibrillary acidic protein-immunoreactive astrocyte population in young rat hippocampus〔J〕.J Neurosci Res,2005;79(4):488-94.
9 Diaz-Prado S,Muinos-Lopez E,Hermida-Gomez T,et al.Multilineage differentiation potential of cells isolated from the human amniotic membrane〔J〕.J Cell Biochem,2010;111(4):846-57.
10 Kakishita K,Nakao N,Sakuragawa N,et al.Implantation of human amniotic epithelial cells prevents the degeneration of nigral dopamine neurons in rats with 6-hydroxydopamine lesion〔J〕.Brain Res,2003;980(1):48-56.
11 Park D,Xiang AP,Mao FF,et al.Nestin is required for the proper selfrenewal of neural stem cells〔J〕.Stem Cells,2010;28(12):2162-71.
12 Foudah D,Redondo J,Caldara C,et al.Expression of neural markers by undifferentiated rat mesenchymal stem cells〔J〕.J Biomed Biotechnol,2012;2012:820-1.
13 Marcus AJ,Coyne TM,Rauch J,et al.Isolation,characterization,and differentiation of stem cells derived from the rat amniotic membrane〔J〕.Differentiation,2008;76(2):130-44.
14 Sankar V,Muthusamy R.Role of human amniotic epithelial cell transplantation in spinal cord injury repair research〔J〕.Neuroscience,2003;118(1):11-7.
15 Zhou Q,Choi G,Anderson DJ.The bHLH transcription factor Olig2 promotes oligodendrocyte differentiation in collaboration with Nkx2.2〔J〕.Neuron,2001;31(5):791-807.
16 Hwang DH,Kim BG,Kim EJ,et al.Transplantation of human neural stem cells transduced with Olig2 transcription factor improves locomotor recovery and enhances myelination in the white matter of rat spinal cord following contusive injury〔J〕.BMC Neurosci,2009;10:117.

