阿托伐他汀对人CD4+T淋巴细胞microRNA-21表达的影响
刘 洋 李 浪 周 游 王江友 苏 强 孙羽涵
(广西医科大学第一附属医院心内科,广西 南宁 530021)
他汀类药物是动脉粥样硬化性疾病的主要治疗药物,除明显改善血脂异常外,尚具有独立于降脂作用之外的多效性作用,其中抗炎特性最引人注目。研究表明,阿托伐他汀抑制CD4+T细胞的增殖,使 Th1分泌的细胞因子 IFN-γ、TNF-α减少,Th2分泌的细胞因子IL-4、IL-10分泌增多,从而调整Th1/Th2亚群平衡〔1,2〕。然而阿托伐他汀抑制CD4+T淋巴细胞炎症反应的具体机制尚未完全清楚。越来越多的研究表明,微小核糖核酸(microRNA)参与了免疫性疾病的发生发展。研究发现,在活化的CD4+T淋巴细胞中miRNA-21表达明显上调〔3〕,miRNA-21能够通过抑制靶蛋白程序性细胞死亡因子4(PDCD4)的表达使IL-10分泌增多而起到抗炎作用〔4〕。本研究旨在了解阿托伐他汀对人CD4+T淋巴细胞miRNA-21表达的影响,从而进一步揭示他汀类药物的免疫调节机制。
1 材料与方法
1.1 试剂与材料 Dynabeads®FlowCompTMHuman CD4试剂盒购自 Dynal公司,RPMI1640培养基购自 Hyclone公司,TRNzol-A+总RNA提取试剂购自北京天根公司,逆转录试剂盒购自Fermentas公司,荧光定量试剂盒购自Rox公司,miRNAQ-PCR检测试剂盒购自GeneCopoeia公司,microRNA-21、U6引物由GeneCopoeia公司提供,PDCD4mRNA、GAPDHmRNA引物由上海生工公司合成,兔抗人PDCD4单抗购自Abcam公司,羊抗兔荧光二抗购自LI-COR公司,GAPDH单抗购自碧云天公司,人TNF-α ELISA试剂盒购自ebioscience公司,人IL-10超敏ELISA试剂盒购自Neobioscience公司。
1.2 细胞提取与分组 取12例健康志愿者新鲜外周血,按根据Ficoll-Paque密度梯度离心法提取PBMC细胞,重悬于1 ml 1640培养基,严格按照Dynabeads®FlowCompTMHuman CD4磁珠分选试剂盒说明书分选人CD4+T淋巴细胞。从分选出的细胞中取10 ml+90 ml PBS做细胞计数,同时用0.4%台盼蓝染色观察并计算出活细胞存活率。存活率>90%的CD4+T淋巴细胞调整为1×106/ml,接种到6孔板中,每孔2 ml。分为①空白组:加等量1640培养基;②刺激组:加5 μg/mlPHA;③他汀药物干预组:分别加入不同浓度阿托伐他汀(终浓度为0、1、5、10 μmol/L),先加PHA刺激1 h后再加阿托伐他汀。用含10%胎牛血清、100 U/ml青链霉素、2 μmol/Lol/L的谷氨酰胺的改良型1640培养基,在5%CO2、37℃孵育48 h,分别离心取培养基上清和细胞用于后续实验。
1.3 实时荧光定量PCR检测各组细胞miRNA-21和PDCD4 mRNA的表达 按照Trizol操作说明提取细胞的总RNA,根据逆转录试剂盒合成cDNA。采用SYBR Green Ι荧光标记法检测PCR产物,总反应体系为20 μl,根据荧光定量PCR说明书分别加入不同组分,miRNA-21及内参U6引物由GeneCopeia公司提供(引物ID分别为:hsmq-0057和hsnRNAU6),PDCD4引物:上游:5'-AACTGTGCCAACCAGTCCAA-3',下 游:5'-TCTTCTCAAATGCCCTTTCATC-3';GAPDH引物:上游:5'-GAGTCAACGGATTTGGTCGT-3',下游:5'-GACAAGCTTCCCGTTCTCAG-3'。按试剂盒说明设置反应体系及参数,每个样本均做复孔检测,同时每次反应均设置阴性孔。结果采用2-ΔΔCT方法比较。
1.4 Western印迹检测各组PDCD4蛋白的表达 分选出的CD4+T淋巴细胞中加入100 μl蛋白裂解液混匀,然后在4℃下12 000 r/min离心20 min。提取上清转移至新离心管中,然后用BCA法检测蛋白浓度,内参为GAPDH。配置12%分离胶和5%浓缩胶,进行SDS-PAGE聚丙烯酰胺凝胶电泳,半干法转膜 40 min,用 TBST配置的 5%脱脂奶粉封闭 1 h,1∶2 500一抗4℃过夜,脱色摇床上用TBST洗膜5 min×5次,1∶5 000红外荧光二抗室温敷育2 h后双色红外激光成像系统扫描成像。
1.5 ELISA检测各组TNF-α和IL-10浓度 将收集的血清标本和ELISA试剂盒常温下放置约30 min,根据试剂盒说明书操作,于酶标仪下读取450 nm的OD值,根据标准曲线计算出样本的浓度。
1.6 统计学处理 应用SPSS13.0统计软件对数据做统计学分析。计量资料以±s表示,两组间比较采用成组t检验,多组间比较采用单因素方差分析,两两比较用LSD检验。
2 结果
2.1 阿托伐他汀对miRNA-21和PDCD4 mRNA表达的影响①与空白组比较,PHA刺激组CD4+T淋巴细胞miRNA-21和PDCD4 mRNA相对表达量增加(P<0.05);②与刺激组比较,加入阿托伐他汀干预后CD4+T淋巴细胞miRNA-21相对表达量进一步上调,且随着药物浓度增加,上调的程度越明显(P<0.05);在阿托伐他汀浓度达10 μmol/L时miRNA-21相对表达量最高(P<0.05);PDCD4 mRNA变化无统计学意义(P>0.05)。见表1。
表1 不同浓度阿托伐他汀对CD4+T淋巴细胞miR-21及PDCD4 mRNA相对表达量水平的影响(±s)

表1 不同浓度阿托伐他汀对CD4+T淋巴细胞miR-21及PDCD4 mRNA相对表达量水平的影响(±s)
与空白组比较:1)P<0.05;与PHA刺激组比较:2)P<0.05
项目 空白组 PHA刺激组PHA+1 μmol/L 组PHA+5 μmol/L 组PHA+10 μmol/L 组miR-21 0.58±0.11 1.02±0.241)1.07±0.21 1.59±0.362)3.39±0.302)PDCD4 2.55±0.69 2.77±0.22 2.94±0.66 3.61±0.73 1.72±0.15
2.2 Western印迹检测PDCD4蛋白的相对表达量 ①与空白组(0.15±0.06)比较,PHA刺激组(0.43±0.04)CD4+T淋巴细胞PDCD4蛋白相对表达量明显增多(P<0.05);②与刺激组比较,经阿托伐他汀干预后PDCD4蛋白相对表达量减少,且随着药物浓度的增加,抑制作用越明显,在阿托伐他汀浓度为10 μmol/L时抑制作用最显著(P <0.05)〔1 μmol/L他汀组、5 μmol/L他汀组、10 μmol/L 他汀组分别为(0.41 ± 0.07),(0.26±0.10),(0.19±0.03)〕,见图1。
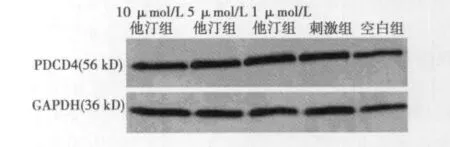
图1 不同浓度阿托伐他汀对PDCD4蛋白相对表达量水平的影响
2.3 ELISA检测上清TNF-α和IL-10浓度 ①与空白组比较,PHA刺激组培养基上清TNF-α浓度明显增加(P<0.05),IL-10则无统计学意义(P>0.05)。②与刺激组比较,加入阿托伐他汀后TNF-α浓度降低,且随着药物浓度的增加,变化越明显,在阿托伐他汀浓度为10 μmol/L时抑制作用最显著(P<0.05)。③与刺激组比较,加入阿托伐他汀后IL-10的浓度增加,且随着药物浓度的增加,变化越明显,在阿托伐他汀浓度为10 um时促进作用最明显(P<0.05)。见表3。
表2 不同浓度阿托伐他汀对培养基上清TNF-α和IL-10浓度的影响(±s,pg/ml)
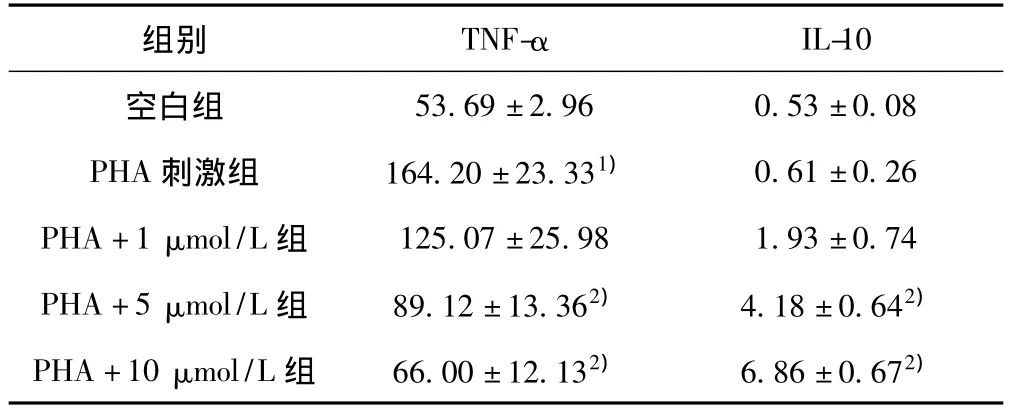
表2 不同浓度阿托伐他汀对培养基上清TNF-α和IL-10浓度的影响(±s,pg/ml)
53.69±2.96 0.53±0.08 PHA刺激组 164.20±23.331) 0.61±0.26 PHA+1 μmol/L组 125.07±25.98 1.93±0.74 PHA+5 μmol/L组 89.12±13.362) 4.18±0.642)PHA+10 μmol/L 组 66.00 ±12.132) 6.86 ±0.672)IL-10空白组组别 TNF-α
3 讨论
他汀类药物己经广泛应用于冠心病的一级和二级预防。他汀类药物的临床益处除了降脂以外,还与能调节炎症、稳定斑块有关。他汀类药物能抑制CD4+T淋巴细胞的增殖起到抑制炎症反应的作用〔5〕。活化的辅助性T淋巴细胞(Th)根据分泌的细胞因子不同可分为两类:Th1细胞主要分泌 IFN-γ、TNF-α,Th2细胞主要分泌 IL-4、IL-10,Th2细胞分泌的抗炎因子能抑制Th1细胞分泌的促炎因子。正常情况下,Th1/Th2细胞趋于动态平衡,而冠状动脉粥样硬化主要是Th1细胞过度增殖导致Th1/Th2细胞失去平衡〔6〕。越来越多的研究发现,miRNA可以调节免疫反应。研究发现,miRNA-21在活化的CD4+T淋巴细胞表达上调〔3〕。在本实验中,PHA刺激后与空白组比较,CD4+T淋巴细胞miRNA-21表达上调。
据报道,过表达miRNA-21能够促进IL-10 mRNA表达增加110%,上清IL-10浓度增加85%〔7〕,抑制miRNA-21表达可使 TNF-α 表达增加〔8〕。Lu等〔9〕的研究发现,抑制 CD4+T 淋巴细胞miRNA-21表达能抑制Th2细胞极化,使CD4+T淋巴细胞分化偏向Th1,加重Th1介导的炎症反应,表明miRNA-21可以调控CD4+T淋巴细胞亚群Th1/Th2的平衡,从而使促炎-抑炎因子的分泌保持平衡。本实验发现,随着阿托伐他汀药物浓度的增加,CD4+T淋巴细胞miRNA-21表达量增加,培养基上清IL-10浓度增加,TNF-α浓度明显降低,提示阿托伐他汀能够调整Th1/Th2细胞分泌促炎因子和抗炎因子趋于平衡可能是通过调控miRNA-21起效。
PDCD4既往被认为是促炎因子,Anja等〔10〕研究显示,敲除小鼠PDCD4基因后,小鼠淋巴细胞分泌IL-10、IL-4抗炎因子明显增多,而IL-10能够抑制TNF-α分泌,表明PDCD4可能促进炎症发生。Merline〔11〕研究发现增加PDCD4表达,能够促进炎症信号的活化。本实验发现,与空白组相比,PHA刺激CD4+T淋巴细胞后PDCD4mRNA和PDCD4蛋白相对表达量均显著增加,培养基上清 TNF-α浓度也明显增多,提示 PDCD4参与CD4+T淋巴细胞的炎症反应过程。
既往研究证实,miRNA-21的靶基因之一是 PDCD4〔12〕,主要为转录后负调控蛋白的表达。Sheedy等〔4〕研究发现,过表达miR-21可以下调PDCD4,从而使抑炎因子IL-10表达增加,抑制促炎因子TNF-α表达,限制过度激活的炎症反应。本实验发现在不同浓度阿托伐他汀组中CD4+T淋巴细胞miRNA-21表达上调后,其靶蛋白PDCD4相对表达量显著减少,培养基上清的TNF-α浓度明显降低,IL-10浓度明显增加。提示miRNA-21可能通过抑制其靶蛋白PDCD4表达,促进抗炎因子IL-10的分泌,抑制TNF-α的表达,从而调控CD4+T淋巴细胞介导的炎症反应。
本研究亦发现,随着阿托伐他汀药物浓度的增加,CD4+T淋巴细胞miRNA-21相对表达量逐步上调,靶蛋白PDCD4相对表达量则逐步降低,促炎因子TNF-α浓度减少,抗炎因子IL-10浓度则增加,在药物浓度达10 μmol/L时作用最显著,表明阿托伐他汀调整CD4+T淋巴细胞抗炎因子和促炎因子平衡与促进CD4+T淋巴细胞miRNA-21的表达有关。
综上所述,阿托伐他汀能够促进miRNA-21表达增加,抑制其靶蛋白PDCD4表达,从而调控CD4+T淋巴细胞分泌抗炎因子与促炎因子平衡。可能是阿托伐他汀抑制CD4+T淋巴细胞炎症反应的机制之一。
本研究为他汀的抗炎作用提供了新的视角。然而本实验仅用了阿托伐他汀为实验用药,对于其他他汀类药物是否有同样作用尚需进一步研究。
1 Tawfik MK,Ghattas MH,Abo-Elmatty DM,et al.Atorvastatin restores the balance between pro-inflammatory and anti-inflammatory mediators in rats with acute myocardial infarction〔J〕.Eur Rev Med Pharmacol Sci,2010;14(6):499-506.
2 Cheng X,Ding Y,Xia C,et al.Atorvastatin modulates Th1/Th2 response in patients with chronic heart failure〔J〕.J Card Fail,2009;15(2):158-62.
3 Pan W,Zhu S,Yuan M,et al.MicroRNA-21 and microRNA-148a contribute to DNA hypomethylation in lupus CD4+T cells by directly and indirectly targeting DNA methyltransferase 1〔J〕.J Immunol,2010;184(12):6773-81.
4 Sheedy FJ,Palsson-McDermott E,Hennessy EJ,et al.Negative suppressor PDCD4 by the micro RNA miR-21 regulation of TLR4 via targeting of the proinflammatory tumor〔J〕.Nat Immunol,2011;11(2):141-7.
5 Shaw SM,Najam O,Khan U,et al.Ezetimibe and atorvastatin both immunoregulate CD4+T cells from cardiac transplant recipients in vitro〔J〕.Transpl Immunol,2009;21(3):179-82.
6 De Palma R,Del Galdo F,Abbate G,et al.Patients with acute coronary syndrome show oligoclonal T cell recruitment within unstable plaque:evidence for a local,intracoronary immunologic mechanism〔J〕.Circulation,2006;113(5):640-6.
7 Philip TL,Matthew W,Rosane T,MicroRNA-21 targets the vitamin D-dependent antimicrobial pathway in leprosy〔J〕.Nat Med,2012;18(2):267-73.
8 Wu Z,Lu H,Sheng J.Inductive microRNA-21 impairs anti-mycobacterial responses by targeting IL-12 and Bcl-2〔J〕.FEBS Lett,2012;16:2459-67.
9 Lu TX,Hartner J,Lim EJ,et al.MicroRNA-21 limits in vivo immune response-mediated activation of the IL-12/IFN-gamma pathway,Th1 polarization,and the severity of delayed-type hypersensitivity〔J〕.Immunol,2011;187(6):3362-73.
10 Anja H,Brendan H,Zheng SJ,et al.Translational regulation of autoimmune inflammation and lymphoma genesis by programmed cell death 4〔J〕.J Immunol,2006;177(11):8095-102.
11 Merline R,Moreth K,Beckmann J,et al.Signaling by the matrix proteoglycan decorin controls inflammation and cancer through PDCD4 and MicroRNA-21〔J〕.Sci Signal,2011;4(199):ra75.
12 Asangani IA,Rasheed SA,Nikolova,et al.MicroRNA-21(miR-21)post-transcriptionally downregulates tumor suppressor Pdcd4 and stimulates invasion,intravasation and metastasis in colorectal cancer〔J〕.Oncogene,2008;27(15):2128-36.

