机关老年人阻塞性睡眠呼吸暂停与代谢综合征关系初探
丁明 顾建华 刘剑南 吴颖 陆甘
阻塞性睡眠呼吸暂停综合征(OSAS)是由于睡眠时反复咽部气道塌陷使上呼吸道阻塞,呼吸时气流减少或暂停而引起反复发作的低氧血症、高碳酸血症以及睡眠碎裂。大量研究证明,OSAS可导致或加重高血压、冠心病、糖尿病等许多严重并发症[1],与代谢综合征(MS)有极高的重叠。MS是一组代谢异常症候群,主要临床表现为:(1)超重或肥胖;(2)高血糖或确诊糖尿病;(3)脂代谢异常;(4)高血压。如果出现上述3项或以上症候即可诊断MS。MS是心脑血管疾病重要危险因素已成定论,而OSAS与MS二者关系以及可能的病理生理机制相对了解甚少,尤其在老年人更缺乏必要的关注。本文为探讨老年人OSAS与MS之间关系,对机关老年打鼾者进行了初步分析。
1 资料与方法
1.1 调查人员和方法 由受过培训的睡眠医学硕士研究生进行现场调查并填写问卷调查表,该表由中华医学会呼吸病学分会睡眠呼吸疾病学组编制,包含的主要项目:姓名、性别、年龄、职业、体质量指数(BMI)、颈围/身高、吸烟史、饮酒史、相关症状得分、相关体征得分、心脑血管疾病史、高血压、糖尿病、高脂血症等。日间嗜睡状况采用Ep-worth嗜睡量表评分(ESS评分)。ESS<9分为正常,≥9分为异常[2]。MS诊断参照中华糖尿病协会2004年标准[3]。
1.2 调查对象 156例系2008年10月至2009年4月来我院体检的机关老年打鼾者,男134例(84.4%),女 22例(15.6%),年龄 60~86岁,平均(70.9±6.9岁)。均行常规体检,经病史询问及睡眠问卷调查测评,全部接受多导睡眠图(PSG)全夜连续睡眠监测,根据呼吸暂停低通气指数(AHI)评分分为AHI>5和AHI≤5者2组,并同时进行ESS评分。现场由专职护士完成体格检查,包括体质量、腰围、臀围等,颈围在环甲膜水平测量,腰围在两侧髂前上棘水平测量;并作口服葡萄糖耐量试验(OGTT)并采集5 ml静脉血备检。156例均知情同意。
1.3 PSG检测 对纳入研究的连续156名打鼾者进行了PSG检测,由睡眠室技师进行全夜7 h检查(Alice 4)。以AHI定义有睡眠呼吸暂停(AHI>5/h)和无睡眠呼吸暂停(AHI≤5/h)。
1.4 实验室检测 指标包括空腹葡萄糖(FBG)、空腹胰岛素(Fins)、总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)和尿酸(UA)等。MS诊断标准参照中华医学会糖尿病分会(2004)标准,体质量指数(BMI)=体质量(kg)/身高(m)2。采用稳态模式评估法的胰岛素抵抗指数(HOMA-IR)公式评价胰岛素抵抗,具体如下:HOMA-IR=Fins×FBG/22.5。
1.5 统计学处理 采用SPSS 15.0软件进行统计学分析。计量资料采用均数±标准差描述,组间比较采用t检验或方差分析(ANOVA,两两比较采用 SNK法);计数资料采用百分比描述,组间比较采用χ2检验;日间嗜睡程度与AHI的关系采用Pearson相关分析。影响因素采用非条件logistic回归分析。P<0.05为差异有统计学意义。
2 结果
2.1 人口学参数 身高:148~180 cm,平均(169.0±6.9)cm;体质量:42~98.2 kg,平均 (73.4±11.3)kg;BMI:17.71~36.7,平均(25.6±3.2);颈围:32~49 cm,平均(39.3±5.2)cm;腰围:67~132 cm,平均(91.8±11.0)cm。
2.2 MS及组分、疾病状况在2组间的分布
2.2.1 ESS评分与MS的关系:按ESS 0~20分排列,MS患病构成比随ESS分值增加而增高。以ESS分值作为自变量,MS构成比作为因变量进行直线拟合分析,结果表明,MS构成比=0.1433+0.0337×ESS(R2=0.7414,P=0.000)。ESS分值每增加1分,MS构成比增加3.37%。2组间MS构成比差异具有统计学意义(χ2=2.164,P=0.032)。
2.2.2 2组间相关指数比较:2组间BMI、FBG、TC、LDL-C均具有显著性差异;2组间TG、HDL-C无显著性差异;2组间血压、冠心病构成比的比较均无显著性差异;脑血管病构成比的比较:本研究资料中脑血管病以脑血栓为主,2组间有显著性差异;2组间ESS评分、HOMA-IR均具有显著性差异。见表1。
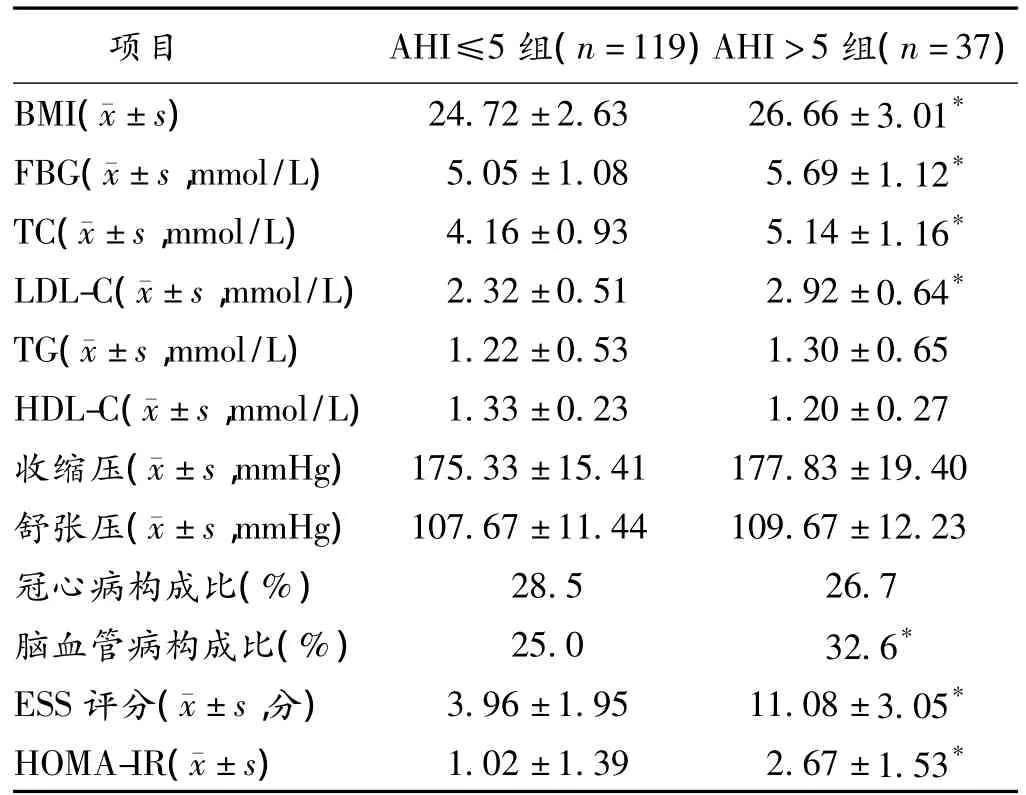
表1 2组参数比较
3 讨论
随着我国人民生活水平提高,饮食结构发生了很大的改变,不良生活方式(高热量、高脂肪饮食及体力活动减少)使疾病谱也发生变化,特别是OSAS及MS患者明显增多。本研究结果揭示OSAS患者更易发生代谢紊乱,国内外大量研究证实,OSAS是成年人MS的危险因素之一。二者均被认为属“源头疾病”,并且互相之间存在相互影响的病理生理机制。
OSAS患者最主要的临床症状包括习惯性打鼾、白天嗜睡、夜间尿频、记忆力下降、夜间憋醒及失眠等。老年OSAS患者常常因缺乏典型临床表现而被忽视,易被误诊、漏诊,这与文献报道的结果一致[4]。本研究初步显示,无论打鼾轻重的老年人中,心血管疾病如高血压、冠心病的发病率没有差异,考虑这2种疾病本身就是老年性疾病,在老年患者中比较普遍,而且危险因素也较其他年龄组为多。虽然OSAS对心脑血管疾病的发生和发展有着严重影响已成为共识,但随着年龄的增长,二者可能互相影响,难以分辨因果关系。提示我们对这两类疾病都应该积极早期干预治疗。
MS是指高血糖、高血压、肥胖症和高血脂等多种代谢危险因素在人体内集结的一种状态,可能导致严重的心血管疾病及并发症[2]。文献报道OSAS与MS的并存率高达28%,且MS的发病率随OSAS程度的加重而增加。二者可能都是因为胰岛素抵抗的出现而发生。OSAS患者夜间反复呼吸暂停及间断低氧,使中性粒细胞及单核细胞爆发性增多,导致系统性炎症反应出现,使一些炎症因子大量分泌,其中包括患者瘦素明显升高。瘦素是脂肪细胞产生的抗肥胖激素,它可以通过调节食欲和能量代谢来控制体质量和血脂。瘦素水平高的患者不但血脂异常,而且内脏脂肪沉积也明显增多[5],这可以部分解释OSAS与MS两者之间的相关性[7]。有研究报道,通过持续正压通气治疗OSAS,不但可以缓解患者夜间缺氧憋气,改善白天临床症状,而且可以使患者的瘦素水平明显下降[8],同时改善MS。甚至有些学者认为OSAS应作为MS的一种临床表现,而不是单独的上气道疾病[9]。
肥胖与OSAS密切相关,肥胖既是引起MS的最常见原因,又是MS的主要症状。本资料显示,较重的老年打鼾患者其BMI、ESS评分明显高于对照组,提示肥胖患病率随着OSAS程度的加重有增加趋势。日间明显嗜睡的老人,腰围、颈围均高于对照组,提示OSAS患者不仅肥胖患病率高,还存在脂肪分布失衡。其可能的机制是:OSAS夜间血氧饱和度明显下降,从而引起交感神经兴奋、血管紧张素升高、血压波动,继而引起瘦素分泌增加。造成过多的脂肪沉积在上气道和内脏。另一方面肥胖者由于上呼吸道、内脏脂肪过量沉积,导致上呼吸道狭窄、呼吸时胸廓运动受限等多种病理生理学机制导致或加重OSAS,从而形成恶性循环。提示减重既是治疗MS又是防治OSAS的重要措施[3]。
综上所述,机关老人OSAS和MS的关系非常密切,随着对OSAS病理生理及相关机制研究的不断深入,提示二者可能有相似的病理生理环境,两者均能增加心血管疾病的危险。OSAS引起的低氧高碳酸血症可能是导致MS的重要原因之一,而MS又可以加重OSAS,二者互为因果,症状相互重叠,使得病情变得复杂。目前它们的发病机制尚不完全明确,可能是多基因和多环境因素综合作用的结果,涉及多个系统、组织和器官。因此,无论对于打鼾人群,还是肥胖人群,均需提高OSAS和MS的筛查,同时对高危人群主张早期干预,以期改善预后和减少并发症,并对OSAS与MS二者间的关联进一步深入研究。
[1]Chan HS,Chiu HFK,Tsel KK,et al.Obstructive sleep apnea presenting with nocturnal angina heart failure and nearmiss sudden death [J].Chest,1991,995(4):1023-1025.
[2]中华医学会糖尿病分会代谢综合征研究协作组.中华医学会糖尿病分会关于代谢综合征的建议[J].中华糖尿病杂志,2004,12(3):156-158.
[3]Redline S,Storfer-lsser A,Rosen CL,et al.Association between metabolic syndrome and sleep-disordered breathing in adolescents[J].Am J Respir Grit Care Med,2007,176(4):401-408.
[4]Peppard PE,Young T,Palte M,et al.Longitudinal study of moderate weight change and sleep disorder breathing[J].JAMA,2000,284(23):3015.
[5]Bhek J.Sleepiness and residual sleepiness in adults with obstructive sleep apnea[J].Respi Physi Neum,2003,136(2):21l-220.
[6]Philljps BG,Kato M,Narkiewicz K,et al.Increases in leptin levels,sympathetic drive,and weight gain in obst uctive sleep apnea[J].Am J Physiol Heart Circ Physiol,2000,279(1):234-237.
[7]Hatipoglu U,Rubinstein I.Israel rubinstein inflammation and obstructive sleep apnea syndrome pathogenesis:a working hypothesis[J].Respiration,2003,70(6):665-671.
[8]Sanner BM,Kollhosser P,Buechner N,et al.Influence of treatment on leptin level in patients with obstructive sleep apnea[J].Eur Respir J,2004,23(4):601-604.
[9]Vgontzas AN,Bixler EO,Chrousos GP.Sleep apnea is a manifestation of the metabolic syndrome[J].Sleep Med Rev,2005,9(3):211-224.

