雌激素及精氨酸对去卵巢大鼠血清一氧化氮水平的影响
景秀菊 祁秀娟 刘建新 汤秀明 刘海宁 赵频
雌激素与心血管疾病的关系已经争论了半个世纪。绝经前女性冠心病(CHD)的发病率仅为男性的1/10至3/10,随着年龄增长,女性CHD发病率增高,55~70岁渐达高峰,以致两性患者CHD发生率的差异趋于缩小。绝经后女性采用雌激素替代疗法,冠脉事件可减少30%~40%。雌激素可能通过影响脂质代谢、糖代谢、血压等方面起到保护心血管的作用,但并不能全面深入地解释其对心血管的保护机制。既往临床试验提示口服一氧化氮(NO)前体L-精氨酸(L-arginine,L-Arg)对冠心病患者、高脂血症患者、健康老年人、青年吸烟者的内皮功能可以产生影响。口服LArg是否可改善内皮功能,尚存争议。本研究选用2种干预因素雌激素、L-Arg来探讨其对大鼠动脉粥样硬化发生发展的影响。从NO、动脉内皮组织病理变化等角度来探讨不同干预因素的作用,从而为临床探索绝经后安全有效的预防保健措施提供实验依据。
1 材料与方法
1.1 动物模型的建立与分组 3月龄雌性Wistar大鼠40只(购自山东鲁抗医药股份有限公司),平均体质量为(214.83±10.72)g,分笼饲养,饲养条件符合国家实验动物的饲养标准,实验期间普通饲料饲养,每日光照12 h。随机分为假手术组(A组)、双侧卵巢切除组(B组)、双侧卵巢切除+苯甲酸雌二醇(E2)治疗组(C组)、双侧卵巢切除+E2+L-Arg治疗组(D组),每组10只。实验前大鼠E2的含量分别为:A组为(38.66 ±3.89)pg/ml、B 组(37.88 ±2.96)pg/ml、C 组(39.39 ± 2.29)pg/ml、D 组(38.89 ± 3.32)pg/ml,各组差异无统计学意义 (P>0.05)。动物去势:10%水合氯醛腹腔注射麻醉,0.3 ml/kg,于无菌条件下在背部正中切开,进入腹腔在肾下极附近找到卵巢,用4号丝线结扎并摘除双侧卵巢,分层缝合切口。A组仅找到卵巢后即关腹分层缝合切口。术后连续3 d给予青霉素80万U肌注预防感染。术后第3天起连续4 d经阴道做细胞涂片,无角化者证实双侧卵巢切除完全,否则弃去不用。术后1周根据组别给予不同的干预措施,连续4月。动物给药:A组:每3 d肌注,生理盐水0.04 ml;B组:每3 d肌注,生理盐水0.04 ml;C组:E210 μg/d,每 3 d 肌注;D 组:E210 μg/d,每 3 d 肌注,每天2.25%L-Arg饮水。
1.2 标本取材 术后4月,用注射器心脏取血3 ml左右,3000 r/min,15 min,取上层血清,置-20℃冰箱保存备用。剪下胸主动脉约3 cm,立即用10%中性福尔马林固定。
1.3 血清E2、NO、L-Arg浓度的测定 采用北京北方生物技术研究所提供的E2放射免疫分析试剂盒测定各组大鼠血清E2含量;采用南京建成生物工程研究所提供的硝酸还原酶法NO试剂盒检测各组大鼠血清NO含量,按试剂盒操作说明检测。L-Arg采用高效液相色谱法测定(Agilent1100、美国安捷伦公司)[1]。
1.4 主动脉组织切片观察 从10%中性福尔马林液中取出浸泡的胸主动脉,常规石蜡包埋、切片(5 μm厚),并将切片行HE常规染色,于显微镜下观察内膜厚度。
1.5 统计学处理 数据以均数±标准差表示,多组样本均数的比较采用方差分析,组间两两比较采用LSD检验。所有统计分析均采用SPSS 18.0统计软件进行处理。以P<0.05为差异有统计学意义。
2 结果
实验期间D组因麻醉意外死亡1只。其余各组存活良好,未见异常反应。
2.1 4月后各组E2、L-Arg、NO水平比较 B组E2和A组比较显著降低,差异有统计学意义,表明大鼠去势成功。C组E2和A组比较差异无统计学意义,表明大鼠去势后适当补充E2后可使体内E2水平增加,并可以接近未去势大鼠的E2水平。D组E2和C组比较差异无统计学意义,表明补充外源性L-Arg对血清E2水平没有影响。
B组L-Arg浓度和A组相比差异无统计学意义,表明去卵巢并不影响血清L-Arg水平。B组L-Arg和C组相比较差异无统计学意义,表明补充雌激素对血清L-Arg水平没有影响。D组L-Arg水平和C组相比显著增加,差异有统计学意义,表明补充外源性L-Arg增加了血清L-Arg水平。
B组NO浓度和A组比较显著降低,差异有统计学意义,提示去卵巢显著降低了大鼠血清NO水平。A组NO和C组比较无统计学差异,说明补充E2后血清NO增加至假手术组水平。D组NO浓度和C组比较显著升高差异有统计学意义,说明补充L-Arg可以显著增加血清NO水平。见表1。
表1 各组E2、L-Arg、NO比较(±s)

表1 各组E2、L-Arg、NO比较(±s)
注:与其他3组比较,*P<0.05;与C组比较,△P<0.05
组别 n E2(pg/ml) L-Arg(μmol/L)NO(μmol/L)A组10 42.33±2.77 48.50±2.55 42.87±3.74 B组 10 10.43±2.31* 47.90±3.67 30.19±3.02*C组 10 41.03±3.39 48.00±3.02 40.89±3.07 D组 9 43.50±4.34 92.75±10.09△ 47.05±2.34△
2.2 胸主动脉的形态学观察 3月龄大鼠胸主动脉HE染色后在光镜下观察:A组、C组、D组、胸主动脉壁层次清晰,内膜薄,中层平滑肌层均匀无萎缩,厚度正常,各组之间未见明显差异;B组和以上各组相比,内膜增厚,内皮细胞不完整,未见明显脂质沉积(图1)。
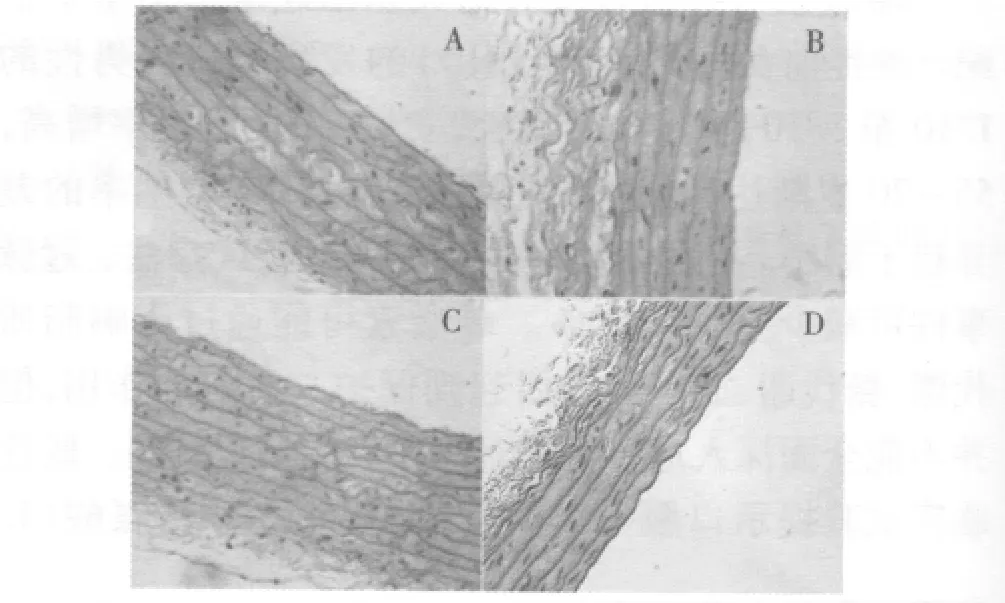
图1 各组大鼠胸主动脉形态学观察(×400)
3 讨论
1980年Furchgott和Zawadski发现了血管内皮依赖性舒张现象,提出了内皮依赖性舒张因子(endothelium derived relaxing factors,EDRF)的概念,1987年Palmer证实NO与EDRF具有相同的化学性质,现已知EDRF即为NO。NO是内皮细胞合成的最重要的血管活性物质,它不但有强大的扩张血管作用,而且有抑制血小板聚集、平滑肌细胞增生、单核细胞黏附和黏附分子表达的作用,从而可防止血管壁发生粥样硬化和血栓形成。
3.1 本实验采用双侧卵巢切除的大鼠模拟绝经模型 卵巢切除后血清E2浓度显著降低,反映了人工绝经后的状态,实验结果显示血清NO与E2水平呈正相关:去势大鼠随着E2水平的下降,血清NO水平明显降低,明显低于未切除卵巢大鼠(A组);去卵巢大鼠接受E2治疗后,血清NO水平升高接近未切除卵巢组,这和以前的众多文献报道结果一致[2-4]。补充E2使血清NO水平升高提示E2可能通过NO途径产生心血管保护效应。另外,发现3月龄A组、C组之间主动脉内膜形态学未见明显差异,而B组和A组比较内膜增厚,内皮细胞不完整。C、D组之间主动脉内膜病变未见明显差异。E2能增加NO合成或释放的机制还不十分清楚。目前大家公认的有:(1)“基因组效应”机制[5],即经典机制。E2与胞质受体结合,形成激素受体复合物进入细胞核,进而与核内受体结合,转变为激素-核受体复合物,调节基因表达。此种机制发挥作用通常需要数小时。(2)“非基因组效应”机制[6-8],即快速信号通路:E2通过位于细胞膜上或者毗邻细胞膜的内质网,或者其他相关的雌激素结合蛋白,引起细胞应答反应而发挥效应。此种机制发挥作用只需几秒或几分时间。此外还有雌激素-磷酸肌醇-3激酶-丝氨酸-苏氨酸—内皮型一氧化氮合酶(eNOS)通路[9]。E2的应用可改善全身及局部症状的作用已被确定[10],有研究发现,应用E2可降低绝经后妇女的骨转移率[11]。
3.2 药理研究发现 L-Arg是NO的生理性前提,在体内L-Arg和氧分子在NOS催化下生成NO和L-瓜氨酸而发挥生物学效应[12]。最近,L-Arg对血管内皮作用的研究正日益受到科学工作者的广泛关注。人们对L-Arg寄予厚望,以期能以之改善内皮功能,预防及治疗心血管疾病。Boger等[13]对L-Arg-NO途径进行了较多的研究,他们将雄性家兔分为普通喂饲组、高脂喂饲组、高脂喂饲加L-Arg组,喂饲12周,以尿硝酸盐浓度表示体内NO的水平,结果显示L-Arg组尿硝酸盐浓度增加。本实验比较各组血清水平的结果表明:去势或绝经后血清NO低水平存在,提示绝经后提高NO水平的必要性;去卵巢大鼠接受E2治疗后,血清NO水平升高接近未切除卵巢组;补充外源性L-Arg亦可明显提高血清NO水平,此为外源性L-Arg作为体内NO供体的应用提供了实验依据。L-Arg的功效依赖于最初的内皮健康状况。也就是说,基线血流介导的血管舒张越低,L-Arg改善内皮功能的作用越显著。LArg改善内皮功能的作用机制可能与增加NO释放,抑制血小板活化,血栓形成和抑制血管平滑肌细胞增殖有关。
目前许多学者对正常人、高胆固醇患者及动物实验中L-Arg浓度的报道各异。Post等[14]对65名健康的绝经后妇女进行了雌激素替代及安慰剂对照实验,结果发现雌激素治疗组血清精氨酸浓度与对照组相比降低(P=0.05);Verhoeven等[15]对152名健康绝经妇女进行了类似实验,结果提示雌激素治疗组血清精氨酸浓度较对照组显著降低(P<0.05),同时以上实验发现雌激素治疗组血清ADMA(内源性NOS抑制剂)显著降低。由于2个实验均未测NO浓度,实验设计者推测雌激素治疗组L-Arg浓度降低是由于雌激素降低了ADMA对NOS的抑制作用,致使L-Arg生成NO消耗增多所致。Xiong等[16]比较了6月龄及20月龄雄性SD大鼠的血清L-Arg浓度结果差异无统计学意义。本实验A、B、C组间L-Arg浓度未发现明显差异,L-Arg浓度是否存在统计学差异尚需进一步大样本实验研究。
L-Arg是生成NO的前体,L-Arg来源不足、转运障碍或代谢异常都可影响NO的生成,应该指出的是,在体内L-Arg易被肝脏摄取而进入鸟氨酸循环。因此,合成可选择性地易被内皮细胞摄取的、高效和长效的L-Arg衍生物,将有助于L-Arg在心血管疾病治疗中的广泛、有效的应用。
[1]Mao HM,Wei W,Xiong WJ,et al.Simultaneous determination of l-citrulline and l-arginine in plasma by high performance liquid chromatography[J].Clin Biochem,2010,43(13-14):1141-1147.
[2]阮云军,朱小虎,吴赛珠,等.雌激素替代治疗去卵巢大鼠血清一氧化氮含量的变化[J].中国实验动物学报,2001,9(3):186-188.
[3]金香兰,姚兰春,焦润生.雌二醇对去卵巢大鼠心肌和血管内皮细胞功能的影响[J].中国医疗前沿,2009,20(4):3-4.
[4]LeBlanc AJ,Reyes R,Kang LS,et al.Estrogen replacement restores flow-induced vasodilation in coronary arterioles of aged and ovariectomized rats[J].Am J Physiol Regul Integr Comp Physiol,2009,297(6):R1713-R1723.
[5]陆静,张丽容,刘乃丰.雌激素促血管内皮生成一氧化氮的机制[J].国外医学心血管疾病分册,2002,29(2):76-78.
[6]Chen Z,Yuhanna IS,Galcheva Z,et al.Estrogen receptor alpha mediates the nongenomic activation of endothelial nitric oxide synthase by estrogen [J].Clin Invest,1999,103(3):401-406.
[7]Stefano GB,Prevo V,Beauvillain JC,et al.Cell-surface estrogen receptors mediate calcium-dependent nitric oxide release in human endothelia [J].Circulation,2000,101(13):1594-1597.
[8]Shaul PW.Novel role of estrogen receptors in vascular endothelium [J].Semin Perinatol,2000,24(1):70-74.
[9]Alexaki VI,Charalampopoulos I,Kampa M,et al.Estrogen exerts neuroprotective effects via membrane estrogen receptors and rapid Akt/NOS activation[J].FASEB,2004,18(13):1594-1596.
[10]薛秀珍.阴道用雌激素治疗老年妇女反复尿路感染[J].实用老年医学,2003,17(4):221-223.
[11]邓廉夫.骨质疏松的雌激素药物治疗与降低其不良反应的对策[J].实用老年医学,2008,22(6):413-420.
[12]Meininger CJ,Marinos RS,Hatakeyama K,et al.Impaired nitric oxide production in coronary endothelial cells of the pontaneously diabetic BB rat is due to tetrahydrobioperin deficiency[J].Biochem,2000,349(Pt 1):353-356.
[13]Boger RH,Bode-Boger SM,Mugge A,et al.Supplementation of hyercholesterolaemic rabbits with L-Arg reduces the vascular release of superoxide anions and restores NO production[J].Atherosclerosis,1995,117(2):273-284.
[14]Post MS,Verhoeven MO,van der Mooren MJ,et al.Effect of hormone replacement therapy on plasma levels of the cardiovascular risk factor asymmetric dimethylarginine:a randomized,placebo-controlled 12-week study in healthy early postmenopausal women[J].J Clin Endocrinol Metab,2003,88(9):4221-4226.
[15]Verhoeven MO,Hemelaar M,van der Mooren MJ,et al.O-ral,more than transdermal,oestrogen therapy lowers asymmetric dimethylarginine in healthy postmenopausal women:a randomized,placebo-controlled study[J].J Intern Med,2006,259(2):199-208.
[16]Xiong Y,Yuan LW,Deng HW,et al.Elevated serum endogenous inhibitor of nitric oxide synthase and endothelial dysfunction in aged rats[J].Clin Exp Pharmacol Physiol,2001,28(10):842-847.

