以肺纤维化就诊的原发性纵膈精原细胞瘤1例
张虹 杜颖 刘伟 魏葆琳 孙增涛 胡建功
1 一般资料
患者王某,男性,65岁,主因“间断喘憋1年,加重1月”于2013年5月2日就诊于我院。既往高血压、慢性消化道溃疡病史。患者入院1年前无明显诱因出现咳嗽咯痰、喘憋,于2012年7月30日首次就诊于我院呼吸科,查胸计算机断层扫描(computed tomography, CT)示“两肺间质纤维化,肺气肿,两下肺炎症,两侧包裹性积液”,肺功能示“中重度限制性通气功能障碍,弥散量中度降低”,肿瘤标记物未见异常,予抗炎化痰平喘治疗后好转出院。2012年11月26日患者主因“上腹隐痛3月余,加重1周”于我院消化科住院治疗,住院期间查胃镜示“慢性胃炎”,胸CT示“两肺间质纤维化伴炎症,两侧胸膜增厚,右侧包裹性胸腔积液”,肿瘤标记物无异常,予对症治疗后好转出院。此后患者咳喘时有发作、纳差,近1年来体重下降20余斤。
此次入院前一月患者喘憋持续加重,外院查胸片示“两肺间质纤维化、右侧胸腔积液”,遂以“肺纤维化、胸腔积液”收入我院呼吸科住院治疗。入院查体:T 36.6oC,BP 130/80 mmHg,神清,口唇紫绀,双锁骨上窝淋巴结肿大,颈后可见一大小约0.8 cm×1.0 cm肿大淋巴结,压痛明显,双肺呼吸音低,可闻及细小爆裂音,HR 86次/分,心律不齐,腹(-),双下肢无水肿。予超声胸水探查定位后行胸腔细管引流术,引出橘黄色透明胸腔积液并送检。结合患者胸水常规、生化,考虑为渗出液,胸水癌胚抗原(carcino-embryonic antigen, CEA)6.40 ng/mL,然胸水多次送病理检测均未找到肿瘤细胞,仅可见少量淋巴细胞、中性粒细胞。胸腔积液引流后查胸CT示“①两肺间质纤维化伴炎症;②肺气肿、肺大泡;③纵膈密度增高,其内组织分界欠清并伴多发淋巴结增大”(图1), 肺功能示“重度限制性通气功能障碍,弥散量极重度降低”,肿瘤标记物示“CEA 23.1 ng/mL,细胞角蛋白21-1(cytokeratins 21-1, CYFRA21-1)4.92 ng/mL,糖蛋白抗原199(carbohydrate antigen199, CA199),822.37 U/mL,鳞状上皮细胞癌抗原(squamous cell carcinoma antigen, SCC)1.88 ng/mL”,均明显升高。遂予超声气管镜引导下行第7组纵膈淋巴结穿刺活检,气管镜下示“隆突增宽,粘膜轻度充血”,纵膈穿刺刷片找到高度可疑肿瘤细胞,隆突下淋巴结穿刺物病理:送检灰白灰粉不整形组织一堆,直径0.7 cm:(隆突下淋巴结穿刺物)为少量退变的纤维及坏死组织,内散在异形细胞;免疫组化:白细胞分化抗原20(cluster of differentiation 20, CD20)、白细胞分化抗原3(CD3)(-)、细胞角蛋白7(cytokeratin 7, CK7)(+)、甲状腺转录因子-1(thyroid transcription factor-1, TTF-1)(+)、细胞角蛋白34βE12(cytokeratin 34βE12, CK34βE12)(+/-)、P63(-),倾向为腺癌(图2A,图2B)。为明确纵膈肿瘤细胞来源,予局麻下行左颈后淋巴结摘除活检术,病理示:送检灰粉结节样肿物一个,大小1.5 cm×1.1 cm×0.7 cm,切面灰白、灰红、质软;(颈左侧)淋巴结结构破坏,淋巴结结构破坏,内可见较大的肿瘤细胞,实性、巢状、腺样排列,考虑为精原细胞瘤。免疫组化:胎盘碱性磷酸酶(placental alkaline phosphatase, PLAP)(+)、肌酸激酶(creatine kinase, CK)(+)、波形蛋白(vimentin)(+/-)、白细胞分化抗原117(CD117)(+),病变符合精原细胞瘤(图2C,图2D)。后患者家属将颈后淋巴结病理涂片送至天津医科大学肿瘤医院,亦证实其为“淋巴结转移性低分化恶性肿瘤,结合免疫组化结果,考虑为生殖细胞来源肿瘤(精原细胞瘤)”。患者无会阴部不适主诉,彩超示“双侧睾丸大小正常,内部回声均匀,彩色多普勒超声(color Doppler flow imaging,CDFI)显示未见异常血流信号”。至此,患者明确诊断为“原发性纵膈精原细胞瘤”。其胸CT显示肺间质呈网状结节影、支气管束增粗、小叶间隔呈串珠形增厚、两侧胸膜增厚等均考虑为“癌性淋巴管炎”。系因肿瘤细胞在淋巴管内生长繁殖,或/及淋巴引流受阻,都使淋巴管扩张,局部可出现间质性肺水肿,致使间质性病变加重,多见于淋巴管及结缔组织丰富的支气管血管周围,小叶间隔及胸膜下区域。诊断明确后予顺铂+依托泊苷化疗1周期。经治疗,患者喘憋症状好转出院。
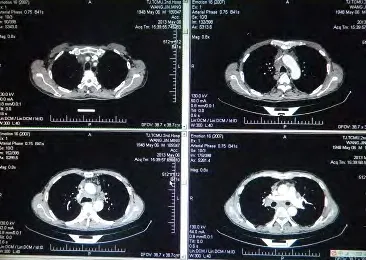
图 1 胸部CT示:纵膈密度增高,其内组织分界欠清并伴多发淋巴结增大Fig 1 The chest CT showed: mediastinal density increased,obscure boundary with multiple enlarged lymph nodes.CT: computed tomography.
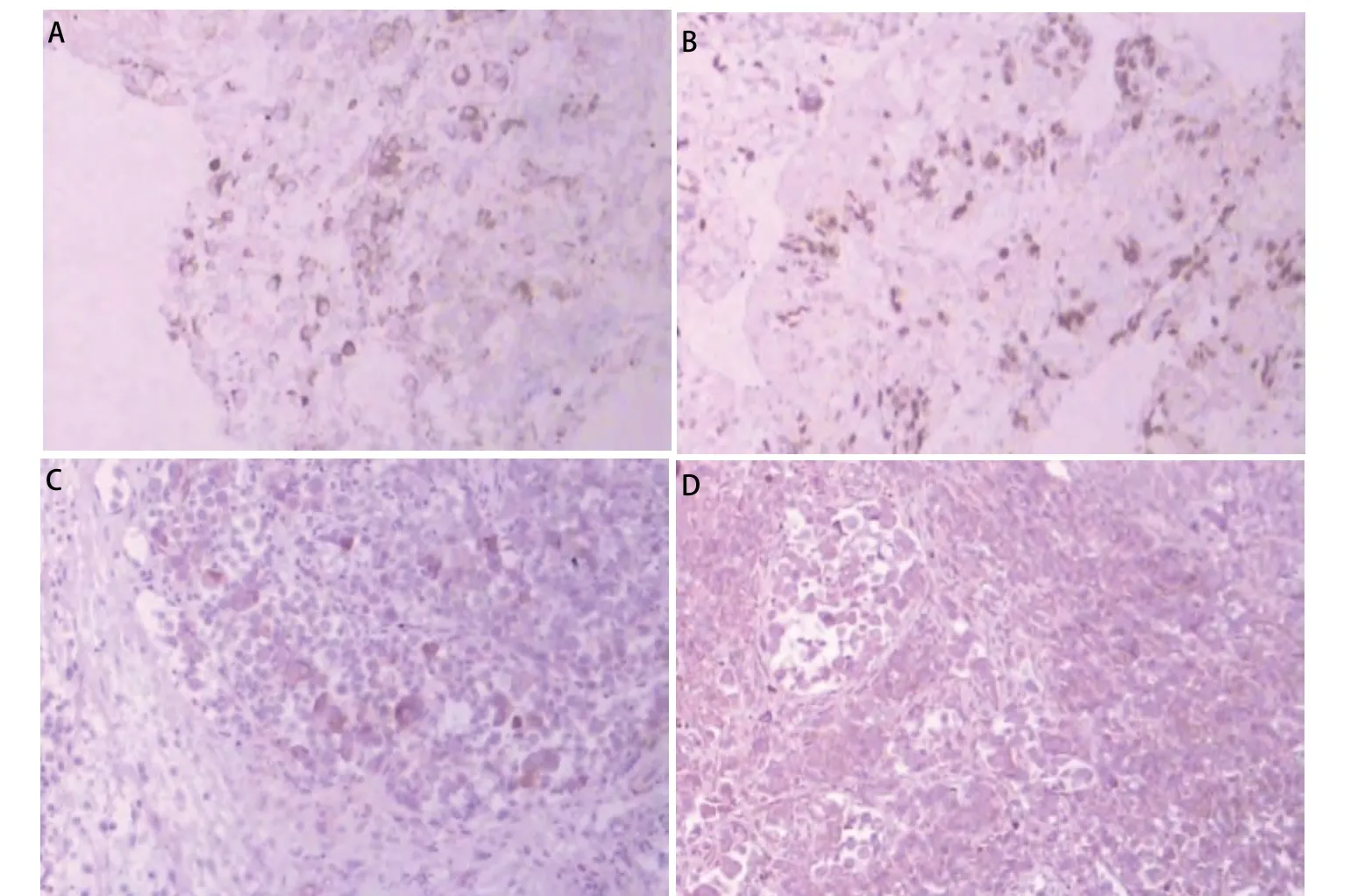
图 2 免疫组化图片(iVision, ×100)。A:细胞角蛋白7(cytokeratin7, CK7)(+);B:甲状腺转录因子-1(thyroid transcription factor-1, TTF-1)(+);C:胎盘碱性磷酸酶(placental alkaline phosphatase, PLAP)(+);D:白细胞分化抗原117(cluster of differentiation 117, CD117)(+)。Fig 2 Immunohistochemical images(iVision, ×100). A: CK7 (+); B: TTF-1 (+);C: PLAP (+); D: CD117 (+).
2 讨论
精原细胞瘤(seminoma)也叫生殖细胞癌(germino carcinoma),起源胚胎发育过程中残留于生殖细胞的恶性肿瘤[1],是睾丸最常见的肿瘤。恶性生殖细胞肿瘤通常发生于性腺,但也有部分病例发生于性腺外,如纵膈、腹膜后腔、松果体[2]。刘仁伟等[3]在对7例精原细胞瘤患者的影像学表现进行回顾性分析的过程中发现:纵膈原发性精原细胞瘤的CT表现为前中上纵膈内大的不规则软组织肿块,肿瘤浸润生长,大血管周围脂肪间隙消失,肿瘤内部及边缘无钙化,肿瘤内部可有点片状坏死灶,可伴有上腔静脉综合征,可存在淋巴结转移或胸膜种植转移。最终明确诊断仍需依靠病理及免疫组化。原发纵膈精原细胞瘤生长缓慢、发生部位隐匿,症状多出现在病程晚期,临床表现为肿块压迫产生的局限症状,如胸闷、胸痛、咳嗽、呼吸困难等,全身症状少见。部分严重者可伴发热、体重下降及上腔静脉阻塞综合征。原发性纵膈精原细胞瘤的临床表现、影像学特征与其他前纵膈肿瘤难以鉴别,其诊断需依靠手术活检或穿刺活检、胸腔积液找脱落细胞。其组织类型与睾丸精原细胞瘤相同。
在治疗方面,Bokemeyer等[4]报告的回顾性分析中,欧美11个中心于1975年-1996年以顺铂为基础的联合化疗治疗原发性纵膈精原细胞瘤,其治愈率近90%。原发性纵膈精原细胞瘤为中低度恶性肿瘤,对放疗、化疗敏感,为放疗、化疗可治愈的肿瘤之一,预后较好。5年生存率为50%-80%,10年生存率为65% -69%[5]。Hurt[6]认为有以下情况者预后较差:①年龄>35岁;②伴发热;③伴上腔静脉阻塞综合征;④锁骨上窝或颈静脉淋巴结肿大;⑤胸片检查示肺门病灶。该病发病隐匿,患者就诊时多已失去手术时机,手术完全切除率仅为20%[7]。
本例患者1年内因喘憋、纳差三次住院治疗,前两次住院期间查胸CT均示双肺间质纤维化伴炎症,无纵膈淋巴结肿大等异常影像。然针对肺纤维化对症治疗后喘憋无明显改善。此次住院期间查胸CT才显示出纵膈肿物,伴多发淋巴结肿大,后经进一步检查,得以明确诊断“原发性纵膈精原细胞瘤、伴多发淋巴结转移,肺部癌性淋巴管炎”。说明原发性纵膈精原细胞瘤发病隐匿,症状出现时通常已至病程晚期。因此在临床上对常见病常规治疗后症状无明显改善时,应提高警惕,进一步追查是否为疑难少见病,以明确诊断,防止漏诊误诊。

