上调Delta-Like1基因可增强小细胞肺癌化疗敏感性
刘换新 彭娟 白义凤 郭琳琅
小细胞肺癌(small cell lung cancer, SCLC)的细胞倍增时间短,病情进展快,早期即发生血道和淋巴道转移,恶性程度在所有肺癌类型中最高.SCLC的治疗以放化疗为主,尽管80%患者早期对放、化疗呈现出较好的初始反应性,但很快即发生复发或病情进展.局限期患者5年生存率低于30%,广泛期患者5年生存率仅1%-2%[1].耐药形成,尤其是多药耐药(multidrug resistance, MDR)的产生是SCLC化疗失败的最重要原因[2,3].因此,化疗抗药性已成为目前SCLC临床治疗急需解决的问题之一.
DLL1(Delta-Like1)为单次跨膜糖蛋白,属于DSL(Delta, Serrate, Lag-2)蛋白家族,人类DLL1基因定位于染色体6q27,全长3.04 kb中,ORF编码723个氨基酸,是脊椎动物Notch的两个配体之一,它与Notch受体结合激活Notch信号通路,决定细胞分化的命运,参与调控许多组织的生长发育.DLL1的细胞内区域与E3泛素连接酶特异结合,使DLL1泛素化和内吞,激活Notch信号通路所必须的结构域[4-6].已有研究[7,8]报道DLL1与肿瘤的生长、分化密切相关,但DLL1对肿瘤耐药方面的研究还很少见,尤其在SCLC耐药中的作用目前国内外还未见相关的报道.我们前期通过基因表达谱芯片对SCLC耐药细胞H69AR和非耐药细胞H69中21,522个基因进行分析,结果发现H69AR细胞中包含DLL1在内的1,131个基因表达下调[9],1,252个基因表达上调,本实验旨在进一步验证DLL1在SCLC敏感细胞株H69和多药耐药株H69AR中的表达,以及其表达对SCLC化疗药物敏感性及细胞周期与凋亡的影响.
1 材料与方法
1.1 材料 pIRES2-EGFP质粒、感受态细菌为本实验室保存.人SCLC敏感细胞株(H69)和其阿霉素耐药株(H69AR)均购自美国ATCC,新生胎牛血清、RPMI-1640培养基购自美国Gibco公司;顺铂、阿霉素和依托泊苷购自辉瑞公司;CCK8及凋亡检测试剂盒购自上海碧云天公司;第1链cDNA合成试剂盒、聚合酶链反应(PCR)试剂盒、DNA maker、DNA纯化试剂盒、质粒提取试剂盒、反转录试剂盒、限制性内切酶等购自大连宝生生物公司;脂质体Lipofetamine 2000购自Invitrogen公司;兔抗人单克隆抗体DLL1购自美国Santa Cruz公司;羊抗兔二抗购自武汉博士德生物公司.
1.2 方法
1.2.1 实时荧光定量PCR分析DLL1及其下游基因的mRNA表达 提取细胞中的总RNA进行逆转录和实时荧光定量PCR.使用SYBR实时定量反应试剂盒(Takara)对实验组和对照组细胞中的DLL1基因及其下游基因的表达进行分析.Real-time PCR反应及数据分析在ABI PRESM 7500实时定量反应仪上完成,引物由Takara公司合成.DLL1 Forward:AGGGTGTGATGACCAACATGGA;DLL1 Reverse:ATCGGATGCACTCATCGCAGTA;HES 1 Forward:AAAGACGGCCTCTGAGCAC;HES1 Reverse:GGTGCTTCACAGTCATTTCCA;HEY1 Forward:CATGAAGAGAGCTCACCCAGA;HEY1 Reverse:CGCCGAACTCAAGTTTCC;内参照GAPDH上游引物为5'-GGAAGGACTCATGACCACAGTCC-3',下游引物为5'-TC GCTGTI'GAAGTCAGAGGAGACC-3'.逆转录反应及PCR参照试剂盒说明,以DLL1及其下游基因的上下游引物进行PCR扩增,PCR反应在实时定量PCR反应仪上进行.3次独立实验后得到的数据运用公式RQ=2-ΔΔCt的方法进行分析.
1.2.2 过表达pIRES2-EGFP-DLL1的转染及稳定转染细胞株的筛选 ①转染前1天,胰酶消化H69AR细胞并计数,细胞铺板,加入含20%胎牛血清的RPMI-1640细胞培养液,使其在转染日密度为60%-80%;②在两个无菌的Eppendoff管中,分别将1 μL纯化的质粒pLEGFP-N1-DLL1(浓度1 μg/μL)和1 μL纯化的质粒pLEGFP-N1(浓度1 μg/μL)空载体质粒,各用50 μL的无血清无抗生素的Opti-MEM进行稀释、混匀,制成溶液A和B.在另一个Eppendoff管中,将4 μL LipofectamineTM2000用100 μL的无血清无抗生素的Opti-MEM进行稀释、混匀,制成溶液C.在5 min内将A和50 μL C、B和50 μL C混匀,室温静置20 min;③等待期间,将培养板中的H69AR细胞用无血清的RPMI-1640培养液洗涤3次,加入400 μL无血清无抗生素的Opti-MEM培养基;④将AC、BC混合物加于H69AR细胞表面,轻轻来回晃动培养板,使混合物均匀覆盖于细胞表面,37oC、5%CO2孵育;⑤6 h后吸去培养液,将细胞用新鲜的培养液洗涤2次,加入含20%胎牛血清的无抗生素的RPMI-1640培养基继续培养.转染48 h后荧光显微镜下观察荧光强度,检测转染效率;⑥第2天细胞按1:8传代,正常培养基培养;⑦第3天培养基换成含筛选浓度(400 μg/mL)的G418的10%胎牛血清RPMI-1640培养基进行筛选培养;⑧3周后待形成阳性单细胞克隆群落后,用尖吸管吸取单克隆阳性细胞培养,改用含半浓度G418(200 μg/mL)的培养基扩大培养.
1.2.3 Western blot分析DLL1蛋白表达 提取细胞总蛋白,BCA法蛋白定量,每孔中加样50 μg蛋白,经10%SDSPAGE后,电转移至PVDF膜.5%BSA/TBST室温封闭1 h,加入兔抗人DLL1单克隆(1:200)孵育,4oC过夜.TBST漂洗3次,用 HRP标记的羊抗兔IgG(1:5,000)孵育,室温2 h,TBST漂洗3次,ECL检测,暗室曝光10 s-10 min,显影.
1.2.4 CCK8法检测药物敏感性 参照顺铂(DDP)、足叶乙苷(VP-16)及阿霉素(ADM)3种化疗药物的血浆高峰浓度,在各种转染细胞中分别加入0.01倍、0.1倍、1倍和10倍血浆高峰浓度的化疗药物,每种药物的每一浓度设4个重复孔;阴性对照组:仅加细胞不加药物,设 4个重复孔;空白调零组:仅加细胞培养液,设4个重复孔.以每孔3X103个细胞接种于96孔培养板中,每孔加入200 μL培养液;细胞贴壁后,将3种化疗药物按不同浓度加入各孔细胞,继续常规培养24 h;每孔加新鲜配制的CCK8溶液20 μL,37oC、5%CO2下继续培养0.5 h-4 h后,终止培养.选择450 nm波长,在酶联免疫检测仪上测定各孔光吸收值,取每4个重复孔的光吸收值(A值)的平均值,计算各种转染细胞在3种化疗药物不同浓度下的存活率;细胞存活率=(实验组A值-空白对照组A值)/(阴性对照组A值-空白对照组A值)X100%.重复实验3次,取平均值,以细胞存活率为纵轴,药物浓度对数为横轴作半对数图,并按作图法求出3种药物的IC50值.
1.2.5 细胞凋亡检测 对数生长期的细胞以 4X105/孔接种6孔板中;37oC培养48 h;收集细胞,PBS洗涤2次;细胞重悬于100 μL含Annexin V-FITC和0.5 μg PI的结合缓冲液(10 mM HEPES pH7.4; 0.15 M NaCl; 5 mM KCl; 1 mM MgCl2; 1.8 mM CaCl2)中;避光室温孵育15 min;加入400 μL结合缓冲液;流式细胞仪分析.
1.2.6 细胞周期检测 取对数生长期的细胞,用0.25%胰蛋白酶和0.02%EDTA消化细胞,PBS洗2次,用75%乙醇冰浴固定24 h,然后用含1%BSA的PBS充分混匀洗涤2次,PI染色后进行流式细胞仪测定并用Cell Quest软件分析各组细胞群体在细胞周期各个时相的分布比例.
1.3 统计学方法运用SPSS 13.0统计软件分析,采用t检验或One-way ANOVA检验,P<0.05为差异具有统计学意义.
2 结果
2.1 DLL1在敏感株(H69)和耐药株(H69AR)中的差异表达 如图1A所示,qRT-PCR结果显示H69AR细胞株中DLL1 mRNA表达较H69细胞降低,差异具有统计学意义(P=0.003).Western blot结果也显示在耐药株H69AR中的DLL1蛋白的表达较敏感株H69明显降低(图1B,P<0.001).通过PIRES2-EGFP-DLL1上调H69AR细胞株中DLL1的表达:如图2所示,H69AR分别转染PIRES2-EGFP-NC(A)及PIRES2-EGFP-DLL1(B)后48 h,通过荧光显微镜观察其转染效率达80%(图2A,图2B).QRT-PCR和Western blot检测转PIRES2-EGFP-DLL1后,DLL1在mRNA和蛋白水平上均增高(图2C,图2D,P=0.004),差异具有统计学意义.提示过表达DLL1的稳定细胞株H69AR-eGFP-DLL1构建成功.细胞对化疗药物敏感性的变化:如图3所示,CCK8检测显示H69AR对顺铂(DDP),阿霉素(ADM)及足叶乙苷(VP-16)的IC50值较敏感细胞株H69增高,提示H69AR对化疗药物的敏感性降低(图3A,P=0.009).通过转染PIRES2-EGFP-DLL1上调H69AR细胞株中DLL1的表达后,与对照组(H69AR及H69AR-PIRES2-EGFP-NC)相比细胞对DDP,ADM及VP-16的敏感性明显增加,差异具有统计学意义(图3B,P=0.016).

表 1 上调DLL1的表达后细胞凋亡率的变化(%, Mean±SD, n=5)Tab 1 The apoptosis rate of cells was assayed after transfected with eGFP-DLL1 or a negative control (NC) (%, Mean±SD, n=5)
2.2 细胞凋亡率的变化 如表1及图4所示,流式细胞技术检测显示,上调DLL1表达后,H69组凋亡率为(7.294±0.389)%(图4A),H69AR细胞的凋亡率为(1.954±0.088)%(图4B),H69AR的凋亡率明显低于H69,两组之间差异具有统计学意义(P<0.001).而H69AR转染PIRES2-EGFPDLL1(图4D)后凋亡率为(17.202±0.872)%较H69AR组及转染PIRES2-EGFP-NC(2.112±0.222)%(图4C)组明显增高,差异具有统计学意义(P<0.001).结果提示上调DLL1明显增加H69AR细胞的凋亡.
2.3 细胞周期的变化 流式细胞技术检测显示,H69组细胞周期主要以G0/G1期为主(图5A),H69AR细胞G2/M期细胞增多(图5B),H69AR的G2/M期细胞明显较H69细胞增多,两组之间差异具有统计学意义(P<0.01).而H69AR转染PIRES2-EGFP-DLL1(图5D)后细胞周期G0/G1期及S期细胞较H69AR组及转染PIRES2-EGFP-NC(图5C)组明显增高(P<0.001).结果提示上调DLL1使细胞周期发生G0/G1期和S期阻滞(表2).
2.4 DLL1对下游靶基因的激活 为进一步研究DLL1影响小细胞肺癌耐药的分子机制,我们通过qRT-PCR从基因水平检测了DLL1下游基因的表达,如图6所示,上调DLL1的表达,下游靶基因HES1及HEY1的表达升高,提示DLL1对下游靶基因HES1及HEY1有激活作用.DLL1下游基因HES1、HEY1的激活可能是通过肿瘤细胞之间的受体--配体相互作用的结果.
3 讨论
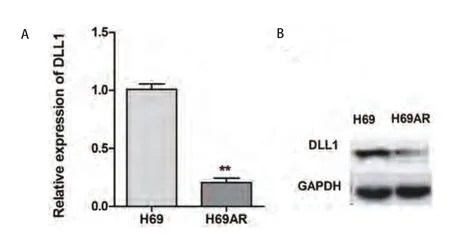
图 1 qRT-PCR和Western blot在mRNA水平(A)和蛋白水平(B)检测H69及H69AR细胞中DLL1的表达. **P<0.01.Fig 1 The expression of DLL1 mRNA (A) and protein (B) levels were assessed by qRT-PCR and Western blot in H69 and H69AR cells. **P<0.01.

图 2 转染PIRES2-EGFP-DLL1过表达质粒上调DLL1的表达.H69AR分别转染PIRES2-EGFP-NC(A)及PIRES2-EGFP-DLL1(B)后48 h,通过荧光显微镜观察其转染效率.细胞转染PIRES2-EGFP-DLL1后,在mRNA水平(C)和蛋白水平(D)检测其对DLL1的表达.光镜,200X(左);荧光显微镜,200X(右).**P<0.01.Fig 2 eGFP-NC (negative vector) and eGFP-DLL1 overexpression plasmid were transfected into H69 cells. At 48 h after transfection, uorescent microscopy showed emission green uorescence to detect the transfection efficiency. (A) PIRES2-EGFP-NC; (B) PIRES2-EGFP-DLL1. The expression of DLL1 mRNA (C) and protein (D) after transfected with PIRES2-EGFP-DLL1. Left: Light microscopy, 200X; Right: Fluorescent microscopy, 200X.**P<0.01.

表 2 过表达DLL1后细胞周期分布的百分数(%,Mean±SD,n=3)Tab 2 The cell cycles distribution were detected after transfected with eGFP-DLL1 or a negative control (NC) (%, Mean±SD, n=3)

图 3 细胞对化疗药物的敏感性的变化.A:CCK8检测H69和H69AR细胞对化疗药物DDP、ADM及VP-16的敏感性;B:通过转染PIRES2-EGFP-DLL1上调H69AR中DLL1的表达后,细胞对DDP、ADM及VP-16的敏感性明显增加.*P<0.05.Fig 3 The sensitivities of cells to chemotherapy drugs. A: The sensitivities of cells to chemotherapy drugs (ADM, DDP and VP-16) were measured in H69 and H69AR cells; B: The sensitivities of cells to chemotherapy drugs (ADM, DDP and VP-16) were measured after H69AR cells transfected with PIRES2-EGFP-DLL1 or mock by CCK-8 assay. DDP: cis-platinum; ADM: adriamycin; VP-16: etoposide; IC50 value: half maximal inhibitory concentration.

图 4 上调DLL1的表达后流式细胞术检测细胞凋亡的变化.A:H69;B:H69AR;C:H69AR-EGFP-NC;D:H69AR-EGFPDLL1.Fig 4 Cell apoptosis was assayed by flow cytometric analysis after transfected with eGFP-DLL1 or a negative control (NC). A: H69; B: H69AR; C: H69AR-EGFP-NC; D:H69AR-EGFP-DLL1.

图 5 上调DLL1的表达后流式细胞术检测细胞周期的变化.A:H69;B:H69AR;C:H69AR-EGFP-NC;D:H69AR-EGFP-DLL1.Fig 5 Cell cycles were assayed by flow cytometric analysis after transfected with eGFP-DLL1 or a negative control (NC). A: H69; B: H69AR; C: H69AREGFP-NC; D: H69AR-EGFP-DLL1.
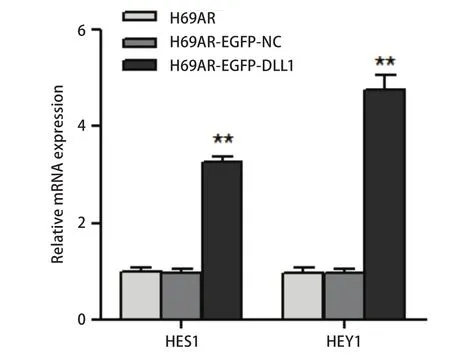
图 6 qRT-PCR检测DLL1下游基因的表达Fig 6 The expression of DLL1 downstream genes HES1 and HEY1 were detected by qRT-PCR
Notch信号通路是进化上高度保守的细胞与细胞间的信号传导系统,与细胞增殖、分化及凋亡密切相关[10,11],在胚胎正常发育、机体稳态调控以及成体干细胞的维持中发挥重要作用,该通路的异常激活不仅直接参与肿瘤的发生发展,还与肿瘤耐药密切相关[12-14].近年来的研究[15-17]发现Notch-1广泛表达于多种肿瘤细胞,通过促进上皮间质转换(epithelial-mesen chymal transition, EMT)、肿瘤干细胞(cancer stem cells, CSC)表型的改变和调节微小RNA(microRNAs, miRNA)等途径,导致肿瘤对多种化疗药物产生抗药性.因此,Notch-1是对抗肿瘤耐药的潜在靶点.还有研究[18-23]表明Notch1受体及其配体deltalike-1(DLL1)在肿瘤的生长、分化、增殖及凋亡中发挥着重要的作用.目前共发现了5种人的Notch配体,分别是DLL1、Delta-like-3(DLL3)、Delta-like-4(DLL4)、JAG1和JAG2.DLL1为单次跨膜糖蛋白,属于DSL(Delta,Serrate, Lag-2)蛋白家族成员,作为Notch信号转导通路的配体之一,目前已有相关研究[17,18]报道DLL1能够抑制肿瘤细胞的增殖和促进细胞分化.人类DLL1基因定位于染色体6q27,长度为3.04 kb,其ORF 编码723个氨基酸,它与Notch受体结合激活Notch信号通路,决定细胞分化的最终归宿,并参与调控许多组织的生长发育[23,24].DLL1的细胞内区域与E3泛素连接酶特异结合,该过程称为DLL1泛素化和内吞,此为激活Notch信号通路所必须的结构域[4-6].Notch信号通路正是通过这一机制调控细胞的分化、增殖及凋亡等过程.研究[21]报道,MiR-34a通过靶向作用于Notch的配体DLL1损害CD15+/CD133+肿瘤增殖细胞从而促进髓母细胞瘤的分化.Huang等[7]发现选择性的刺激DLL1-Notch信号通路能够恢复T细胞的功能,抑制肿瘤的生长.还有研究[8]发现在B16黑色素瘤细胞中上调Notch配体DLL1的表达引起肿瘤血管的减少而抑制肿瘤的生长.
尽管DLL1与肿瘤的生长及分化方面的研究较多,然而该基因及其编码的蛋白质与肿瘤耐药的关系报道很少,与SCLC的多药耐药的相关性目前国内外尚未见相关报道.本实验在前期对SCLC耐药细胞株和敏感细胞株高通量芯片筛选中发现,H69AR耐药细胞株中DLL1的表达较敏感细胞株H69明显降低[9],为了进一步验证芯片结果,我们运用qRT-PCR和Western blot方法进一步从基因和蛋白水平检测了SCLC中DLL1的表达,结果和基因芯片的表达一致.同时,我们还发现,在H69AR细胞株中转染PIRES2-EGFP-DLL1上调DLL1的表达后,肿瘤细胞对化疗药物的敏感性明显增加,流式细胞仪检测显示上调DLL1的表达后细胞凋亡明显增加,细胞周期阻滞在G0/G1期,提示DLL1与SCLC的耐药相关,上调DLL1基因的表达可以提高SCLC耐药细胞株的化疗敏感性,DLL1有可能成为治疗SCLC的靶标.但其具体的机制尚有待于进一步研究.

