药物研发:靶向抗癌
邢鸿飞/编译
●临床试验的优化设计和联合疗法的应用会改善白血病的治疗。
35年前,伊莱休·艾斯特(Elihu Estey)还是得克萨斯州休斯敦安德森癌症中心的一名工作人员,他阅读了大量针对急性髓细胞白血病研发的临床试验药物的方案。他最感兴趣的是“基本原理”部分,解释各种疗法的治疗原理。
“它们听起来都挺吸引人的。”艾斯特说,他现在在西雅图,是华盛顿大学的一名血液病专家,“但是,当然,能最后起到作用的非常少。”
从那之后,研究者们已经在不同类型的白血病治疗方面取得了突飞猛进的进展,但是,会使白细胞前体细胞也就是骨髓细胞疯狂增加的恶性血液癌症,急性髓细胞白血病,仍然是一个无法攻克的难题。
这个问题棘手,因为急性髓细胞白血病占所有白血病的1/3。在65岁以上的人群中非常普遍,但病后5年的存活率不到10%,在年轻人中5年存活率接近50%。事实上,每个急性髓细胞白血病患者,他们体内的每一个细胞,都能携带各种突变的不同组合。这种基因多样性给药物的研发,甚至对照临床试验的患者都会造成障碍。
针对急性髓细胞白血病的标准治疗方法是上世纪70年代研制的化疗方案。病症程度稍轻的患者可能比较适合血液干细胞移植。但10%到25%的死亡率和长期的副作用说明这一疗法仍然是比较冒险的方式。除了目前的初期试验中的免疫疗法,现阶段没有其他的治疗方法从实质上改变这一局面。艾斯特说:“没有有效的药物。”
其他类型的白血病的预后更有前景。急性淋巴细胞白血病在儿童白血病病例中占75%,15岁以下儿童治愈率90%。还有一些罕见的成人白血病亚型,比如毛细胞白血病和急性早幼粒细胞白血病都有类似较积极的治疗前景。在很多慢性淋巴细胞白血病病例中,免疫细胞B细胞会受到影响,对它需要结合化疗和单源抗体的治疗 (单源抗体是绑定特殊蛋白质的免疫分子),诊断后5年的存活率约为80%。
随着2001年伊马替尼药物获批,或许在效果上变化最明显的是治疗慢性粒细胞白血病,该药物由瑞士诺华制药公司推广,该药品的问世将慢性粒细胞白血病的5年存活率从原来的30%迅速提升到90%。伊马替尼还可以为特别遗传畸形的目标诊断提供早期的概念验证,这一方法有望运用于各种其他的疾病。
伊马替尼阻断了一种叫做BCR-ABL的酪氨酸激酶的活动,这种酶能促进细胞信号传导和细胞生长。9号和22号染色体部分段交换位置,将BCR和ABL基因融合,于是产生BCR-ABL基因,本来这些基因在不同的染色体中单独存在。95%感染慢性粒细胞白血病的患者携带这种染色体变异。
药物的研发状况不尽如人意:慢性粒细胞白血病患者中有1/3对药物完全没有反应,或者反而出现抗药性。另外4种抑制BCR-ABL的药物陆续被批准,希望能够填补空白。其中一种药物,坡那替尼,2012年12月份获批,标靶为BCR-ABL中一种特殊的突变,该突变使细胞对伊马替尼产生抗体,这在BCR-ABL突变中占20%。
白血病药物审批的趋势说明,科学家们越来越意识到,没有唯一的药物能够独当一面,治愈疾病。
安德森癌症研究中心白血病科主任、肿瘤专家哈古普·坎塔尔吉恩(Hagop Kantarjian)认为,慢性粒细胞白血病患者需要从使用伊马替尼药物转向其他药物的使用以防产生抗药性。他说:“如果病人们使用对他们有效的药物,而且药物根据不同的需求调整更换的话,会有更多的患者存活下来。”
与慢性粒细胞白血病相比,其他类型的白血病,比如急性髓细胞白血病和急性淋巴细胞白血病,基因变化多端,而且由于它们类属急性,基因的突变速度也更快。肿瘤专家布莱恩·德鲁克(Brian Druker)认为,靶向疗法,比如伊马替尼,当与其他药物联合使用时会有疗效。德鲁克是俄勒冈州俄勒冈健康科学大学骑士癌症研究所所长,该研究所也是负责研发伊马替尼药物的三家研发中心之一。“通过在标准化疗方法中添加靶向剂,对预后急性白血病影响显著。”
改良试验
伊马替尼的巨大成功推动了抑制其他酪氨酸激酶的药剂研发。最有前景的靶向是酶FLT3,急性髓细胞白血病患者中的1/4都有突变,从而增加了复发的风险。目前,已有少量FLT3抑制剂正在研制当中。根据2012年12月份一份临床试验二期的报告,携带FLT3突变的受试患者中有一半对quizartinib有药物反应,没有突变的患者1/3有反应。
英国卡迪夫大学试验癌症医学中心的血液病学家、急性髓细胞白血病专家艾伦·伯内特(Alan Burnett)表示,尽管前景不错,但FLT3抑制剂的实验结果表明,仅仅识别一种突变并不能保证治疗的成功。研究者们目前尚不了解AML细胞中哪些常见的突变最关键,或者说它们会起到什么样的作用。
伯内特解释道,例如,一些突变的组合似乎与更有利的疾病预后有关,但其中缘由无人能知。由于患者群人数少,制药公司可能并不情愿开发靶向某种特殊的突变组合的药物。
为了解决相关的一些问题,研究者们正在探索建构临床试验的新方法。通常情况下,新型药物在临床试验的初期不被互相比较。而且因为试验的设计方式各不相同,其结果很难比较。但艾斯特和他的同事们选了4种试验药物,在临床试验最初期进行互相对比,主要考虑选取最佳的方案进行下一步的药物研发。
在美国,这一方法并未得到足够响应,但在其他地方有所进展。在英国、丹麦和新西兰,过去6年中有约10种药物获得评估。用伯内特的话说,人们的初衷是要识别“更有效的方式找到疗效显著的药物”。
与此同时,德鲁克也着力开发了一种筛选方法来检测不同白血病患者对130种激酶抑制剂的不同反应。研究者们使用数据来预测对每个个体最有效的药物,并识别白血病中活跃的分子畸形。2013年初,德鲁克启动了一项研究,将接受标准疗法的病人和接受他实验中精心筛选出来的药物治疗的病人进行比对。一般情况下,临床试验中的试验组接受同样治疗,但在他的实验中,根据不同的个体分子表达谱,他们的治疗方案不同。
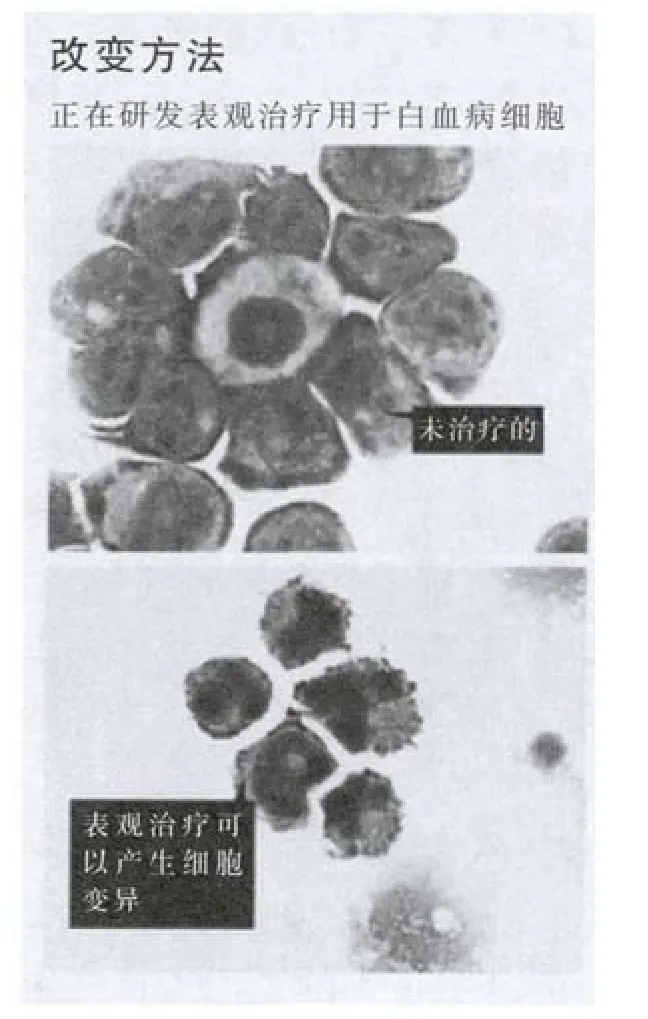
变异表达
其他研发靶向药物的努力集中在遗传因子上,影响基因表达但不改变根本遗传密码的酶。近几年,研究者们发现很多表观遗传过程在白血病以及其他癌症中出现增生调节。纽约纪念斯隆-凯特琳癌症中心的儿科肿瘤专家斯科特·阿姆斯特朗(Scott Armstrong)说:“借助实验胚胎学,我们有了酶的全新分类,为靶向癌症细胞提供了新方法。这无论对于临床还是经济方面,都让人觉得振奋。”
但迄今为止,医学成就远远赶不上人们的振奋程度。很多基于实验胚胎学的合成物在培养白血病细胞和动物模型中显有成效,但治疗效果远不可及。比如,阿扎胞苷(统称维达扎)和地西他滨(统称达克金)都会干扰DNA甲基化,这是基因表达的制动系统。两种药物在治疗骨髓增生异常综合症方面都受到广泛的认可。骨髓增生异常综合症是一种良性癌症,患者中有1/3会转成急性髓细胞白血病。
这些药物在治疗白血病的临床试验中疗效并不明显。伊马替尼和其他酪氨酸激酶抑制剂标靶特殊的分子标记,与它们不同,这些表观遗传药物在功能上不那么明确。阿姆斯特朗认为,另一类药剂存在同样的问题,这就是人们熟知的组蛋白脱乙酰酶抑制剂,修改与DNA有关的组蛋白。
阿姆斯特朗的研究小组的主要方向是不同的表观遗传标靶:DOT1L蛋白质,用于调节染色质结构和基因表达。DOT1L可能适用于混合细胞系白血病(MLL)基因中的突变引发白血病的细胞。急性髓细胞白血病和急性淋巴细胞白血病病例中约5%-10%出现这一突变。
2012年9月,阿姆斯特朗和他的同事们与位于马萨诸塞州剑桥市的Epizyme生物科技公司合作,启动一项临床药物试验,阻止携带突变混合细胞系白血病基因的白血病患者的DOT1L。阿姆斯特朗表示,由于标靶一种特殊的遗传畸形,应试药物EPZ-5676“又陷入了伊马替尼式的疗法”。
尽管科学家们还在继续努力研发小分子药物,另一种已经经历了30年研究的强效免疫疗法似乎正蓄势待发。嵌合抗原受体疗法(CAR)将T细胞(识别病原体和肿瘤阻止的免疫细胞)从白血病患者身上提取出来。第二步再将带有受体的T细胞进入患者杀死白血病。
据率先领导开发此项疗法的费城宾夕法尼亚大学佩雷尔曼医学院的免疫学家卡尔·朱恩(Carl June)介绍,到目前为止在所有接受嵌合抗原受体疗法的16名成年患者和8名儿童患者中,有10名成人和6名儿童全部或部分地缓解了病情。2012年8月,瑞士诺华制药公司宣布,他们认可朱恩的研究疗法,并投入2 000万美元资助他的研究。
2013年3月,纪念斯隆—凯特琳癌症中心的雷尼尔·布伦特扬斯(Renier Brentjens)和米歇尔·萨德林(Michel Sadelain)带领研究者们报告了5例接受类似疗法的患者的病情缓解。朱恩和布伦特扬斯已经开始了一项试验,对比两种技术,并确定各自最佳的疗效因素。安德森癌症中心和休斯敦贝勒医学院的研究者们也在研究嵌合抗原受体疗法。
朱恩说:“这些药物产生疗效的原理已经确定。目前的问题是如何进一步优化,以及细胞生产。”
其他人更加谨慎。艾斯特说:“这可不是冷嘲热讽,我也听说了一些事,比如嵌合抗原疗法,看起来挺有前途但并不成功。历史的启示是,它不会像传说中那么一帆风顺。”

