丁酸钠对重症急性胰腺炎大鼠肺损伤的保护作用
崔 勇 李 杰
深圳市南山区蛇口人民医院普外科,广东深圳 518067
丁酸钠对重症急性胰腺炎大鼠肺损伤的保护作用
崔 勇 李 杰
深圳市南山区蛇口人民医院普外科,广东深圳 518067
目的 探讨丁酸钠对大鼠重症急性胰腺炎(SAP)合并肺损伤的治疗作用。 方法 牛磺胆酸钠逆行胰胆管注射制作SAP动物模型,30只SD大鼠分成对照组、SAP组及丁酸钠(NaB)治疗组,检测胰腺湿/干重比值、胰腺及肺脏病理改变、肺脏细胞凋亡情况。 结果NaB治疗组肺组织湿/干重比值下降;NaB治疗组胰腺及肺组织病理改变明显减轻。NaB治疗组肺组织细胞凋亡指数显著高于SAP组。 结论 NaB可以有效诱导SAP大鼠肺组织细胞发生凋亡,减轻肺损伤。
丁酸钠;重症急性胰腺炎;细胞凋亡;肺损伤
重症急性胰腺炎(severe acute pancreatitis,SAP)容易引起全身炎症反应综合征(systemic inflamatory response syndrome,SIRS),如果没有及时控制病情可进一步发展成为多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS),救治困难,死亡率高。多器官中肺损伤最常见,30%的SAP患者可发生明确的急性肺损伤 (acute lung injury,ALI);严重者可发生急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)[1-2]。 细胞凋亡与 SAP 及其引起的肺损伤密切相关,胰腺腺泡细胞凋亡可能是急性胰腺炎发生后对机体较为有利的一种反应,诱导胰腺或肺细胞凋亡可以有效减轻局部及全身炎症反应,是治疗SAP的有效途径[3]。 丁酸钠(sodium butyrate,NaB)能够诱导肿瘤细胞和多种非肿瘤细胞的凋亡,但NaB诱导肺组织细胞凋亡以及对SAP并发的急性肺损伤治疗作用方面的研究不多,本研究通过建立SAP动物模型,探讨NaB对大鼠SAP的并发症急性肺损伤的治疗作用。
1 材料与方法
1.1 实验动物
健康雄性SD大鼠(吉林大学实验动物中心提供)30只,体重 200~250 g,随机分为对照组、SAP组、NaB 治疗组,每组各10只。实验前12 h开始禁食,自由饮水。
1.2 主要试剂
牛磺胆酸钠(Sigma公司),加蒸馏水配制成5%的溶液备用;丁酸钠(Sigma公司);TUNEL细胞凋亡原位检测试剂盒(美国Promega公司)。
1.3 模型制备
参照Aho等[4]的方法制备SAP组动物模型,大鼠于术前12 h禁食,但可以自由饮水。1%戊巴比妥钠腹腔注射麻醉(0.3 ml/100 g),固定动物消毒,取上腹部正中切口,在手术显微镜下操作,4#头皮针十二指肠外穿刺并找到乳头进入乳头1.0 cm,以动脉夹夹闭肝门及十二指肠远端,注入5%牛磺胆酸钠(剂量0.1 ml/100 g),注射完10 min拔出针头,放开动脉夹,逐层关腹。NaB治疗组即是制作一组SAP模型(10例),手术后10 min通过股静脉途径注射NaB 5 mg/kg。对照组手术过程基本同SAP组,但穿刺十二指肠胰胆管内注射的是等量生理盐水。各组动物于术后12 h在麻醉下剖开腹腔,观察腹水情况,观察胰腺大体病理变化,取胰腺组织用多聚甲醛固定,开胸后观察肺脏,切取右侧肺脏测定肺组织湿/干重比率,并留取左肺上叶标本,以Bouin液固定,供肺组织细胞凋亡(TUNEL)检测。
1.4 检测指标及方法
1.4.1 肺组织湿/干重比值测定 各组大鼠12 h处死后,将称重的肺脏于160℃烘烤24 h后再次称重,计算湿/干重比值。
1.4.2 胰腺及肺组织病理学观测 切取的各组大鼠胰腺及肺组织用多聚甲醛固定,脱水、透明、封片后在光学显微镜下观察胰腺及肺组织的病理学改变,参照Kusske等[5]的方法对胰腺的炎症轻重程度评分。参照Osman等[6]的方法,根据肺实质和空肺泡所占面积的百分比判断肺的炎症及损伤的程度。
1.4.3 肺组织细胞凋亡检测 TUNEL操作步骤按说明书进行,每张切片随机选择5~10个高倍视野,计数1000个肺脏细胞中的凋亡细胞,用百分数表示,作为凋亡指数(apoptosis index,AI)。
1.5 统计学分析
2 结果
2.1 肺组织湿/干重比值、TUNEL法检测肺组织细胞凋亡的结果
大鼠肺组织湿/干重比值在SAP组升高明显,NaB治疗组肺组织湿/干重比值下降,与SAP组比较差异有统计学意义,说明NaB对减轻肺组织水肿有一定作用。对照组肺组织细胞凋亡很少,SAP组有一定数量的肺组织细胞凋亡,NaB治疗组模型大鼠的肺组织细胞凋亡指数高于SAP组(P<0.05)(表 1)。
表1 各组大鼠肺组织湿/干重比值及细胞凋亡检测结果的比较(±s,n=10)

表1 各组大鼠肺组织湿/干重比值及细胞凋亡检测结果的比较(±s,n=10)
与对照组比较,*P<0.01;与SAP组比较,#P<0.05
组别 肺组织湿/干重比值 肺组织细胞AI对照组SAP组NaB治疗组4.36±0.11 5.81±0.23*4.65±0.31#0.25±0.13 5.31±0.37*9.63±0.36#
2.2 各组大鼠胰腺及肺组织病理的变化
对照组胰腺及肺脏未见明显异常,腹腔内无腹水。SAP组大鼠胰腺组织间质水肿,有散在的腺泡坏死灶;胰腺实质内见大量出血和坏死,小静脉扩张,部分胰管破坏,红细胞沉积;间质出血伴有脂肪坏死及大量中性粒细胞浸润,血管扩张。SAP组大鼠肺脏表面有散在出血点,肺泡及间质水肿,间质内红细胞及炎性细胞渗出,有小片状肺不张。NaB治疗组胰腺及肺组织病理改变明显减轻(表2)。
表2 各组大鼠胰腺及肺组织病理变化的比较(±s,n=10)
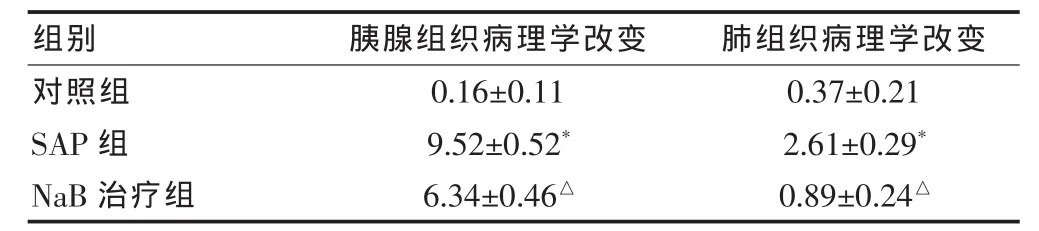
表2 各组大鼠胰腺及肺组织病理变化的比较(±s,n=10)
与对照组比较,*P<0.01;与SAP组比较,△P<0.05
组别 胰腺组织病理学改变 肺组织病理学改变对照组SAP组NaB治疗组0.16±0.11 9.52±0.52*6.34±0.46△0.37±0.21 2.61±0.29*0.89±0.24△
3 讨论
即使明确诊断后经过及时治疗,仍有一部分患者发生ALI甚至ARDS,继而引起MODS,是造成SAP死亡的主要原因[7-8],说明SAP的总体疗效仍不令人满意,原因就是对SAP的发病机制仍未阐明。Kaiser等[9]通过研究SAP大鼠模型发现,胰腺组织内发现大量坏死细胞,炎性细胞浸润,但是凋亡细胞却很少,同时发现轻症胰腺炎胰腺组织内却发现较多量的凋亡细胞,由此可以认为细胞凋亡参与了不同类型胰腺炎的病理过程,诱导凋亡可能会减轻胰腺炎的炎症反应[10-11]。
通过本研究发现,细胞凋亡参与了SAP病变发生及进展的全过程,在SAP发生发展过程中起重要作用。NaB是一种无毒的短链脂肪酸[12]。NaB可以抑制体内外肿瘤细胞增殖、促进细胞分化,并阻滞细胞周期、诱导细胞凋亡的发生[13-14]。但NaB诱导肺组织细胞凋亡以及NaB对SAP及其并发的肺损伤保护作用的实验研究较少。本研究结果显示,NaB对SAP大鼠的胰腺及肺脏具有保护及治疗作用,据实验结果分析可能是诱导细胞凋亡途径可减轻胰腺及肺脏的炎症反应及病理损害,对肺损伤起到保护作用,有效改善重症胰腺炎的预后。NaB引起细胞凋亡的机制可能是内质网中过多蛋白的积累或钙平衡被破坏,引起内质网压力失衡以及半胱氨酸天冬氨酸特异性蛋白酶(caspase)级联活化后激活caspase-12,进而剪切caspase-3引发细胞凋亡[15]。还需要结合凋亡基因、细胞因子及炎症介质的联合检测,才有可能揭示NaB诱导SAP动物模型胰腺及肺组织细胞凋亡机制。
虽然上述研究仅限于实验室水平,但已经提高了对SAP发病机制的认识,随着研究的不断深入,通过诱导细胞凋亡的方式可能有助于提高SAP的诊治水平。
[1]马振华,马清涌.重症急性胰腺炎合并肺损伤发病机制的研究[J].肝胆外科杂志,2005,13(1):72-73.
[2]Shimada M,Andoh A,Hata K,et al.IL-6 secretion by human pancreatic periacinar yofibroblasts in response to inflammatory mediators[J].J Immunol,2002,168(2):861-868.
[3]Fortunato F,Bürgers H,Bergmann F,et al.Impaired autolysosome formation correlates with Lamp-2 depletion:role of apoptosis,autophagy,and necrosis in pancreatitis[J].Gastroenterology,2009,137(1):350-360.
[4]Aho HJ,Koskensalo SM,Nevalainen TJ,et al.Experimental pancreatitis in the rat.Sodium aurocholate induced acute haemorrhagic pancreatitis[J].Scand J Gastroenterol,1980,15 (4):411-416.
[5]Kusske AM,Rongione AJ,Ashley SW,et al.Interleukin-10 prevents death in lethal necrotizing pancreatitis in mice[J].Surgery,1996,120(2):284-288.
[6]Osman MO,Kristensen JU,Jacobsen NO,et al.A monoclonal anti-interleukin 8 antibody (WS-4) inhibits cytokine response and acute lung injury in experimental severe acute necrotising pancreatitis in rabbits[J].Gut,1998,43(2):232-239.
[7]Lee BJ,Kim CD,Jung SW,et al.Analysis of the factors that affect the mortality rate in severe acute pancreatitis[J].Korean J Gastroenterol,2008,51(1):25-33.
[8]Nakamura H,Honda H,Tashiro M,et al.Increased expression of 19-kD interacting protein-3-like protein and the relationship to apoptosis in the lung of rats with severe acute pancreatitis[J].Crit Care Med,2003,31(10):2527-2534.
[9]Kaiser AM,Saluja AK,Lu L,et al.Effects of cycloheximide on pancreatic endonuclease activity,apoptosis,and severity of acute pancreatitis[J].Am J Physiol,1996,271(10):982-989.
[10]Takeyatna Y.Significance of apoptosis cell death in systemic complications with severe acute pancreatitis[J].J Gastroenterol,2005,40(1):11-13.
[11]Hahm KB,Kim JH,You BM,et al.Induction of apoptosis with an extract of Artemisia asiatica attenuates the sevenity of caerulein-induced pancreatitis in rats[J].Pancreas,1998,17(2):153-157.
[12]Cummings JH,Pomare EW,Branch WJ,et al.Short chain fatty acides in human large intestine,portal nepatic and venous blood[J].Gut,1987,28(3):1221-1227.
[13]Mandal M,Kumar R.Bcl-2 expression regulates sodium butyrate-induced apoptosis in human MCF-7 breast cancer cells[J].Cell Growth Differ,1996,12(7):311-318.
[14]Xi L,Wu MF,Feng YD,et al.Selective apoptosis in HeLa cells induced by sodium butyrate and its mechanism[J].Zhongguo Yixue Kexueyuan Xuebao,2003,25(4):401-405.
[15]Curtin M,Glaser K.Histone deacetylase inhibitors: the Abbott experience[J].Curr Med Chem,2003,10(22):2373-2392.
The protective effect of NaB in rats of severe acute pancreatitis-associated lung injury
CUI Yong LI Jie
General Surgery Department,Shekou People′s Hospital of Nanshan Distirct in Shenzhen City,Guangdong Province,Shenzhen 518067,China
ObjectiveTo investigate the protective effects of sodium butyrate on rats of severe acute pancreatitis-associated lung injury.MethodsThe severe acute pancreatitis models rats were established by retrograde injection of sodium taurochoiate into biliopancreatic duct respectively,30 SD rats were randomly divided into control group,SAP group and NaB treatment group.The wet/dry weight ratio of lung,pancreatic and lung pathological changes,lung cell apoptosis were detected.ResultsThe dry ratio of lung reduced in NaB treatment group.The pathological changes of pancreas and lung alleviated obviously.The lung tissue apoptosis rates in the NaB treatment group were higher than those in the SAP group.ConclusionNaB can contribute to the apoptosis of rat lung tissue,alleviate the activation of neutrophil and lung injury.
Sodium butyrate;Severe acute pancreatitis;Cell apoptosis;Lung injury
R657.5+1
A
1674-4721(2013)08(b)-0007-02
广东省医学科研基金立项课题(A2010558)
2013-07-08 本文编辑:林利利)

