吡唑和吡咯类农药残留检测技术研究进展
卢 曦,马继平,闫凤丽
(青岛理工大学环境与市政工程学院,山东 青岛 266033)
该类农药属中等毒性农药并对人类低毒,但随着吡唑和吡咯类衍生物农药的广泛应用,土壤、农作物、蜂蜜、环境水样中都会存在其微量残留。各国规定了其残留量限值,比如:日本“肯定列表制度”规定荷兰豆中氟硅唑的限量分别为0.01mg/kg[2],毛豆中氟虫腈、溴虫腈残留限量分别为0.002,0.05mg/kg[3]。美国环保署规定黄瓜中唑螨酯及其异构体的最大混合残留量为0.10mg/kg[4]。《欧盟饮用水水质指令》水质标准中规定了包括吡唑和吡咯类衍生物农药在内的各农药浓度低于0.10μg/L[5]。我国食品安全国家标准中规定苹果中溴虫腈的最大残留量为1mg/kg,麦类中野燕枯的最大残留量为0.10mg/kg,谷物和蔬菜中氟虫腈的最大残留量为0.02mg/kg[6]。并且,由于许多农作物已对氟虫腈产生抗性及氟虫腈对蜜蜂和水生生物影响较大,我国规定2009年10月1日起禁用氟虫腈。
吡唑和吡咯类衍生物农药的检测方法主要包括气相、液相色谱和气相色谱-质谱联用、液相色谱-串联质谱联用技术,其检测基质以水果[7~9]、蔬菜[10~12]、蜂蜜[13,14]为主,其次是土壤[10,15]和环境水样[16,17]等。近期也有对茶叶[18,19]中吡唑和吡咯类多残留检测的报道。该类农药在基质中痕量存在的特性促进了研究人员对其样品前处理技术和检测技术的研究。本文将对近年来吡唑和吡咯类农药的前处理方法和检测技术的研究进展进行总结。
1 样品前处理技术
由于吡唑和吡咯类农药在环境样品中浓度低、组分复杂,所以需要采用样品前处理技术对目标物进行提取、净化、浓缩等。对吡唑和吡咯类衍生物农药的残留检测中,不同样品的提取和净化方法不同。一般来说,水样的净化过程较简单,但对于农产品等固体样品,净化步骤则较复杂,有时还需多种前处理方法结合使用。
1.1 固体样品前处理方法
固体样品的预处理分为提取和净化富集两步。
1.1.1 提取方法
土壤、蔬菜、茶叶等固体样品中吡唑和吡咯类农药的提取方法包括匀浆提取法、超声波提取法、加压溶剂提取法、超临界流体萃取、微波辅助提取等。
匀浆提取法是将目标分析物从含水量较大的固体样品中提取出来的方法,固体样品 (如水果、蔬菜等)经过打浆后用适当的溶剂经过高速匀浆搅拌机搅拌提取,然后过滤、浓缩净化。萃取溶剂常为有机溶剂 (丙酮、乙腈、正己烷、丙酮-水、乙腈-水等)等。薄怀艳等[9]研究了氟硅唑在苹果中的残留分析方法,样品经丙酮-水 (体积比70∶30)混合溶液高速匀浆提取后,丙酮冲洗残渣,合并滤液并收集到分液漏斗中,用石油醚萃取后在旋转蒸发仪上浓缩,氮气吹干后正己烷定容进入气相色谱-氮磷检测器中测定。该方法最小检出量为 6.0×10-11g,平均回收率为 90.9% ~104.7%。匀浆提取方法操作相对简单,耗时少,提取效果好,但只适用于含水量较大的固体中有机物的提取,且消耗溶剂量较大,易污染环境。
超声波提取法方法以超声波为能源,在液体介质中产生大量看不到的微泡,微泡迅速膨胀、破裂,促使萃取剂与样品亲密接触,并渗入内部,将欲分离组分迅速提取出来。Wu等[18]研究了检测茶叶中溴虫腈等杀虫剂残留的方法。将茶叶磨碎过筛后加入丙酮中,对其超声提取处理,离心后取其上清液用NaCl盐溶液稀释之后用固相微萃取净化,浓缩后进入气相色谱-质谱中分析,该方法对溴虫腈的回收率在80.0%~112.0%。此方法简单快速有效地使有机溶剂与目标物质快速接触,达到很好的提取效果,但是对于待测物质为挥发性质的化合物效果不理想。
加压溶剂提取法 (ASE)是一种在提高温度(50℃ ~200℃)和压力 (1000~3000psi或10.3~20.6MPa)的条件下,用有机溶剂萃取固体或半固体样品的方法。徐敦明等[19]对茶叶中10种吡唑和吡咯类农药的残留量进行了检测,将均匀样品加入ASE萃取池中,在温度100℃、萃取压力1.03×107Pa的条件下,加入乙酸乙酯-正己烷 (1∶1)进行萃取5min,之后固相萃取净化富集进入气相色谱-串联质谱中分析,该方法的回收率为77.86%~104.84%。ASE法具有快速、溶剂用量少、萃取效率高等突出特点,由于其提取效率高,是目前可以取代经典的索氏提取的一种固体样品预处理技术,但需要购买专门的仪器。
超临界流体萃取法 (SFE)利用超临界流体作为萃取剂,从液体和固体中萃取出特定成分,以达到某种分离的目的。Halvorsen等[8]采用超临界流体萃取法对苹果样品进行前处理。苹果样品与硅藻土吸附剂等质量比混合后,唑螨酯在压力200bar、温度90℃的条件下,超临界二氧化碳对其萃取,溶剂收集至乙腈中,将乙腈萃取剂蒸发后加入纯水得到乙腈-水 (40∶60)混合溶液1mL,提取的滤液经0.45μm滤膜过滤后直接进入液相色谱-紫外检测器分析。该方法的回收率在60%左右。SFE法目前多采用CO2作为萃取溶剂,使用有机溶剂量小,无毒、高效、快速,但是SFE法萃取装置复杂,CO2流体为非极性,对于极性化合物提取效率不高,SFE法常用来处理固体样品而不适合分析水样,萃取效率随萃取压力的增加而增大,且在高压下操作有一定危险性,成本较高,使用有限。
微波辅助萃取 (MAE)是在密闭容器中利用微波加热及有机溶剂,将待测有机物组分从样品基体中提取出来的一种方法。Moure等[15]采用微波辅助溶剂萃取方法对土壤样品进行前处理,在土壤中加入 Marlon A375或苯扎氯铵 (BAC)、盐酸(37%)、氢氟酸 (48%)和硝酸 (65%)在30min内达到温度 200℃,800W后微波提取20min,之后加入硼酸水溶液 (4%)继续萃取,在15min内达到温度180℃,800W后萃取15min,经过提取的样品用SPE硅土柱净化后进入液相色谱-紫外检测器分析,检测了土壤样品中的野燕枯。该方法的回收率为102% ~109%。MAE法具有节约能源和时间、溶剂用量小、对环境友好等优点,但影响微波萃取的因素较多,萃取条件需要自己摸索。
1.1.2 净化富集方法
从以上固体基质样品中提取出来的样品溶液,还需要净化或浓缩才能满足分析方法的要求。文献报道的吡唑和吡咯类衍生物农药的净化方法主要有液液萃取、固相萃取、固相微萃取、基质固相分散萃取等。
(1)液液萃取法
Cao等[10]研究了溴虫腈在卷心菜和土壤中的残留分析方法。样品用丙酮-水 (体积比70∶30)混合溶液振荡提取,取上清液浓缩后加入盐溶液后放入分液漏斗中,用二氯甲烷萃取后在旋转蒸发仪上浓缩,进入液相色谱中分析。该方法的溴虫腈的回收率在土壤和卷心菜中分别为93.3%和90.6%,溴虫腈最小检测浓度为0.0162mg/kg。液液萃取法简便、快速,但是净化富集效率低、有机试剂使用量大、自动化程度低。
为避免液液萃取中使用有害的有机溶剂,Pérez等[20]采用离子液体作为萃取剂,对香蕉中戊唑醇等杀虫剂的残留量进行了检测。具体做法是:水果样品用乙腈匀浆萃取后,离心将上清液浓缩后加入10mL水,采用离子液体 [C6MIM][PF6]作为萃取剂,平均回收率在69%~97%之间,检出限为0.320μg/kg~4.66μg/kg。
(2)固相萃取法 (SPE)
固相萃取技术 (SPE)基于物质相互作用的相似相溶机理,通过多孔固相吸附剂选择性地吸附溶液中的被测物质,然后用体积较小的另一种溶剂洗脱被测物质。与液液萃取相比,固相萃取富集倍数高,有机溶剂用量少,操作简单,易于实现自动化,但是对于污染严重的复杂样品,尤其是含有胶体或固体小颗粒的样品会堵塞固定相的微孔结构引起柱容量降低、萃取效率严重恶化[21,22]。
徐敦明等[19]对茶叶中10种吡唑和吡咯类农药的残留量进行了检测,乙酸乙酯-正己烷 (1∶1)加压溶剂提取,之后采用固相萃取柱净化,考察了活性炭/氧化铝、Envi-Carb/PSA和 Envi-Carb/SAX/PSA柱对茶叶中分析目标物的净化效果,使用乙酸乙酯-正己烷 (1∶1)洗脱,结果表明经Envi-Carb/PSA和Envi-Carb/SAX/PSA净化后的总体回收率满足农药残留分析要求,但是Envi-Carb/SAX/PSA柱价格昂贵,在净化效果相近的情况下,最终选择成本较低的Envi-Carb/PSA柱。
(3)固相微萃取法 (SPME)
固相微萃取法 (SPME)是基于固相与样品之间的平衡而建立起来的集进样、萃取、浓缩功能于一体的技术。将纤维头浸入样品溶液中或顶空气体中一段时间,同时搅拌溶液以加速两相间达到平衡的速度,待平衡后将纤维头取出插入气相色谱气化室,热解吸涂层上吸附的物质。被萃取物在汽化室内解吸后,靠载气将其导入色谱柱。此方法兼具简便、快速、选择性好、灵敏度高、经济安全、环境友好等优点,但萃取纤维使用寿命低,且方法的精密度不如固相萃取法[23~26]。
周昱等[27]采用丙酮-正己烷 (1∶2)超声提取茶叶中的氟虫腈及其代谢物 (脱亚硫酰基氟虫腈、硫化氟虫腈、氟虫腈砜和酰胺氟虫腈),离心取上清液后,采用两种不同的SPME萃取头聚丙烯酸酯(PA)和聚二甲硅氧烷 (PDMS)净化富集。结果表明,PA萃取头对氟虫腈及其代谢物的萃取效率高于PDMS萃取头,与SPE净化比较,经SPME后的样品的杂峰明显比SPE处理后的样品的杂峰少,但萃取回收率不存在明显差异。此方法对目标物的回收率在71.2% ~109.3%。Wu等[18]采用丙酮超声提取茶叶中的溴虫腈,离心后取其上清液,以单壁碳纳米管 (SWCNTs)作为萃取头的固相微萃取法净化富集,比较了SWCNTs、PDMS和PA 3种SPME萃取纤维头对溴虫腈的净化效果。结果表明,SWCNTs的富集效果明显优于PDMS和PA的富集效果,且SWCNTs纤维的价格更便宜。溴虫腈的回收率在80.0%~112.0%。
1.1.3 其他技术
(1)基质固相分散萃取
基质固相分散萃取 (MSPD)是1989年由Barker等发明的一种新型样品前处理方法[28]。其原理是将涂有吸附剂如C8、C18等多种固相萃取材料与固体、半固体或黏性的样品一起研磨,得到半干状态的混合物并将其作为填料装柱,然后用不同的溶剂淋洗柱子,将各种待测物洗脱下来。MSPD技术样品和有机溶剂用量少,污染小,并避免了对样品均化、沉淀、离心等环节可能造成的待测物的损失,但是由于吸附材料是极性的,对于非极性农药残留处理效果不好,且MSPD更适合分析某一类化合物,另外MSPD需要手工研磨混合样品和吸附剂,自动化程度不高。
王进等[7]对柑桔中唑螨酯残留进行了检测。首先对样品进行基质固相分散萃取,加入无水硫酸钠 (用于吸收样品中的水分)及氧化铝,研磨样品直至成近干燥粉末状,用乙酸乙酯淋洗收集洗脱液氮吹近干后用石油醚溶解残留物,之后过氧化铝柱层析净化,用石油醚/乙酸乙酯 (7∶1)淋洗去除杂质后用石油醚/乙酸乙酯 (3∶1)混合液洗脱,洗脱液浓缩至干,甲醇定容进入液相色谱分析。该方法唑螨酯的最低检出浓度为0.0625mg/kg,方法的回收率在81.9%~96.3%之间。
(2)QuEChERS法
QuEChERS是 Quick(快速)、Easy(简单)、Cheap(便宜)、Effective(高效)、Rugged(耐用)和Safe(安全)的缩写。由美国农业部Anastassiades等[29]在2003年开发的一种快速、简便的预处理方法来实现高质量的农药多残留物分析方法。QuEChERS方法的主要步骤:样品经粉碎后,用乙腈提取,加入MgSO4等盐类除水,再加入N-丙基乙二胺 (PSA)和石墨化碳黑 (GCB)等吸附剂除杂,取上清液进入色谱中检测。QuEChERS方法回收率高,溶剂使用量少,污染小,价格低廉,操作简便,但只适合极性农药残留的提取净化,适用范围有待拓宽,且目前采用的吸附剂种类有限。
朱建华等[30]研究了同时测定蔬菜和水果中唑虫酰胺、氟啶虫酰胺、氯虫苯甲酰胺和氟虫双酰胺残留量的方法,样品经乙腈匀浆提取后,离心取上清液加入装有 QuEChERS填料 (所有蔬菜和水果均装有PSA 100mg和MgSO4300mg,菠菜和青菜等蔬菜还加有GCB 20mg)的离心管中进行净化处理,剧烈振荡30s后,离心取上清液,氮气吹干,乙腈-水 (20∶80)定容至1mL过0.22μm滤膜后进入液相色谱-串联质谱中分析,目标物的回收率在80% ~95%,检出限为0.0005mg/kg~0.005 mg/kg。
1.2 液体样品前处理方法
有关水中吡唑和吡咯类农药残留检测的研究报道不多,样品前处理主要采用固相萃取、固相微萃取及分散液液微萃取技术。
Nunez等[16]采用固相萃取技术富集饮用水中的吡唑类衍生物除草剂野燕枯,比较了HyperSep Hypercarb柱和Envi-Carb柱对饮用水中目标分析物的富集效果,结果表明Envi-Carb柱的保留效果不理想,而HyperSep Hypercarb柱的保留效果较好,使用乙腈-三氟乙酸 (80∶20)作为萃取剂,萃取剂浓缩后进入毛细管电泳进行分析,该方法检出限是0.08μg/L,回收率在80%以上。Jimenez等[13]研究了固相萃取柱中不同吸附剂对提取蜂蜜中氟虫腈残留量的方法,将蜂蜜溶于水中进行固相萃取,比较了 Florisil柱、Oasis HLB、Strata X、Envi-Carb和ODS 5种SPE柱的净化效果,分别使用正己烷-二氯甲烷 (1∶1)、甲醇、甲醇、乙酸乙酯和丙酮洗脱,结果表明,Florisil柱提取和净化氟虫腈杀虫剂的效果和回收率较好。
Vílchez等[31]采用 PA 萃取头的固相微萃取富集,气相色谱-质谱检测了环境水样中的氟虫腈,方法检出限为0.08μg/L。
分散液液微萃取法 (DLLME)是由Rezaee等[32]在2006年首次提出的一种新型的液相微萃取技术。DLLME的主要过程是:用微量注射器将萃取溶剂和分散溶剂快速注入样品溶液中;水相/萃取剂/分散剂形成浑浊现象,此时,萃取剂在分散剂的作用下,在样品溶液中形成无数微小液滴,增大了与水相的接触面积,大大缩短了萃取平衡所需要的时间,可以达到很高的萃取效率和富集倍数;离心后,分析物被萃取到萃取溶剂中并从水相中分离。使用萃取溶剂量非常小,避免了萃取剂微滴的不稳定性,又加快了萃取速度,提高了萃取效率和富集倍数,且操作简便、消耗低,环境友好,是一种有发展潜力的分离富集技术,但其对于水溶性有机化合物萃取效率低[33,34]。Liu 等[17]研究了离子液体-分散液液微萃取法检测饮用水和地表中氟虫腈和溴虫腈的方法,采用了 [C6MIM][PF6]离子液体作为萃取剂,萃取后进入高效液相色谱-二极管阵列检测器中分析,该方法的富集倍数为209~276,回收率为 79% ~84%,方法检出限是0.53μg/L ~ 1.28μg/L。Tomasini 等[35]比 较 了DLLME与改进QuECHERS方法萃取蜂蜜中氟虫腈残留量的优缺点,萃取后进入高效液相色谱-二极管阵列检测器中分析,两种方法的回收率分别为70.7% ~101.1% 和76.3% ~87.7%,定量限分别为0.03mg/kg和0.6mg/kg。经比较,DLLME使用有机溶剂量小,萃取速度快,但是改进QuEChERS方法更加稳定并且适用于更复杂的样品。
下表总结了近年来不同样品中吡唑和吡咯类衍生物农药的提取净化方法及其萃取回收率。
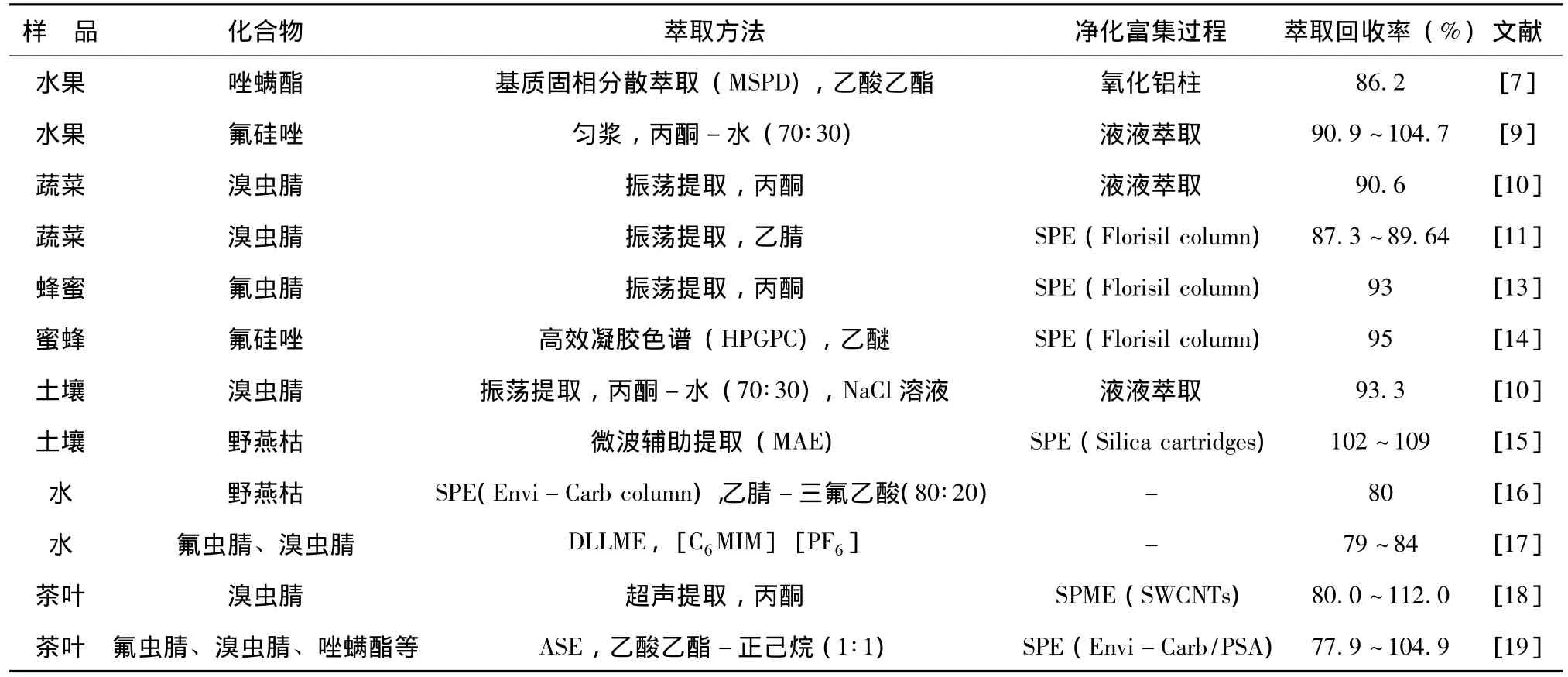
表 不同样品基质中吡唑和吡咯类农药的前处理方法与萃取回收率Tab.Pretreatment method and extraction recovery of pyrazoles and pyrroles pesticides in different samples
2 色谱检测技术
2.1 气相色谱法 (GC)和气相色谱-质谱联用(GC-MS)
吡唑和吡咯类衍生物农药残留最常用的检测方法 气 相 色 谱 法[9,11,13,14], 常 采 用 氮 磷 检 测 器(NPD)或电子捕获检测器 (ECD)。我国《杂环类农药工业水污染物排放标准》(GB 21523-2008)附录中列出的废水中氟虫腈的测定方法即采用气相色谱法[36]。秦旭等[37]采用气相色谱 - 氮磷检测法(GC-NPD)检测土壤和甘蓝中唑虫酰胺,土壤和甘蓝中唑虫酰胺最小检出量均为2×10-11g,最低检出质量均为0.003mg/kg。郭敏等[38]采用气相色谱-电子捕获检测法 (GC-ECD)检测土壤中氟虫腈农药及其代谢产物残留,氟虫腈及其代谢产物在土壤样品中最低检测浓度均可达 0.001mg/kg,回收率在 79% ~111%之间,相对标准偏差在1.2% ~9.5%之间。
GC法对未知样品中物质难以定性,且GC法对于沸点较高的物质无法检测。GC-MS分析方法选择特定离子进行检测,可同时给出结构信息,能用于相似结构的吡唑和吡咯类衍生物农药的多残留分析,是一种很好的分析检测手段。Jimenez等[13]分别采用GC-ECD和GC-MS方法检测蜂蜜中氟虫腈及其代谢物残留量。结果表明,采用GCECD分析方法,方法检出限是0.6μg/kg,加标回收率为72%~93%,5次测定结果的相对标准偏差为4.4%~8.0%。采用GC-MS分析方法,方法检出限是0.3μg/kg,加标回收率为94% ~108%,5次测定结果的相对标准偏差为5.4%~9.1%。徐敦明等[19]利用GC-MS/MS对茶叶中10种吡唑和吡咯类农药的残留量进行了检测。该方法的定量限为0.001mg/kg~0.005mg/kg,回收率在77.86% ~104.84%之间,相对标准偏差为3.55% ~17.50%。Bichon等[39]采用GC-MS/MS对绵羊血浆中氟虫腈及其代谢物检测。该方法的线性范围为0.25 μg/L ~2000μg/L,检出限为0.05μg/L ~0.16 μg/L。
2.2 液相色谱法 (HPLC)和液相色谱-串联质谱联用 (LC-MS/MS)
吡唑和吡咯类农药大部分具有较强的紫外吸收,因此可以采用高效液相色谱仪-紫外检测,Cao等[10]采用HPLC-UV检测土壤和甘蓝中溴虫腈残留量。土壤和甘蓝中溴虫腈残留量平均回收率分别为93.3%和90.6%,重现性分别为2.8%~11.2%和1.7%~11.8%。溴虫腈最小检出量为0.65ng,最低检出质量为0.0162mg/kg。但HPLC法的灵敏度低且无法定性,因此对样品的净化程度要求很高。LC-MS分析法灵敏度高、前处理简单、可同时给出结构信息,是一种很好的分析检测手段,但是仪器价格昂贵,操作较复杂,目前难以普及。Moure等[15]分别采用 LC-UV和 LC-MS/MS方法检测土壤样品中野燕枯的残留量。结果表明,采用LC-UV分析方法,野燕枯的线性范围为20μg/L ~1000μg/L,方法检出限为 20μg/kg。采用LC-MS/MS分析方法,野燕枯的线性范围为0.5μg/L ~100μg/L,方法检出限为 2.5μg/kg。朱建华等[30]采用HPLC-MS/MS测定蔬菜和水果中唑虫酰胺残留量,唑虫酰胺的线性范围为0.075mg/L~2.0mg/L,检出限为 0.0008mg/kg,回收率在80%~95%。
2.3 其他方法
Nunez等[40]利用毛细管电泳方法有效分离和定量测定了环境水样中野燕枯等3种除草剂的残留。采用样品堆积技术对水样中的痕量除草剂浓缩分离,进而提高检测灵敏度。野燕枯的方法检出限为0.08μg/L,5次测定结果的相对标准偏差为6.3% ~7.6%。
Wu等[41]利用凝胶渗透色谱法有效分离和定量测定了食品中多种杀虫剂的残留,其中包括氟虫腈和溴虫腈等。采用加速溶剂萃取的方法对食品中杀虫剂进行提取,氟虫腈和溴虫腈的方法检出限分别为0.2μg/kg和2.2μg/kg,氟虫腈和溴虫腈6次测定结果的加标回收率分别为62.4%~90.7%和66.2%~98.8%,相对标准偏差分别为6.5%~16.4%和12.8%~13.7%。
3 展望
目前有关吡唑和吡咯类衍生物农药残留的检测主要采用气相色谱、高效液相色谱、气相色谱-质谱及液相色谱-串联质谱技术。但由于该类化合物残留量低,基体复杂,样品前处理过程显得尤为重要。基于分析物的多样性和复杂性,对前处理方法提出了越来越高的要求,样品前处理技术也在不断更新和完善,向简单、快速、低廉、试剂消耗少、环境友好的方向发展。有关土壤、茶叶、蔬菜等固体样品中该类物质的前处理技术中,集提取与净化一体的基质固相分散萃取及QuEChERS方法快捷、方便、高效,应引起重视。水样的前处理技术中固相萃取、固相微萃取、分散液液微萃取都有各自的优势,对不同方法的比较研究还有待开展。目前尚无该类农药检测的自动在线的样品预处理方法,今后应是重点发展的方向之一。此外,针对此类杀虫剂和除草剂的多残留检测目前报道不多,应加强此类除草剂的多残留检测方法开发及应用。
[1]郎玉成,柏亚罗.吡唑类农药品种的研究开发进展[J].现代农药,2006,5(5):6-12.
[2]王连珠,王登飞,郑俊超,等.气相色谱-质谱法测定荷兰豆中氟硅唑、丙环唑、苯醚甲环唑残留量[J].理化检验-化学分册,2006,42(12):1025-1028.
[3]陈树兵,俞雪钧,贺小雨,等.气相色谱法测定毛豆中一些残留杀虫剂[J]. 理化检验-化学分册,2008,44(10):924-926.
[4]EPA-HQ-OPP-2008-0556,Federal Register[S].
[5]Council Directive 98/83/Ec,on the Quality of Water Intended for Human Consumption[S].
[6]GB 2763-2012,食品安全国家标准食品中农药最大残留限量[S].
[7]王 进,岳永德,花日茂,等.基质固相分散-液相色谱法测定柑桔中唑螨酯残留[J].食品科学,2007,28(1):239-242.
[8]Halvorsen B L,Thomsen C,Greibrokk T,Lundanes E.Determination of fenpyroximate in apples by supercritical fluid extraction and packed capillary liquid chromatography with UV detection[J].J Chromatogr A,2000,(880):121-128.
[9]薄怀艳,侯志广,孙 慧,等.气相色谱法测定苹果中氟硅唑的残留量[J]. 农药,2011,50(4):281-282.
[10]Cao Yongsong,Chen Jiuxin,Wang Yuelong,et al.HPLC/UV analysis of chlorfenapyr residues in cabbage and soil to study the dynamics of different formulations[J].Sci Total Environ,2005,350:38-46.
[11]Rahman Md.Mus fiqur,Choi Jeong-Heui,El-Aty A.M.Abd,et al.Determination of chlorfenapyr in leek grown under greenhouse conditions with GC-μECD and confirmation by mass spectrometry[J].Biomed Chromatogr,2012,26(2):172-177.
[12]Walorczyk Stanis|/aw,Drozdzynski Dariusz,Kowalska Jolanta,et al.Pesticide residues determination in Polish organic crops in 2007-2010 applying gas chromatography-tandem quadrupole mass spectrometry[J].Food Chem,2013,139:482-487.
[13]Jimenez J J,Bernal J L,Del Nozal M J,et al.Sample preparation methods to analyze fipronil in honey by gas chromatography with electron-capture and mass spectrometric detection[J].J Chromatogr A,2008,1187:40-45.
[14]Charlton Andrew J A,Jones Ainsley.Determination of imidazole and triazole fungicide residues in honeybees using gas chromatography– mass spectrometry[J].J Chromatogr A,2007,1141:117-122.
[15]Moure Miriam Pateiro,Carballo Elena Martinez,Estevez Manuel Arias,et al.Determination of quaternary ammonium herbicides in soils Comparison of digestion,shaking and microwave-assisted extractions[J].J Chromatogr A,2008,1196-1197:110-116.
[16]Nunez O,Moyano E,Galceran M T.Solid-phase extraction and sample stacking–capillary electrophoresis for the determination of quaternary ammonium herbicides in drinking water[J].J Chromatogr A,2002,946:275-282.
[17]Liu Yu,Zhao Er-cheng,Zhu Wen-tao,et al.Determination of four heterocyclic insecticides by ionic liquid dispersive liquid–liquid microextraction in water samples[J].J Chromatogr A,2009,1216:885-891.
[18]Wu Fang,Lu Wan-ping,Chen Jing-hua.Single-walled carbon nanotubes coated fibers for solid-phase microextraction and gas chromatography–mass spectrometric determination of pesticides in Tea samples[J].Talanta,2010,82:1038-1043.
[19]徐敦明,卢声宇,陈达捷,等.加速溶剂萃取-气相色谱-串联质谱法测定茶叶中10种吡唑和吡咯类农药的残留量[J].色谱,2013,31(3):218-222.
[20]Ravelo-Pérez Lidia M,Hernández-Borges Javier,Asensio-Ramos María,et al.Ionic liquid based dispersive liquid – liquid microextraction for the extraction of pesticides from bananas[J].J Chromatogr A,2009,1216(43):7336-7345.
[21]Ma Ji-ping,Xiao Rong-hui,Li Jin-hua,et al.Determination of 16 polycyclic aromatic hydrocarbons in environmental water samples by solid-phase extraction using multi-walled carbon nanotubes as adsorbent coupled with gas chromatography-mass spectrometry[J].J Chromatogr A,2010,1217(34):5462-5469.
[22]马继平,李 茉,赵秀华,等.固相萃取-反相高效液相色谱法测定水中的邻苯二甲酸酯[J].分析试验室,2009,28(3):6-9.
[23]Arthur C L,Pawliszyn J.Solid phase-with Thermal Desorption using Fused Silica Optical Fibers[J].Anal Chem,1990,62:2145-2148.
[24]马继平,王涵文,关亚风.固相微萃取新技术[J].色谱,2002,20(1):16-20.
[25]马继平,陈令新,丁明玉.微液相色谱分离的在线样品预处理技术—固相微萃取和膜萃取[J].分析测试学报,2005,24(4):116-121.
[26]Ma Ji-ping,Xiao Rong-hui,et al.Headspace Solid-phase Microextraction with On-fiber Derivatization for the Determination of Aldehydes in Algae by Gas Chromatography-mass Spectrometry[J].J Sep Sci,2011,34(12):1477-1483.
[27]周 昱,徐敦明,陈达捷,等.固相微萃取-气相色谱法和气相色谱-质谱法测定茶叶中氟虫腈及其代谢物残留[J].色谱,2011,29(7):656-661.
[28]Barker S A,Long A R,Short C R.Isolation of drug residues from tissues by solid phase dispersion[J].J Chromatogr,1989,475:353-361.
[29]Anastassiades M,Lehotay S J,Stajnbaher D,et al.Fast and easy multi-residue method employing acetonitrile extraction/partitioning and“dispersive solid-phase extraction”for the determination of pesticide residues in produce[J].AOAC International,2003,86(2):421-431.
[30]朱建华,赵 莉.液相色谱-串联质谱法测定果蔬中的唑虫酰胺、氟啶虫酰胺、氯虫苯甲酰胺及氟虫双酰胺残留[J].分析测试学报,2011,30(6):646-650.
[31]Vílchez José Luis,Prieto Avismelsi,Araujo Lilia,et al.Determination of fipronil by solid-phase microextraction and gas chromatography-mass spectrometry[J].J Chromatogr A,2001,919(1):215-221.
[32]Rezaee Mohammad,Assadi Yaghoub,Hosseini Mohammad-Reza Milani,et al.Determination of organic compounds in water using dispersive liquid-liquid microextraction[J].J Chromatogr A,2006,(1116):1-9.
[33]邓 勃.一种新的液液萃取模式—分散液液微萃取[J].现代科学仪器,2010,3(3):123-130.
[34]Ma Ji-ping,Lu Wen-hui,Chen Ling-xin.Recent Advances in Dispersive Liquid-Liquid Microextraction for Organic Compounds Analysis in Environmental Water:A Review[J].Current Anal Chem,2012,8(1):78-90.
[35]Tomasini Débora,Sampaio Maicon R F,Cardoso Liziane V,et al.Comparison of dispersive liquid-liquid microextraction and the modified QuEChERS method for the determination of fipronil in honey by high performance liquid chromatography with diode-array detection[J].Anal Methods,2011,3:1893-1900.
[36]GB 21523-2008,杂环类农药工业水污染物排放标准[S].
[37]秦 旭,孙 扬,秦冬梅,等.唑虫酰胺在土壤和甘蓝中的气相色谱分析[J]. 农药,2009,48(9):660-661.
[38]郭 敏,宗良纲,单正军,等.加速溶剂萃取-气相色谱法测定土壤中氟虫腈农药及其代谢产物残留[J].农业环境科学学报,2008,27(5):2114-2117.
[39]Bichon E,Richard C A,Le Bizec B.Development and validation of a method for fipronil residue determination in ovine plasma using 96-well plate solid-phase extraction and gas chromatography-tandem mass spectrometry[J].J Chromatogr A,2008,1201:91-99.
[40]Nunez O,Moyano E,Puignou L,et al.Sample stacking with matrix removal for the determination of paraquat,diquat and difenzoquat in water by capillary electrophoresis[J].J Chromatogr A,2001,912:353-361.
[41]Wu Gang,Bao Xiao-xia,Zhao Shan-hong,et al.Analysis of multi-pesticide residues in the foods of animal origin by GC-MS coupled with accelerated solvent extraction and gel permeation chromatography cleanup[J].Food Chem,2011,126:646-654.

