响应面法优化枇杷核多糖的提取工艺
吴竹青,黄 群,2,余 佶,2,喻林波
(1.吉首大学食品科学研究所,湖南吉首416000;2.吉首大学植物保护与利用湖南省高校重点实验室,湖南吉首416000)
枇杷(Eriobotrya japonica(Thunbl)Lindl)为蔷薇科植物,我国长江以南各省均有栽培,是我国特产水果,种植面积达11万余公顷,年产量40余万t,占世界枇杷鲜果总量的一半以上,按果核占果实重量的15%计算,每年将产生6万t左右的枇杷核废弃物。关于枇杷及其综合利用研究主要涉及果汁、果酒等产品的研制,枇杷果实和果核的组成成分及营养价值分析[1-5],枇杷果核中黄酮类、苦杏仁甙等的提取[6-7],枇杷叶多糖的提取等[8-11],但未见关于枇杷核多糖提取及应用研究的相关报道。目前,可用于多糖提取的方法主要有水提、酶法提取、超声波辅助提取、超声-微波协同萃取等技术[8-13]。本实验采用响应面法研究不同酶解条件对枇杷核中多糖得率的影响,优化枇杷核多糖提取工艺条件,为枇杷核资源的综合利用提供实验参考。
1 材料与方法
1.1 材料与仪器
枇杷核 产自湖南省湘西自治州吉首市,干燥至水分含量为7%左右,粉碎过40目筛,密封保存备用;纤维素酶2000U/g 南宁东恒华道生物科技有限责任公司;蒽酮、浓硫酸、葡萄糖、95%乙醇等 国产分析纯。
722型可见分光光度计 上海舜宇恒平科仪;PHS-25数字式pH计 上海日岛科仪;CDE-220E多功能食品处理机 佛山市顺德区欧科电器有限公司;KQ-250E型超声波清洗器 昆山市超声波仪器制造厂;HH.S型精密恒温水浴锅 江苏金坛市医疗仪器厂;GZX-9246MBE数显热鼓风干燥箱 上海博迅实业;LXJ-IIB离心机 上海安亭科学仪器厂。
1.2 实验方法
1.2.1 枇杷核多糖提取工艺流程 枇杷核→干燥→粉碎→过筛→称量→料液混匀→超声波处理→调节pH→酶解处理→离心分离→加95%的乙醇沉淀→离心→取沉淀→干燥→枇杷核多糖粗品
1.2.2 标准曲线的绘制与枇杷核多糖含量的测定精确称取葡萄糖10mg,加蒸馏水100mL溶解,定容配制0.1mg/mL葡萄糖标准溶液,然后吸取标液0、0.2、0.4、0.6、0.8、1.0mL 于 10mL 带塞比色管中,加蒸馏水至2mL,加入5mL蒽酮-硫酸溶液,摇匀放置10min,以加入葡萄糖溶液为0mL的比色管作为参比,在吸收波长490nm处测定其吸光度值[14]。以葡萄糖质量为横坐标,吸光值A为纵坐标,绘制标准曲线,得到回归方程y=2.06x-0.0003,相关系数R2=0.9998。
枇杷核多糖含量测定采取硫酸-蒽酮法,根据标准曲线回归方程计算出枇杷核多糖含量[14]。
1.2.3 单因素实验 分别考察料液比、超声处理温度、超声处理时间、纤维素酶用量、酶解温度、酶解时间、酶解pH对枇杷核多糖提取效果的影响。
1.2.4 响应面优化实验 在上述单因素实验基础上,根据Box-Behnken中心组合设计原理,选取纤维素酶用量、酶解温度、酶解pH、酶解时间为主要考察因素,实验因素水平见表1,以枇杷核多糖得率为响应值,进行中心组合实验设计,得出相关实验数据,采用SAS 8.1软件对所得数据进行处理,得到枇杷核多糖提取的优化工艺参数,并开展验证性实验[15-16]。
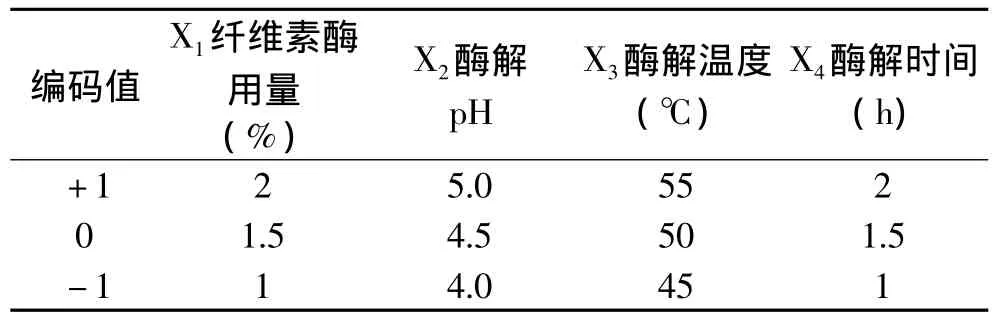
表1 Box-Behnken实验设计因素水平表Table 1 Experimental variables and levels for the Box-Behnken experimental design
1.2.5 枇杷核多糖得率的计算 计算公式如下:
枇杷核多糖得率(%)=枇杷核多糖的质量(g)/干燥枇杷核质量(g)×100
2 结果与分析
2.1 枇杷核多糖提取单因素实验
2.1.1 料液比对多糖得率的影响 在超声处理温度60℃、超声处理时间30min、纤维素酶用量1.5%、酶解温度50℃、酶解pH4.5和酶解时间2h的条件下,考察不同的料液比对枇杷核多糖提取效果的影响,结果见图1。
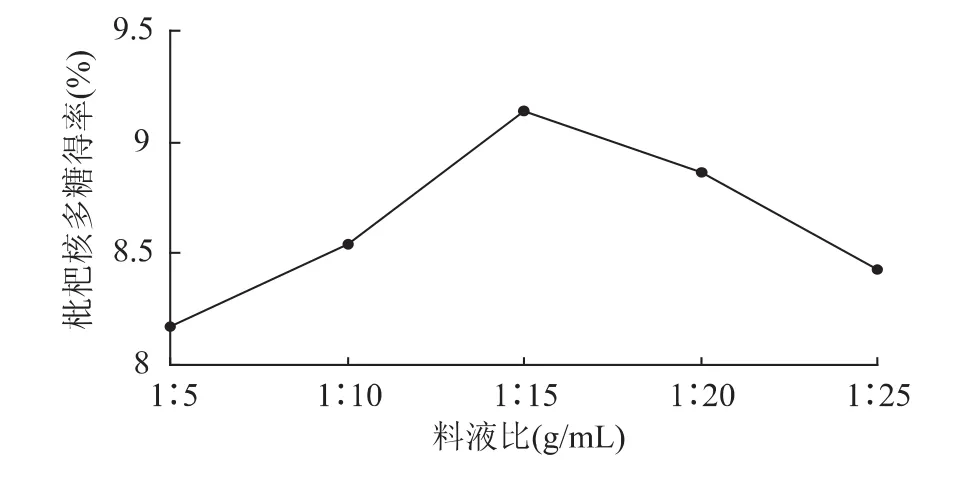
图1 料液比对枇杷核多糖得率的影响Fig.1 Effect of material-water ratio on loquat core polysaccharide yield
由图1可知,随着液体比例增加,多糖得率开始上升,在料液比1∶15时达到最高,继续增大液体比例多糖得率开始下降。当液体含量较小时,体系黏稠度较大,经超声处理后体系内乳化现象严重,酶与底物接触不充分,导致酶解效果较差;随着液体比例的增加,乳化现象减弱,酶解效果增强,而当液体比例比较大时,底物浓度较低,反而影响了酶解效果,导致多糖得率下降,综合考虑选择料液比1∶15较适宜。
2.1.2 超声处理温度对多糖得率的影响 在料液比1∶15(g/mL)、超声处理时间 30min、纤维素酶用量1.5%、酶解温度50℃、酶解pH4.5、酶解时间2h的条件下,考察不同的超声处理温度对枇杷核多糖提取效果的影响,结果见图2。
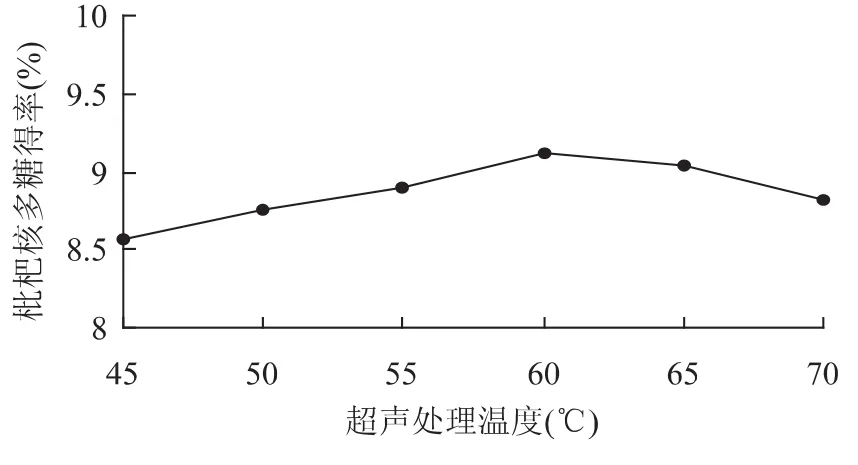
图2 超声波处理温度对枇杷核多糖得率的影响Fig.2 Effect of ultrasound treament temperature on loquat core polysaccharide yield
由图2可知,超声处理温度为60℃时多糖得率最高。当超声处理温度较低时,分子扩散运动能力较小,物料的空化作用不够完全,影响多糖得率;当温度高于60℃后,物料略有糊化而造成枇杷核多糖得率降低,故选超声处理温度为60℃为宜。
2.1.3 超声处理时间对多糖得率的影响 在料液比1∶15(g/mL)、超声处理温度 60℃、纤维素酶用量1.5%、酶解温度50℃、酶解pH4.5、酶解时间2h的条件下,考察不同的超声处理时间对枇杷核多糖提取效果的影响,结果见图3。
由图3可知,随着超声处理时间的延长,枇杷多糖得率不断提高,当超声处理时间超过30min以后,枇杷核多糖得率增加不明显。这是由于超声波作用在开始阶段对细胞膜的破碎作用较大,溶出物多,得率不断升高,当溶解度达到饱和时,有效成分不再溶出,故选择超声处理时间为30min。
2.1.4 纤维素酶用量对多糖得率的影响 在料液比1∶15(g/mL)、超声处理温度 60℃、超声处理时间30min、酶解温度50℃、酶解 pH 4.5、酶解时间2h的条件下,考察不同的纤维素酶用量对枇杷核多糖提取效果的影响,结果见图4。
在洛阳城里,从朝阳到夕阳,平时温暖的风,渐渐有了寒意,平时那些充满活力的翠绿叶子,也变成了经历人间沧桑的枯黄叶子,以往繁华热闹的街道也变得冷清了,洛阳城里一切都变了。
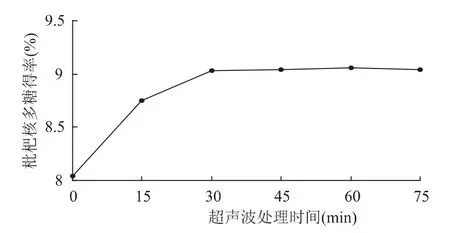
图3 超声处理时间对枇杷核多糖得率的影响Fig.3 Effect of ultrasound treatment time on loquat core polysacchrride yield
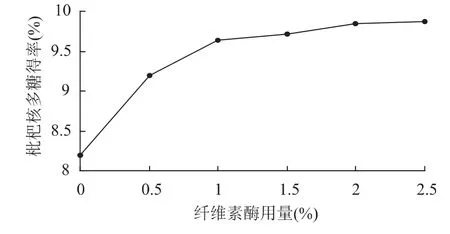
图4 纤维素酶用量对枇杷核多糖得率的影响Fig.4 Effect of amount of enzyme on loquat core polysaccharedes yield
由图4可见,纤维素酶用量在0~1%时,多糖得率变化明显,原因是纤维素酶能有效破坏其细胞壁结构,使内部的多糖释放出来,继续增加酶用量多糖得率增加缓慢。综合考虑纤维素酶用量以1.5%为宜。
2.1.5 酶解温度对多糖得率的影响 在料液比1∶15(g/mL)、超声处理温度60℃、超声处理时间30min、纤维素酶用量1.5%、酶解pH4.5、酶解时间2h的条件下,考察不同的酶解温度对枇杷核多糖提取效果的影响,结果见图5。
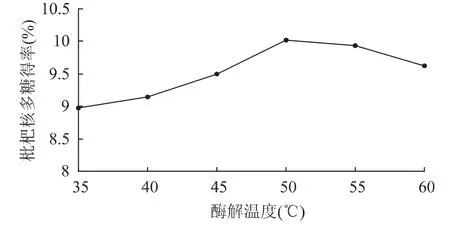
图5 酶解温度对枇杷核多糖得率的影响Fig.5 Effect of enzyme hydrolysis temperature on loquat core polysaccharides yield
从图5可知,温度升高,多糖得率逐渐增加,当温度高于50℃时,多糖产率开始下降。这是因为当温度升高时,分子热运动加快,活化分子数增多,反应速度加快,但超过最适温度后,随着温度升高酶蛋白开始变性,酶活力降低,从而影响多糖得率。因此,酶解温度以50℃为宜。
2.1.6 酶解时间对多糖得率的影响 在料液比1∶15(g/mL)、超声处理温度60℃、超声处理时间30min、纤维素酶用量1.5%、酶解温度50℃、酶解pH4.5的条件下,考察不同的酶解时间对枇杷核多糖提取效果的影响,结果见图6。
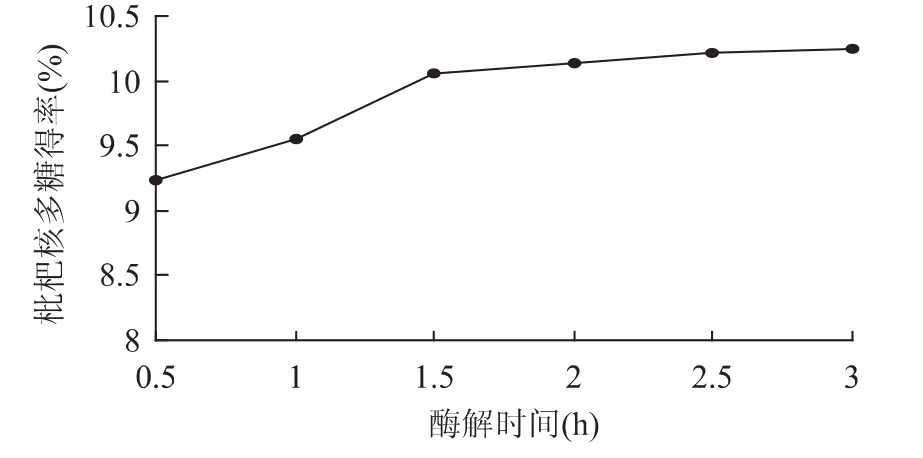
图6 酶解时间对枇杷核多糖得率的影响Fig.6 Effect of enzyme hydrolysis time on loquat core polysaccharide yield
由图6可知,随着酶解时间的增加,枇杷核多糖得率逐渐增加。当酶解时间超过1.5h后,多糖得率的增加趋于平缓。综合考虑酶解时间取1.5h左右为宜。
2.1.7 酶解pH对多糖得率的影响 在料液比1∶15(g/mL)、超声处理温度60℃、超声处理时间30min、纤维素酶用量1.5%、酶解温度50℃、酶解时间2h的条件下,考察不同的酶解pH对枇杷核多糖提取效果的影响,结果见图7。
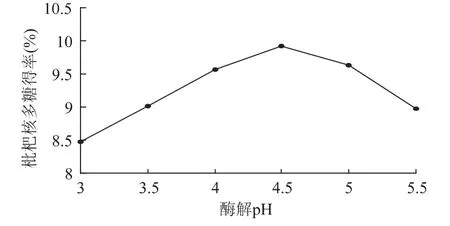
图7 酶解pH对枇杷核多糖得率的影响Fig.7 Effect of enzyme hydrolysis pH on loquat core polysaccharedes yield
如图7可知,当pH为4.5时,多糖得率最高,pH过高或过低均会影响多糖得率。因过高或过低的pH环境会导致酶蛋白的变性或失活,影响酶的活力;此外,pH还可通过影响底物分子的解离来影响反应速度。故选择酶解pH为4.5。
2.2 响应面优化实验
2.2.1 数学模型的建立与显著性检验 根据Box-Benhnken中心组合实验设计原理,在上述单因素实验基础上,选取纤维素酶用量(X1)、酶解pH(X2)、酶解温度(X3)和酶解时间(X4)为考察因素,以枇杷核多糖得率(Y)为响应值,进行Box-Benhnken中心组合设计实验,实验设计方案及结果见表2。
采用SAS 8.1软件对27个实验点的枇杷核多糖得率进行回归分析,得出二次模型回归统计分析表3。响应值与各因素进行回归拟合后,得到枇杷核多糖提取得率的回归方程为:
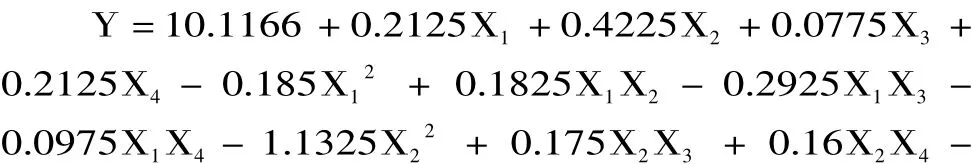
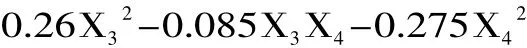
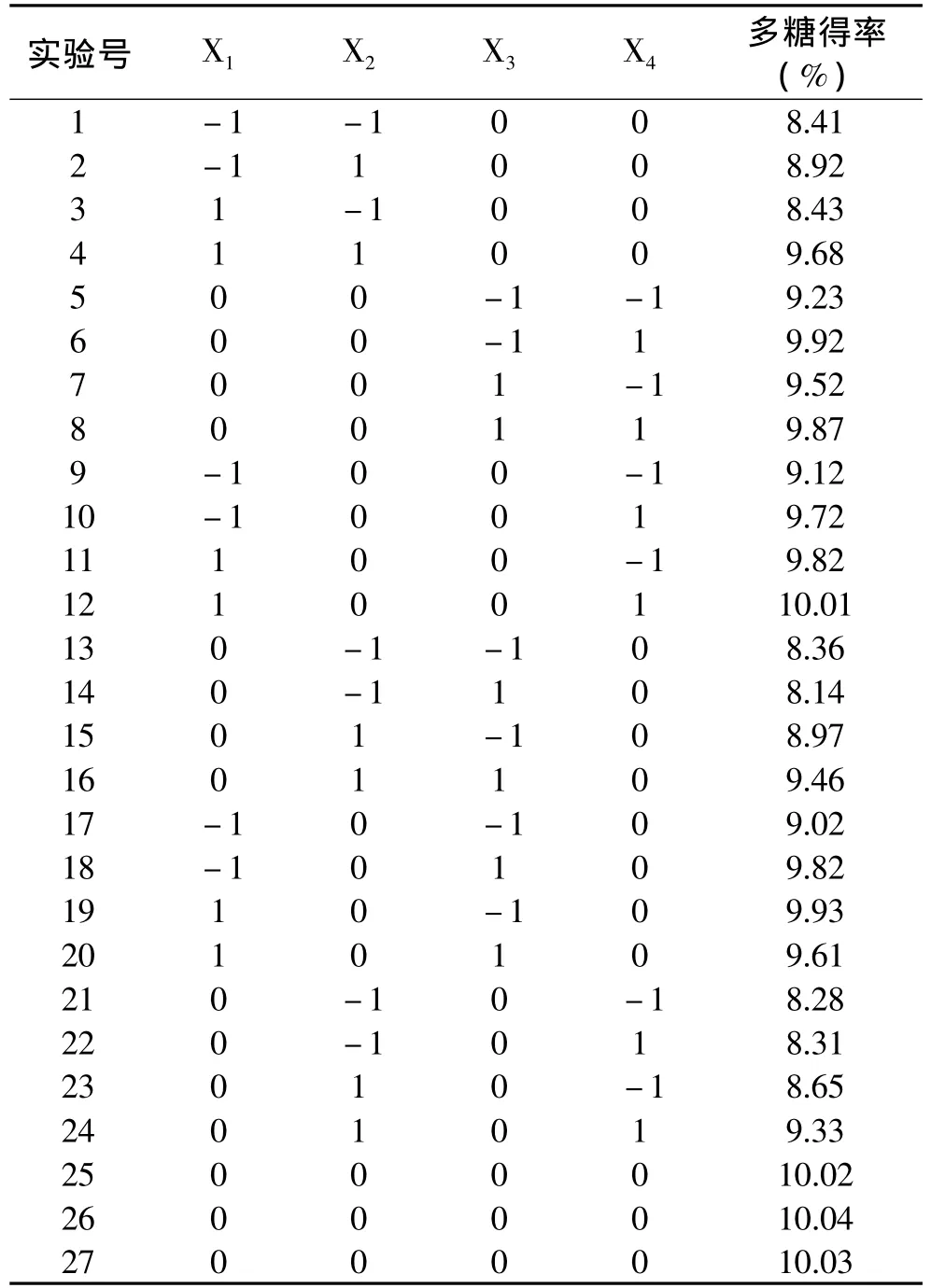
表2 Box-Behnken实验设计及结果Table 2 Box-Behnken experimental design arrangement and experimental results
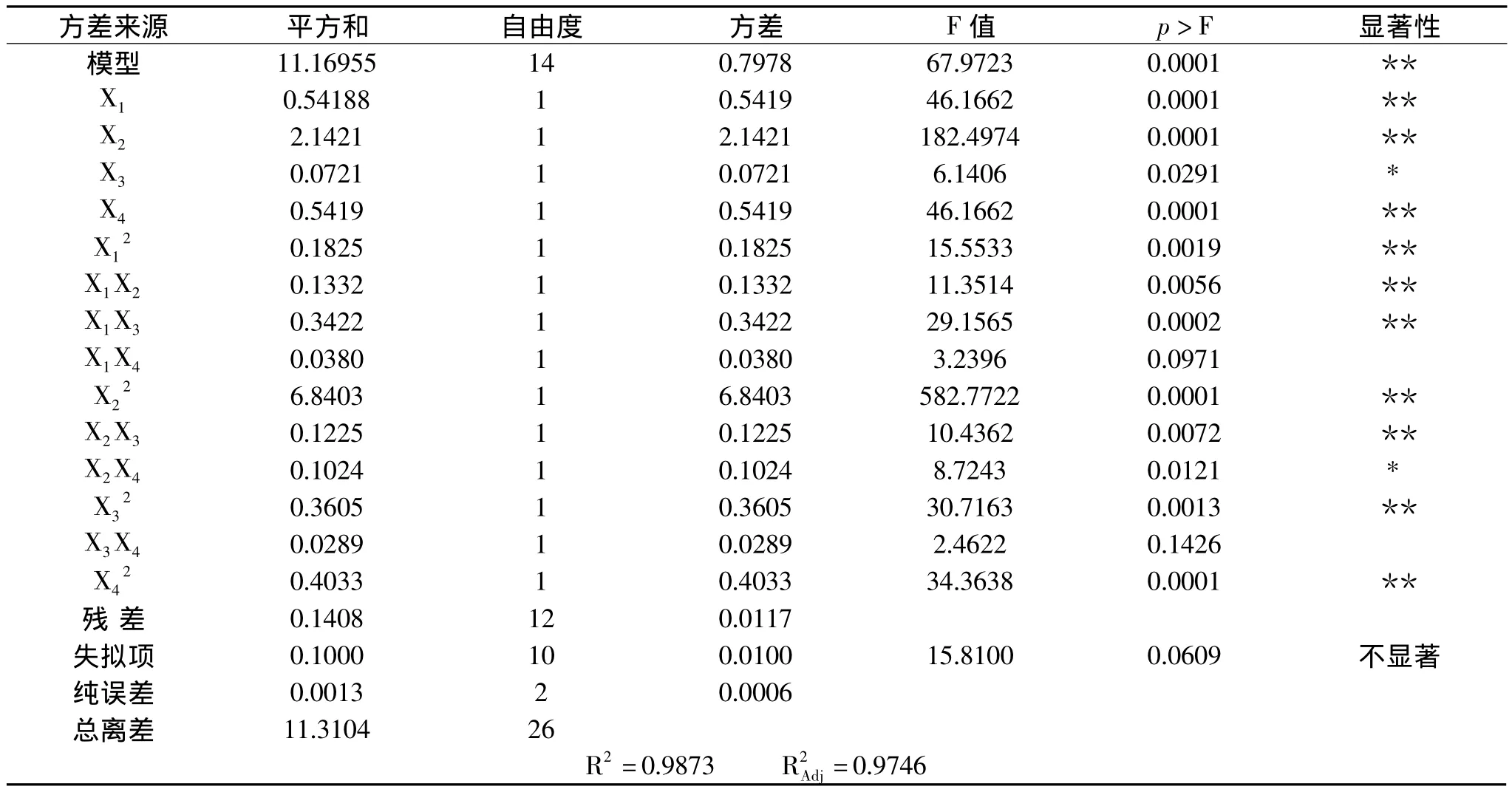
表3 回归统计分析表Table 3 ANOVA for the regression response surface model
从表3可知,模型极显著,回归决定系数R2=0.9873,修正决定系数=0.9746,回归模型 p<0.01,说明响应值的变化有98.73%来源于所选因子变化,拟合程度良好,失拟项不显著(p>0.05),回归模型极显著,模型能够较好的描述枇杷核多糖提取实验结果,说明本实验所得二次回归方程高度显著,能很好地对响应值进行预测。从方差分析表中各因素F值可以看出,各因素对枇杷核多糖得率影响顺序为:酶解pH>酶解时间=纤维素酶用量>酶解温度,且影响均达到了显著水平;二次项X12、X22、X32、对得率的影响极显著,说明二次项响应值影响极大且不是简单的一次线性关系。去除不显著项,回归方程可简化为:
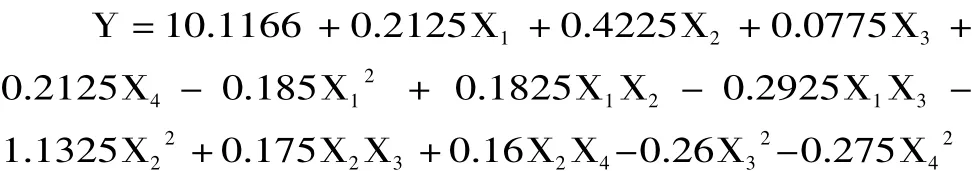
2.2.2 响应面图形分析 根据简化后回归方程,采用SAS8.1软件绘制出交互作用显著两因素的响应面图,见图9所示,可以直观地预测响应值以及确定变量相互作用的关系。由图9a~9d可知,纤维素酶用量与酶解pH、纤维素酶用量与酶解温度、酶解pH与酶解温度、酶解pH与酶解时间等两两因素交互作用对枇杷核多糖得率的效应相关性呈山丘形或马鞍形曲面,其中,酶解pH与酶解时间之间的交互作用达到了显著水平,而纤维素酶用量与酶解pH、纤维素酶用量与酶解温度、酶解pH与酶解温度之间的交互作用达到了极显著水平。
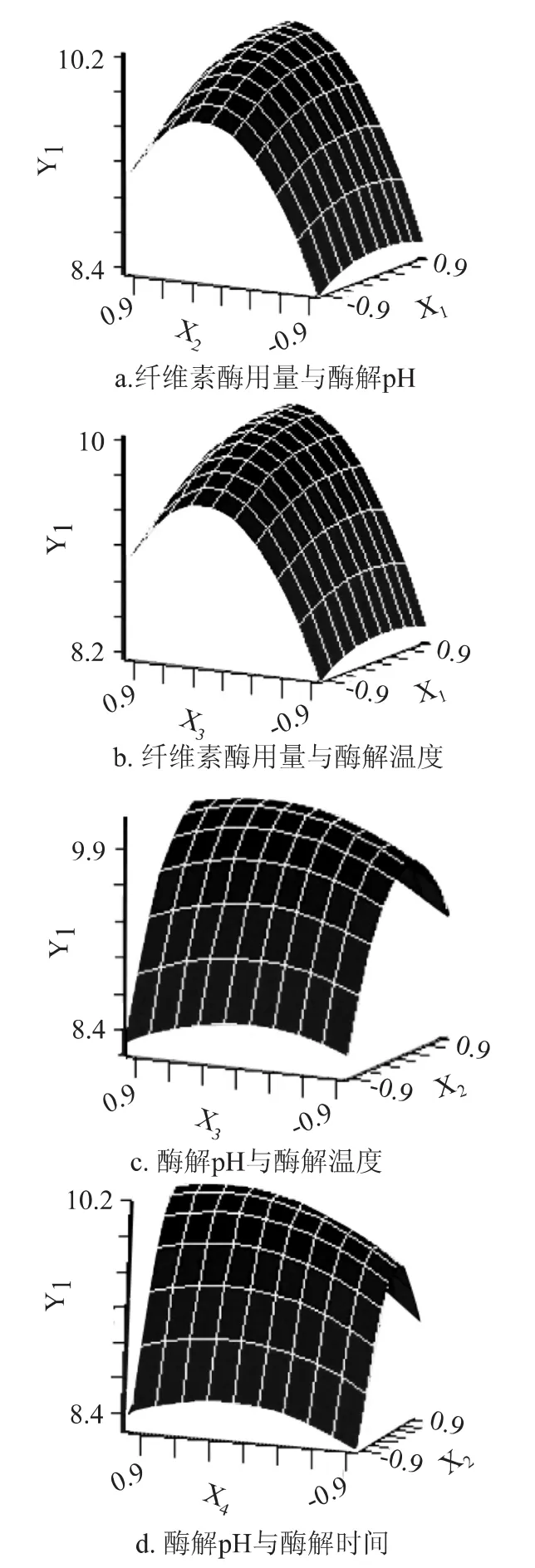
图9 各两因素交互作用对枇杷核多糖得率影响的响应面Fig.9 Response surface plot showing the effect of every two factors interaction on the yield of loquat core polysaccharides
2.2.3 最优条件的求解及验证实验 为求得各因素的最优条件,对回归方程进行数学处理。由SAS8.1分析得到的最优响应值(Y)时,纤维素酶用量(X1)、pH(X2)、酶解温度(X3)、酶解时间(X4)相对应的编码值分别为 0.64、0.29、-0.15、0.61,利用编码公式将上述编码值转变为实际参数值,得出纤维素酶用量 1.819%、酶解 pH4.654、酶解温度49.27℃、酶解时间1.815h,此时枇杷核多糖得率的模型理论预测值为10.05%。考虑实际可操作性,选定优化工艺条件参数为纤维素酶用量1.8%、酶解pH4.7、酶解温度49℃、酶解时间1.8h。
在优化后的工艺条件下进行3次验证实验,枇杷核多糖得率平均值为9.96%,与模型理论预测值误差在1%以内,说明采用响应面分析法优化得到的工艺参数准确可靠,具有较高应用价值。
3 结论
通过单因素实验对影响枇杷核多糖提取效果的料液比、超声处理温度、超声处理时间、纤维素酶用量、酶解温度、酶解pH、酶解时间进行考察,然后采用响应面分析法对主要影响因素进行中心组合设计实验并进行响应面分析,相关因素对枇杷核多糖提取得率影响的主次顺序为酶解pH>酶解时间=纤维素酶用量 >酶解温度,得到回归方程为:Y=由回归统计分析结果可知,在本实验范围内建立的二次线性回归模型准确有效,可用来预测设定条件范围内及其周围的枇杷核多糖提取工艺参数。优化工艺条件为料液比1∶15、超声处理温度60℃、超声处理时间30min、酶用量1.8%、酶解温度49℃、酶解 pH4.7、酶解时间1.8h,在此优化工艺条件下,干燥处理后枇杷核多糖得率可达9.96%,与数学模型的理论预测值基本一致。
[1]郑宝东,郑金贵,曾绍校.果蔬多糖的研究现状及应用前景[J].食品科学,2003,24(1):152-155.
[2]柴振林,陈顺伟,童晓青.枇杷仁成分组成及其综合利用可能途径[J].浙江林业科技,2003,5(3):30-32.
[3]林国荣,沈高扬.枇杷核仁的营养成分分析[J].食品科技,2007(8):276-277.
[4]辛松林,秦文,肖岚.枇杷核的功能性因子[J].中国食物与营养,2006(10):44-45.
[5]张玉,王建清.枇杷的营养及功能成分研究进展[J].食品科学,2005,26(9):602-604.
[6]赵静,段杨峰,孔繁渊,等.超声波辅助提取枇杷核苦杏仁苷工艺优化[J].食品科学,2011,32(8):37-42.
[7]宋日钦,翟大才,陈黎.枇杷核中提取苦杏仁甙的研究[J].资源开发与市场,2006,22(3):210-212.
[8]姜帆,高慧颖,陈秀妹,等.枇杷叶水溶性多糖提取工艺的研究[J].福建果树,2005,135(4):1-3.
[9]田龙,鲁云风.枇杷多糖的提取纯化及理化性质初步研究[J].中国食品添加剂,2008(1):88-90.
[10]王明艳,许瑞波,贺俊霞.超声波技术用于枇杷叶多糖的提取研究[J].中药材,2006,29(11):1230-1232.
[11]王志高,鄢贵龙,武华宜,等.超声-微波协同萃取枇杷叶多糖的工艺研究[J].食品工业科技,2008,29(8):207-209.
[12]张瑶,蒲彪,刘云,等.枇杷果浆酶解工艺的响应面法优化[J].食品科学,2003,24(1):106-110.
[13]陈燕,李世刚,刘朝霞,等.纤维素酶法提取资木瓜多糖的工艺研究[J].安徽农业科学,2010,38(21):11457-11459.
[14]杨秀英,王书林.硫酸-蒽酮比色法测定枇杷叶中可溶性多糖的含量[J].亚太传统医药,2008,4(8):26-27.
[15]安金双,王迪,马士淇,等.响应面法优化灰树花中多糖超声波提取工艺的研究[J].食品研究与开发,2008,29(6):11-15.
[16]戴喜末,熊子文,罗丽萍.响应面法优化野艾蒿多糖的超声波提取及其抗氧化性研究[J].食品科学,2011,32(8):93-97.

