韭菜提取液体外抑菌活性的均匀实验优化
韩亚伟,左婷婷,陈利平,王志勇
(1.郑州轻工业学院,河南郑州 450002;2.机械工业第六设计院,河南郑州 450007)
韭菜(Allium Tuberoum)为百合科葱属多年生草本植物,又名起阳草、壮阳草,主要以叶片、假茎供食,是我国特有的蔬菜之一[1]。其种植资源丰富,价廉易得,全国各地皆产,以河北、山西、吉林、江苏、山东、安徽和河南等地产量最大[2]。韭菜味道鲜美,富含营养,除含有蛋白质、脂肪、碳水化合物,还含有丰富的胡萝卜素、VC以及微量元素,其中Fe、Mn和Zn含量较高[3],兼具主菜及调味功能,是宴席上常见的美味[4]。韭菜不仅营养价值高,而且具有多方面的药用功能,其叶、根、籽均可入药。现代医学研究表明,韭菜含挥发性精油有特殊辛香有助于疏调肝气,促进食欲;韭菜含有丰富的纤维素,可以促进肠道蠕动、预防大肠癌的发生,同时又能减少对胆固醇的吸收,从而起到预防和治疗动脉硬化、冠心病等疾病的作用[5];韭菜可治疗跌打损伤,有消炎止痛,散瘀止血的功效[6]。此外,韭菜籽具有“温补肝肾,壮阳固精”功效[7]。由于韭菜分布范围较窄,因此国际上也少有其相关的研究报道[8]。从目前的文献资料来看,国内对韭菜的研究还刚刚起步,其深入的程度和广度远远比不上其他蔬菜。有关韭菜的报道主要是研究栽培技术及食疗方面[1]。也有学者对韭菜进行了抗植物病原菌的研究[9],但对人体致病菌的抑制作用,则很少见报道。本文通过单因素实验和均匀实验来评价和优化韭菜提取液对一些常见致病菌的体外抑制作用,为韭菜更深入的研究提供理论和实验依据。
1 材料与方法
1.1 材料与仪器
新鲜韭菜(平丰8号)平顶山农科院提供;大肠杆菌(Escherichia coli),枯草杆菌(Bacillus subtilis),金黄色葡萄球菌(Staphyloccocus aureus)。
LDZM-50(60KCS)型立式压力蒸汽灭菌器 上海申安医疗器械厂;QYC-2102C型恒温振荡培养箱上海福玛实验设备有限公司;JJ-2型组织捣碎匀浆机 江苏中大仪器厂;BR4i型多功能离心机 美国Thermo公司;SW-CJ-1F型单人双面净化工作台 苏州净化设备有限公司;HH-2数型显恒温水浴锅 国华电器有限公司;PB-10型pH计 德国Sartorius公司;DNP-9162BS-Ⅲ型电热恒温培养箱 上海新苗医疗器械制造有限公司。
1.2 实验方法
1.2.1 菌种的活化及菌悬液的制备 将供试菌从斜面上接种到营养肉汤培养基中,于37℃、200r/min条件下恒温振荡培养12h,再用无菌的生理盐水将菌液稀释至107~108cfu/mL。振荡均匀后备用。
1.2.2 韭菜提取液的制备 采用直接压榨法制备韭菜提取液。其基本流程为:新鲜韭菜200g→自来水冲洗数次→75%乙醇表面消毒→无菌水冲洗数次→加入100mL无菌水压榨→8层无菌纱布过滤→9000r/min离心10min→取上清液,4℃放置备用(相当于干物质浓度2g/mL)。
1.2.3 体外抑菌实验
1.2.3.1 浓度对体外抑菌实验的影响 二倍稀释法用无菌水将韭菜提取液稀释成5个不同的浓度梯度,即2、1、0.5、0.25、0.125g/mL。无菌移液枪吸取100μL上述菌悬液加入到营养琼脂培养基上,并用无菌涂布棒将菌液涂布均匀。待平板表面干燥后,用无菌镊子放置5个已灭菌的牛津杯。其中3个各加入100μL同一浓度的韭菜提取液,作为3个平行。另外两个分别加入100μL无菌水作为阴性对照、100μL 10mg/mL氨苄青霉素作为阳性对照。上述操作完成后,将平板于超净工作台中静置20min后,于37℃恒温培养箱中培养24h,以十字交叉法测量抑菌圈直径。
1.2.3.2 温度对体外抑菌实验的影响 将2g/mL的韭菜提取液分别置于40、60、80、90、100℃的恒温水浴锅中处理20min后备用[10]。另取部分韭菜提取液于121℃高压蒸汽灭菌20min后备用。无菌移液枪吸取100μL上述菌悬液加入到营养琼脂培养基上,并用无菌涂布棒将菌液涂布均匀。待平板表面干燥后,用无菌镊子放置4个已灭菌的牛津杯。其中3个各加入100μL同一温度处理的韭菜提取液,为3个平行。另外一个加入100μL常温下提取的未处理的韭菜原提取液作为对照。上述操作完成后,将平板于超净工作台中静置20min后,于37℃恒温培养箱中培养24h,以十字交叉法测量抑菌圈直径。
1.2.3.3 pH对体外抑菌实验的影响 用2mol/L的HCl和2mol/L NaOH分别将常温下提取的韭菜原提取液的pH调整为3、4、5、6、7、8、9、10,并于4℃条件下放置备用。无菌移液枪吸取100μL的上述菌悬液加入到营养琼脂培养基上,并用无菌涂布棒将菌液涂布均匀。待平板表面干燥后,用无菌镊子放置4个已灭菌的牛津杯。其中3个各加入100μL相同pH的韭菜提取液,作为3个平行对照。另外一个加入100μL未处理的韭菜原提取液作为对照。上述操作完成后,将平板于超净工作台中静置20min后,于37℃恒温培养箱中培养24h,以十字交叉法测量抑菌圈直径。
1.3 数据统计
数据分析采用SPSS 13.0软件进行单因素的方差分析,实验数据以平均值±标准差表示。组间差异用Duncan检验。
2 结果与分析
2.1 单因素实验结果
2.1.1 不同浓度的韭菜提取液对供试菌的抑制效果如表1所示,韭菜提取液对3种供试菌抑菌圈的大小随浓度的增加而逐渐增大。当韭菜提取液的浓度增加到2g/mL时,其对大肠杆菌、枯草杆菌和金黄色葡萄球菌的抑菌圈直径分别达到了21.2、22.5、27.7mm,且对大肠杆菌和枯草杆菌的抑制作用与10mg/mL的氨苄青霉素阳性对照相接近。这一结果表明,韭菜提取液的浓度与其抑菌活性呈正相关,即浓度越大,抑菌圈直径越大,抑菌活性就越强,且这种影响是显著的。浓度(g/mL)抑菌圈直径(mm)大肠杆菌 枯草杆菌 金黄色葡萄球菌

表1 不同浓度的韭菜提取液对供试菌的抑制效果Table 1 Effects of concentration on the tested bacteria of Chinese chives extract
2.1.2 不同温度的韭菜提取液对供试菌的抑制效果
如表2所示,100℃以下的韭菜原提取液(2g/mL)对3种供试菌均有一定的抑制作用,且在80℃时抑菌效果最好。对同种菌而言,当韭菜提取液温度在40℃和60℃时,抑菌圈大小变化不明显;而温度上升到80℃时,抑菌作用有所增强。当温度上升到80℃以上时,抑菌圈直径则随着温度的上升而逐渐减小,至121℃时,韭菜提取液对3种供试菌已无抑制作用,抑菌圈直径显示为牛津杯的外径。这种现象表明韭菜提取液中的抑菌物质具有一定的热稳定性,但当温度过高时,将会破坏抑菌物质的活性,使其抑制作用减弱甚至消失。这一结论与Hsieh等的研究结果相一致[11]。

表2 不同温度的韭菜提取液对供试菌的抑制效果(mm)Table 2 Effects of temperature on the tested bacteria of Chinese chives extract
2.1.3 不同pH的韭菜提取液对供试菌的抑制效果
如表3所示,不同pH的韭菜提取液对3种测试菌均有不同程度的抑制作用,且当pH为6时抑菌效果最好。对于同种菌,当pH低于6时,抑菌圈直径随pH的增大而先减小后增大;pH上升到6以上时,抑菌圈直径随pH的增大而逐渐减小,抑菌作用逐渐减弱;相同pH的韭菜提取液对金黄色葡萄球菌的抑制效果明显强于大肠杆菌、枯草杆菌。
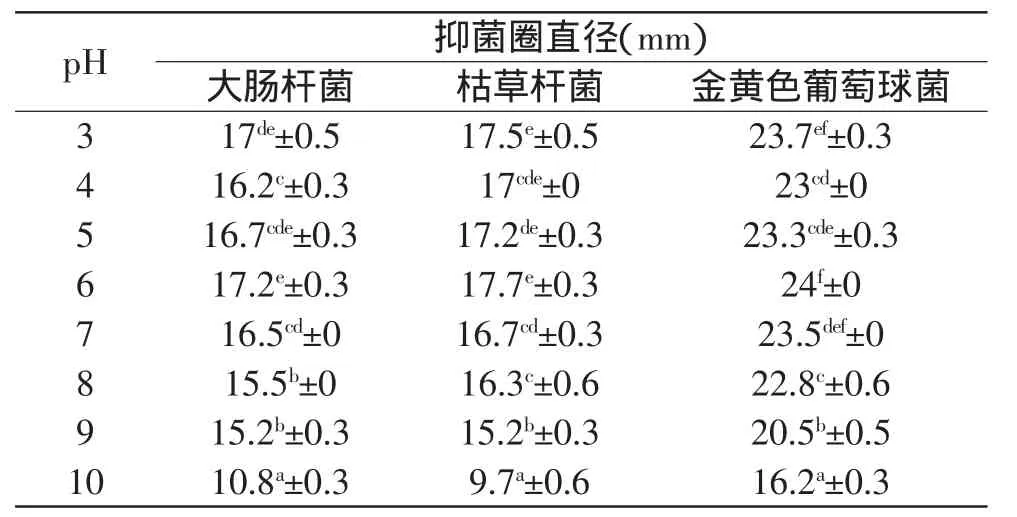
表3 不同pH的韭菜提取液对供试菌的抑制效果(mm)Table 3 Effects of pH on the tested bacteria of Chinese chives extract
2.2 均匀实验
2.2.1 均匀实验因素水平设计 综合上述单因素实验结果,以抑菌圈直径作为检测指标,采用3因素8水平8组实验的方式设计U8(83)[12]均匀实验表,考察了韭菜提取液的浓度(X1)、温度(X2)、pH(X3)对体外抑菌活性的影响。因素水平如表4所示。

表4 U8(83)均匀实验设计因素水平表Table 4 U8(83)table of uniform design
2.2.2 均匀实验结果 根据均匀实验表,分别在相应条件下进行体外抑菌实验并得到抑菌圈直径,实验结果如表5所示。
2.2.3 软件分析 以金黄色葡萄球菌为例,采用Mathematics 4.0软件对均匀实验结果进行分析,得到如下结果:

表5 均匀实验结果Table 5 Results of uniform design


表6 参数表Table 6 Parameter table
采用Mathematics 4.0软件对均匀实验结果进行分析,1代表回归方程中的常数项,复确定系数R2为0.962448,调整后为0.737138,估计方差为3.86313。方差分析表如表7所示。

表7 方差分析表Table 7 Analysis of variance table
按一元线性回归分析,得到三个因素的影响都不显著,因此考虑将影响最不显著的因素(X3,即pH)删去。然后继续进行回归分析得到如下方程:Y(抑菌直径)=-52.73+11.33X1+1.95X2-0.012+1.77X1X3-0.24X1X2-0.068。3个因素对韭菜提取液体外抑菌活性的影响主次顺序是:X2(温度)>X1(浓度)>X3(pH)。在测试条件范围内,经过计算后最佳优化条件为:浓度0.5g/mL,温度80℃,pH为4时,韭菜提取液对金黄色葡萄球菌的抑菌作用最强,抑菌圈直径达到了25.0mm。经实验验证在此优化条件下得到的韭菜提取液对金黄色葡萄球菌的抑菌圈为22.4mm,与理论值的相对误差2.6mm,且远超过各实验值。说明均匀实验优化后的最优条件组合制备的韭菜提取液具有最强的抑菌活性,优化结果可靠。
3 结论
本实验采用牛津杯法对韭菜提取液的体外抑菌效果进行了初步探索,研究发现当浓度在0.25g/mL以上时,韭菜提取液对常见革兰氏阳性菌枯草杆菌、金黄色葡萄球菌以及革兰氏阴性菌大肠杆菌均有明显的抑制效果。不同条件处理得到的韭菜提取液具有不同的抑菌活性。单因素实验表明,韭菜提取液的浓度与抑菌活性呈正相关;80℃时的韭菜提取液对供试菌的抑制效果最好,而121℃处理后的韭菜提取液,由于高温失去了抑菌活性;酸性条件对韭菜提取液的影响不大,但在碱性范围内,抑菌活性则随着pH的增大而逐渐减弱,这可能是碱性环境破坏了韭菜提取液中抑菌成分的活性;同样条件下的韭菜提取液对金黄色葡萄球菌的抑制效果明显好于大肠杆菌、枯草杆菌,对其他两种菌的抑制作用则相差不大。均匀实验表明,以金黄色葡萄球菌为例进行回归分析,得到最佳优化条件为:浓度0.5g/mL,温度80℃,pH为4。此条件下处理的韭菜提取液,体外抑菌活性得到了明显增强。
以10mg/mL的氨苄青霉素作为阳性对照,发现2g/mL的韭菜提取液对大肠杆菌、枯草杆菌、金黄色葡萄球菌的抑菌圈直径分别为氨苄青霉素的78.52%、80.36%、65.95%。由此可见,韭菜提取液的抑菌效果已经很明显。而作为阴性对照的无菌水对供试菌则无抑制作用。近年来,由于抗生素的乱用与滥用,造成许多细菌产生了耐药菌株,并且其出现的频率已远远超过抗生素的研发速度,这给疾病的治疗带来了很大的难度[13]。研究发现,韭菜提取液中存在丰富的天然活性物质,且具有明显的抑菌效果。与抗生素相比,它具有绿色、安全、不存在令细菌产生抗药性的优势。但由于韭菜提取液的抑菌活性成分尚不清楚,因此有关活性物质的分离纯化、结构鉴定、抑菌机制有待进一步深入系统地研究,以期为开发韭菜资源在医药、食品、保健方面的应用提供科学依据。
[1]李雪雁,陈海强.韭菜中提取类胡萝卜素[J].食品研究与开发展,2009(10):86.
[2]刘建涛,赵利.韭菜中生物活性成分及其分子生物学的研究进展[J].食品科技,2006(8):69.
[3]张玲,时延增,徐新刚.韭菜籽中氧基酸及微量元素分析[J].时珍国药研究,1999,7(1):21.
[4]王永成,时军.韭菜籽提取物的温肾助阳作用[J].中国中药杂志,2005,30(13):1017-1018.
[5]吴莉,张平.气-质联用法检测韭菜中香味成分的研究[J].广东化工,2005(7):67-68.
[6]娄卫东,段大航,孙丕东.韭菜提取物及药用研究现状[J].中国民康医学,2007,80(19):671.
[7]中华人民共和国药典[M].北京:化学工业出版社,2000.
[8]高新蕾,吴莉.韭菜中辛香味成分的分析、合成及微胶囊化[J].中国调味品,2004(6):18-20.
[9]蒋继志,史娟,赵丽坤,等.植物提取物对棉铃虫生长发育的影响[J].西北农业大学学报,2001,24(6):99-102.
[10]Hsieh P C,Mau J L,Huang S H.Antimicrobial effect of various combinations of plant extracts[J].Food Microbiology,2001(18):35-43.
[11]Chen C P,Hsieh P C.Development and characterization of the natural antimicrobials[J].Agricultural and Food Chemistry,1998,49(1):183-188.
[12]潘丽军,章银良.实验设计与数据处理[M].南京:东南大学出版社,2008.
[13]扈瑞平,敖长金,杜玲,等.沙葱多糖的体外抑菌实验研究[J].内蒙古大学学报,2011,42(3):299.

