体外连续培养条件下稀释率对培养液中氮素分配的影响
王梦芝 王 曙 王 龙 王洪荣
(扬州大学动物科学与技术学院,扬州225009)
瘤胃微生物蛋白质是反刍动物重要的代谢蛋白质源,占反刍动物小肠食糜氨基酸的30%~100%[1],并可提供足以维持正常生长和生产(如一定产奶量)的蛋白质,而且十二指肠食糜的氨基酸组成往往与瘤胃微生物蛋白质的氨基酸组成近似[2]。因此,研究瘤胃微生物蛋白质的合成规律对反刍动物生产有着重要的意义。瘤胃微生物蛋白质的产量受多种因素的调控[3],研究较多的有饲粮结构、物理有效纤维水平、阴阳离子平衡等因素。理论上,微生物细胞分裂的速度远大于瘤胃液的外流速度(稀释率),但由于大部分微生物(包括细菌、原虫和真菌等)是附着在饲料颗粒上的,因此,稀释率是影响微生物生长和微生物蛋白质产量的重要因素之一。研究表明,在人工瘤胃中当微生物数量达到稳定状态时,稀释率可以用来代表微生物的生长速度[4]。但关于稀释率这一对微生物蛋白质合成有重要影响的因素的研究迄今尚不多见。这主要是由于对活体瘤胃稀释率的研究尚存在一定的困难,同时用于体外瘤胃稀释率研究的双外流人工瘤胃装置多为专利性设备且造价较高,以致目前一般的实验室尚缺乏适宜实验室研究用的体外仿真瘤胃微生物连续培养设备。因此,迄今多数有关体外培养条件下瘤胃稀释率的报道还是以静态培养(没有培养液的连续注入和培养物的外排)为试验条件[5-7]。现有可查的少量文献是关于稀释率影响瘤胃微生物蛋白质合成的[8-9],而对于稀释率调控原虫蛋白质、细菌蛋白质等微生物蛋白质的合成规律,如不同稀释率下以微生物蛋白质或其他形式存在的氮素的分配情况、微生物类群结构和生长速率、原虫吞噬细菌的速率等,尚不得而知。为此,本试验拟在体外连续培养条件下研究稀释率对微生物蛋白质和其他形式氮素的流量以及其在总氮素流量中比例分配的影响,以为进一步研究稀释率影响瘤胃微生物蛋白质合成规律提供一些基础资料。
1 材料与方法
1.1 试验动物与发酵装置
选用5只健康、平均体重为(25.6±0.5)kg装有瘤胃瘘管的成年徐淮白山羊羯羊,统一驱虫,单圈饲养,按体重的2%干物质量给料,每日08:00和20:00分2次等量饲喂,自由饮水,用于提供瘤胃液以配制培养液。所用人工模拟瘤胃连续发酵装置由本实验室2011年完全自主研制完成。该发酵系统包括培养液罐以及发酵罐、溢流罐和集气罐各6个,可进行连续1周稳定的连续培养试验,适用于瘤胃微生物体外连续培养,底物消化率以及产气测定等试验研究,该设备同时配有自动采集发酵罐样品的采集管等,操作方便简捷。
1.2 试验设计
以玉米、豆粕为精料,羊草为粗料,1mm粉碎,按精粗比40∶60(玉米∶豆粕∶羊草=33∶7∶60)配制作为体外培养底物。表1为体外培养所用原料和培养底物的营养水平。采用单因子3水平试验设计,因子为稀释率,水平分别为4%/h、6%/h、8%/h,每个水平设3个重复。
1.3 体外培养
1.3.1 人工唾液盐配制
常用缓冲液配方改进自McDougall缓冲液,具体组成见表2。人工唾液盐以8L为1个配制单位,具体组成如下:双蒸水6 974mL、缓冲液A(5×)960mL、矿物盐溶液B(100×)48mL、尿素溶液C 16mL,充CO2备用。使用前加入结晶半胱氨酸盐酸盐2g。
1.3.2 瘤胃液采集
晨饲前,利用自制真空负压装置,通过瘤胃瘘管从5只山羊的瘤胃背囊、背盲囊、腹囊、腹盲囊4个位点采集瘤胃液各300mL,经混合灌入经预热达39℃并事先通有CO2的保温瓶中。迅速返回实验室,经4层纱布过滤后,滤液通CO2并预热至39℃备用。
1.3.3 体外培养试验
每个培养罐中培养液均按人工唾液盐与瘤胃液体积比为2∶1配制,每12h投放培养底物1次,投放量为20g/次,稀释率按试验设计设定,持续通CO2,39℃连续培养。
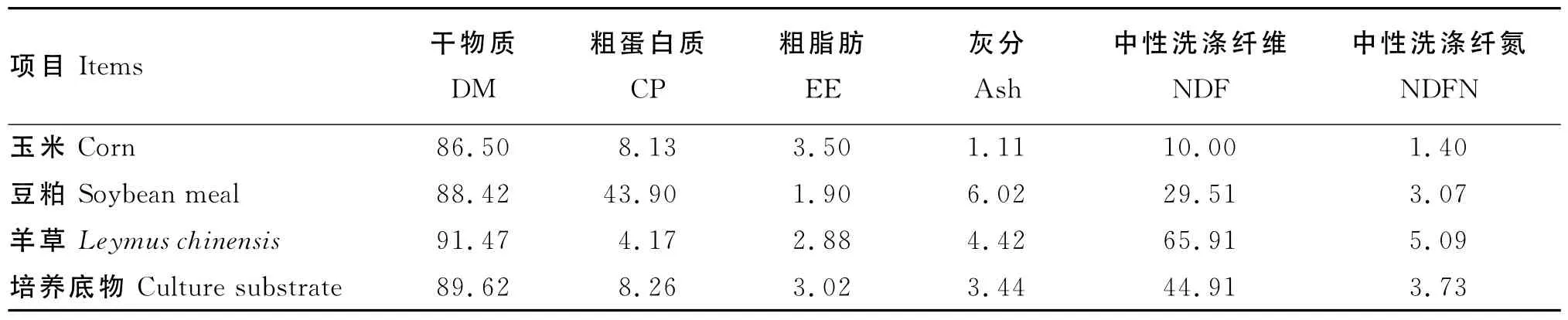
表1 原料和培养底物的营养水平 (干物质基础)Table 1 Nutrient levels of ingredients and culture substrate(DM basis) %

表2 体外培养用人工唾液盐的组成Table 2 Composition of artificial saliva salt in vitro
1.4 样品采集
培养开始后,分别在0、2、4、6、8、10、12、14、16、18、20、22、24h采集培养罐中培养液样品,立即于-20℃冻存,用于培养液中各种形态氮素的测定。
1.5 指标测定
1.5.1 常规营养成分的测定
培养底物及其原料的干物质、粗蛋白质、粗脂肪、灰分和中性洗涤纤维(NDF)含量参照张丽英[10]的方法测定,中性洗涤纤氮(NDFN)含量参照Licitra等[11]推荐的方法测定。
1.5.2 原虫蛋白质和细菌蛋白质含量的测定
参考Wang等[12]的方法分离培养液样品中的原虫和细菌,主要步骤如下:取培养液样品,加等体积生理盐水,39℃、125r/min孵育60min,经80目尼龙布过滤,滤液150×g离心15min,收集沉淀为原虫;收集上述上清液,22 000×g离心20min,收集沉淀为细菌。采用三氯醋酸(TCA)沉淀蛋白质法测定原虫蛋白质和细菌蛋白质含量。主要步骤如下:取分离的原虫或细菌样品适量,加入10%TCA,混匀后置室温30min,6 000×g离心10min,弃上清液再加入5%氢氧化钠溶液混匀溶解后,6 000×g离心10min,取上清液用756型紫外分光光度计测定260和280nm下的吸光度值(OD260nm和OD280nm)。
原虫蛋白质或细菌蛋白质含量(mg/mL)=(1.45×OD280nm-0.74×OD260nm)×稀释倍数。
1.5.3 可溶性蛋白质含量的测定
取培养液样品于SK-1快速混匀器(厦门新科)振荡静置后经4℃、20 000×g离心20min后,取上清液加入终浓度为0.15mol/L的高氯酸,静置20min,再4℃、20 000×g离心20min;收集沉淀,加入2mol/L氢氧化钠溶液水解,用考马斯亮蓝法测其可溶性蛋白质含量。所用试剂盒购自南京建成生物工程研究所。
1.5.4 游离氨基酸氮含量的测定
取培养液样品于4℃、20 000×g离心20min后,取上清液加入25%高氯酸,振荡静置后再次4℃、20 000×g离心20min;再取上清液加入2mol/L碳酸钾溶液,振荡静置后再4℃、20 000×g离心20min;收集上清液用甲醛值法(GB/T 5009.39—2003)[13]测定游离氨基酸氮的含量。
1.5.5 肽含量的测定
采用双缩脲法[14]测定培养液样品中肽含量,主要步骤如下:取培养液样品,加入10%TCA,混匀后静置15min,4 000×g离心15min;取上清液加双缩脲试剂充分混匀,室温静置30min,545nm下测定吸光度值。同时用牛血清白蛋白标准液重复上述步骤,做出标准曲线,进行样品含量的换算。
1.5.6 氨氮含量的测定
参考冯宗慈等[15]的方法测定培养液样品中氨氮含量,主要步骤如下:取培养液样品,4 000×g离心10min,取上清液依次加入苯酚试剂和次氯酸钠试剂,混合均匀后60℃水浴10min,冷水冷却后,546nm下测定吸光度值。同时用氯化铵标准液重复上述步骤,做出标准曲线,进行样品含量的换算。
1.6 数据处理
采用Excel 2003整理数据,以SPSS 13.0统计软件的ANOVA模块进行方差分析,并采用Duncan氏法分别在0.05和0.01水平进行差异显著性比较,结果以平均值±标准误表示。
2 结 果
2.1 稀释率对原虫蛋白质和细菌蛋白质含量动态变化的影响
4%/h、6%/h、8%/h稀释率下记录的培养液中原虫蛋白质含量的变动范围分别为0.67~1.22mg/mL、0.56~1.20mg/mL、0.21~1.12mg/mL。从其24h内的动态变化(图1)看,各稀释率下原虫蛋白质含量均大致呈先上升后下降,再上升继而再下降的趋势;投料后6h时到达第1个高峰,而后下降;再次投料后6h即培养18h时达到第2个高峰,之后再下降。
4%/h、6%/h、8%/h稀释率下记录的培养液中细菌蛋白质含量的变动范围分别为0.68~0.88mg/mL、0.56~0.83mg/mL、0.34~0.78mg/mL。图2表明,各稀释率下细菌蛋白质含量变化均较为复杂,随培养时间的延续大致呈先上升后下降,再上升和下降,再次投料后又先上升后下降,继而又上升和下降的波动变化,培养6、10、18、22h时为峰值点。
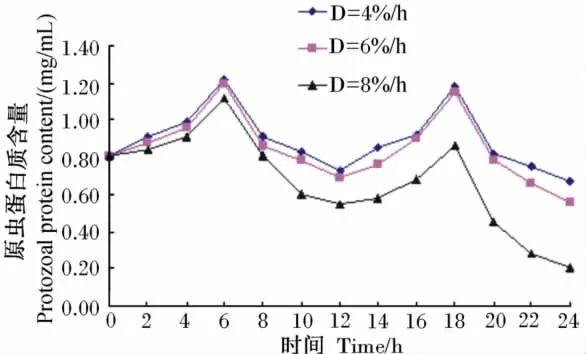
图1 培养液中原虫蛋白质含量的动态变化Fig.1 Dynamic changes of protozoal protein content in culture solution
2.2 稀释率对可溶性蛋白质和游离氨基酸氮含量动态变化的影响
4%/h、6%/h、8%/h稀释率下记录的培养液中可溶性蛋白质含量的变动范围分别为0.41~0.78mg/mL、0.40~0.77mg/mL、0.39~0.78mg/mL。从其24h内的动态变化(图3)看,各稀释率下变化趋势大致相同,均呈现出先下降后上升,再下降和上升的趋势。其中,在投料后4h时出现第1个谷值,再次投料后4h即培养16h时出现第2个谷值。
4%/h、6%/h、8%/h稀释率下记录的培养液中游离氨基酸氮含量的变动范围分别为25.85~44.38μg/mL、25.08~38.24μg/mL、24.42~31.97μg/mL。其24h内的动态变化见图4,随培养时间的延续,各稀释率下均呈现先上升、下降再上升、下降,最后又上升的趋势。其中,投料后到2h的时间内上升,之后下降至4h,然后缓慢上升至12h;再次投料后变化趋势一致,但游离氨基酸氮含量的整体波动水平略有所提高。

图2 培养液中细菌蛋白质含量的动态变化Fig.2 Dynamics changes of bacterial protein content in culture solution
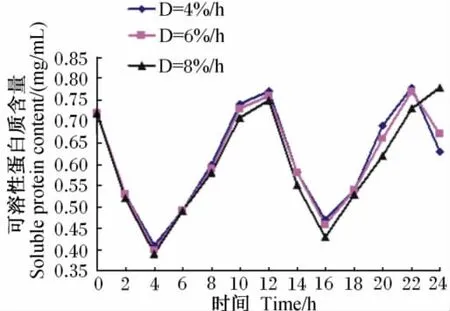
图3 培养液中可溶性蛋白质含量的动态变化Fig.3 Dynamic changes of soluble protein content in culture solution
2.3 稀释率对肽和氨氮含量动态变化的影响
4%/h、6%/h、8%/h稀释率下记录的培养液中肽含量的变动范围分别为10.88~21.97mg/dL、10.78~18.55mg/dL、9.58~15.19mg/dL。从图5可知,各稀释率下肽含量动态变化趋势大致相同,均呈现出先升高后降低,而后又略有上升的趋势。其中,投料后2h内,各组肽含量均有大幅度上升,4%/h组和6%/h组先缓慢上升至6h再下降,而8%/h组持续下降,投料后10h为各组肽含量的最低点。
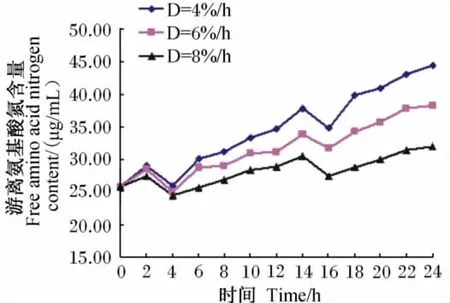
图4 培养液中游离氨基酸氮含量的动态变化Fig.4 Dynamic changes of free amino acid nitrogen content in culture solution
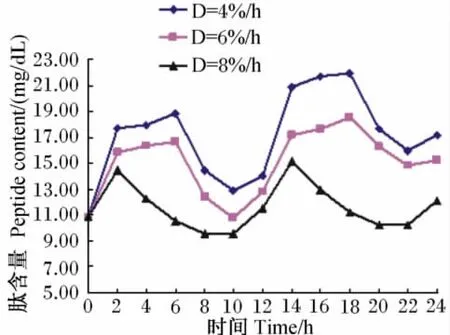
图5 培养液中肽含量的动态变化Fig.5 Dynamic changes of peptide content in culture solution
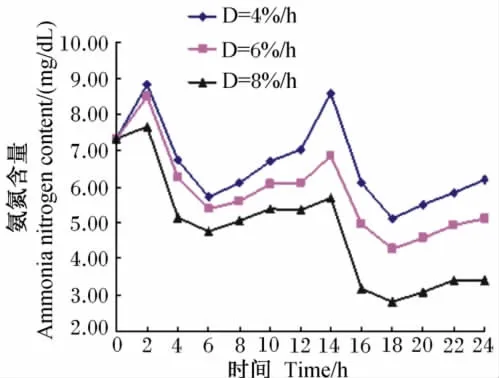
图6 培养液中氨氮含量的动态变化Fig.6 Dynamic changes of ammonia nitrogen content in culture solution
4%/h、6%/h、8%/h稀释率下记录的培养液中氨氮含量的变动范围分别为5.11~8.83mg/dL、4.28 ~ 8.50mg/dL、2.80 ~7.67mg/dL。由图6可知,随培养时间的延续,各稀释率下氨氮含量均大致呈现先升高后下降,再升高和下降,后又有所升高的变化趋势。其中,2、14h时为峰值点,而6和18h为谷值点。
2.4 稀释率对培养液中氮素分配的影响
如表3所示,培养液中原虫蛋白质和细菌蛋白质含量均随稀释率的升高呈现下降趋势。其中,原虫蛋白质含量4%/h组与8%/h组差异极显著(P<0.01),6%/h组与8%/h组差异显著(P<0.05),但4%/h组与6%/h组差异不显著(P>0.05);细菌蛋白质含量4%/h组与8%/h组差异极显著(P<0.01),4%/h组与6%/h组差异显著(P<0.05),6%/h组与8%/h组差异显著(P<0.05)。培养液中可溶性蛋白质含量随稀释率的升高而下降,但各组间差异不显著(P>0.05)。培养液中游离氨基酸氮含量也随稀释率的升高而下降,仅4%/h组与8%/h组之间存在极显著差异(P<0.01)。随着稀释率的升高,培养液中肽和氨氮含量也呈下降趋势。其中,肽含量4%/h组与8%/h组差异极显著(P<0.01),4%/h组与6%/h组差异显著(P<0.05),6%/h组与8%/h组差异极显著(P<0.01);氨氮含量4%/h与8%/h组差异极显著(P<0.01),6%/h组与8%/h组差异显著(P<0.05),但4%/h组与6%/h组差异不显著(P>0.05)。
将所测各类别氮素指标转化为氮量,按其稀释率以24h计各类别氮素的流量及其在总氮素流量中所占比例,结果如图7所示。随着稀释率的升高,各类别氮素流量都有所提高,但其在总氮素流量中所占比例有所不同。原虫蛋白质中氮素流量 在 4%/h、6%/h、8%/h 稀 释 率 下 分 别 为256.32、367.20、385.92mg/d,其在总氮素流量中所占比例范围为29%~31%,以6%/h组的比例最高,为31%。细菌蛋白质中氮素流量在4%/h、6%/h、8%/h稀释率下分别为218.88、289.44、328.32mg/d,其在总氮素流量中所占比例范围为24%~26%,随稀释率的升高而下降,以4%/h组的比例最高,为26%。微生物蛋白质(原虫蛋白质和细菌蛋白质之和)中氮素流量和其在总氮素流量中所占比例在4%/h、6%/h、8%/h稀释率下分别为475.20mg/d和56%、656.64mg/d和56%、714.24mg/d和53%,以6%/h组流量相对较高,且比例没有下降。可溶性蛋白质中氮素流量在4%/h、6%/h、8%/h稀 释 率 下 分 别 为 178.56、263.52、345.60mg/d,其在总氮素流量中所占比例范围为21%~26%,随稀释率的升高而升高,以8%/h组的比例最高,为26%。此外,不同稀释率下,游离氨基酸氮、肽、氨氮中氮素流量在总氮素流量中所占比例范围分别为6%、5%~6%、10%~11%,总体上变化不大。
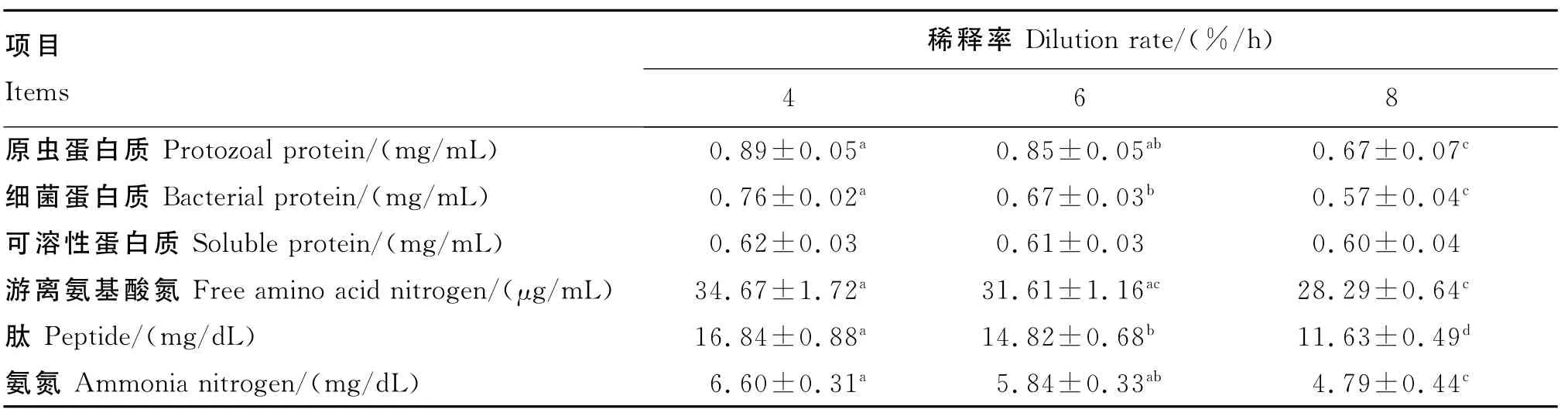
表3 体外连续培养条件下稀释率对培养液中各种氮素含量(24h均值计)的影响Table 3 Effects of dilution rate on various nitrogen contents(expressed as mean value of 24h)in culture solution under the condition of continuous culture in vitro
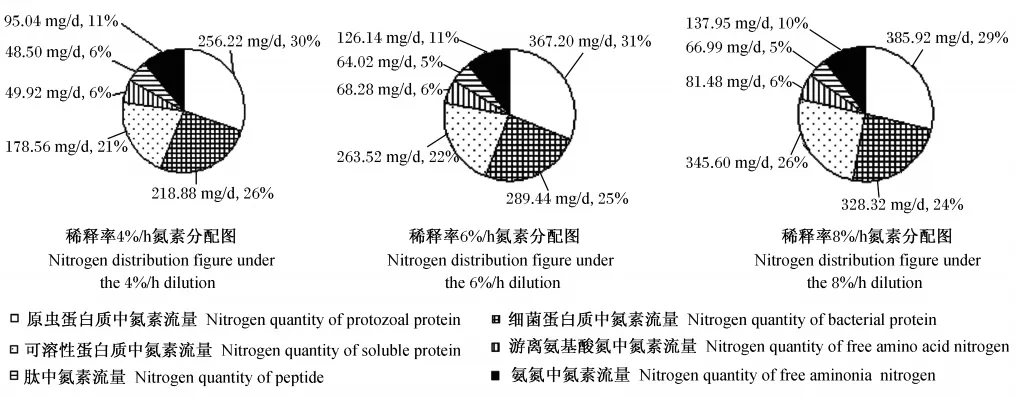
图7 体外连续培养条件下稀释率对培养液中氮素分配的影响Fig.7 Effects of dilution rate on nitrogen distribution in culture solution by in vitro continuous culture
3 讨 论
本试验结果表明,随培养时间的延续,不同稀释率下培养液中的原虫蛋白质、细菌蛋白质、可溶性蛋白质、肽、游离氨基酸氮、氨氮的含量皆呈波动变化;再次投料后其变化趋势基本一致。这可能是由于投料后微生物对培养液中含氮物质的降解、微生物增殖对可利用形式氮素的利用[16-18]、微生物生长的平台期抑制、微生物间的互作等效应[19-20]以 及 微 生 物 本 身 的 自 溶[21]等 原 因 导 致 了所检测的各种形式的氮素含量发生了波动变化。
在本试验所设定的稀释率范围内,原虫蛋白质、细菌蛋白质、可溶性蛋白质、肽、游离氨基酸氮、氨氮的含量随稀释率的升高都有所下降。但是,按其稀释率以24h计各类别氮素流量的结果表明,各类别氮素流量随稀释率的升高又都有所提高,以稀释率为8%/h时的流量最高。这提示,一定范围内增加稀释率提高了微生物蛋白质中氮素的流量(4%/h、6%/h、8%/h稀释率下原虫蛋白质和细菌蛋白质之和的氮素流量分别为475.20、656.64、714.24mg/d)。对于原虫,可能是由于稀释率增加提高了内容物的外排速率[22-24],原虫的外流量也随之增加,进而减少了原虫的滞留和自溶,而在总体上增加了原虫蛋白质中氮素的流量。细菌蛋白质中氮素流量增加的结果与Isaacson等[25]和 Maeng等[26]的研究结果一致。其原因可能是由于稀释率提高降低了培养液中原虫的含量,进而降低了原虫吞噬细菌的能力[27-29],使得培养液中细菌蛋白质流量增加;或者也可能是因为稀释率增加提高了内容物的外排速率,促进了培养液中细菌增殖活性和细菌蛋白质合成效率[26]所致。但该结果与Martínez等[30]得到的随稀释率的增加液相菌增加而固相菌减少不尽一致,其原因可能是由于研究的对象(细菌vs.液相菌和固相菌)、设 置 的 稀 释 率 (4%/h、6%/h、8%/h vs.3.78%/h、5.42%/h)等都有所不同所致。由此也说明,稀释率对微生物蛋白质中氮素影响规律与机制的阐明还需要进一步开展深入的试验研究。
在本试验设置的稀释率范围内,随稀释率的升高,24h内微生物蛋白质中氮素流量增加。但微生物蛋白质中氮素的比例分配是否也有同样的趋势呢?本研究还同时对不同稀释率下各类别氮素流量在总氮素流量中的比例变化情况进行了研究。结果表明,原虫蛋白质中氮素流量在总氮素流量中所占比例在4%/h、6%/h、8%/h稀释率下分别为30%、31%、29%,以稀释率为6%/h时的比例最高;而细菌蛋白质中氮素流量在总氮素流量中所占比例则随稀释率的升高持续下降,在4%/h、6%/h、8%/h稀释率下分别为26%、25%、24%,以稀释率为8%/h时的比例最低;而微生物蛋白质(原虫蛋白质和细菌蛋白质之和)中氮素流量在总氮素流量中所占比例在4%/h、6%/h、8%/h稀释率下分别为56%、56%、53%,以稀释率8%/h时比例较低。以上结果提示,在本试验底物精粗比40∶60的条件下,稀释率对微生物蛋白质中氮素流量在总氮素流量中的比例有调控效应,以稀释率为6%/h时的原虫蛋白质中氮素在总氮素流量中所占比例最高(31%vs.30%、29%),此稀释率下细菌蛋白质中氮素在总氮素流量中所占比例的下降不大(25%vs.26%、24%),微生物蛋白质(原虫蛋白质和细菌蛋白质之和)中氮素在总氮素流量中所占比例尚未下降(56%vs.56%、53%),而且此时氮素流量(4%/h:475.20mg/d;6%/h:656.64mg/d;8%/h:714.24mg/d)也 较高。此外,可溶性蛋白质中氮素流量在总氮素流量中所占比例随稀释率的升高持续增加,在4%/h、6%/h、8%/h稀释率下分别为21%、22%、26%,推测可能是由于稀释率的升高降低了培养液中微生物蛋白质的含量,进而降低了微生物对培养液中可溶性蛋白质的代谢利用率所致。其中,稀释率为6%/h时的影响尚不明显(22%vs.21%),而稀释率为8%/h时的影响已经较为明显(26%vs.21%)。综上,在底物精粗比40∶60条件下,在一定范围内改变稀释率可调控培养液中氮素的流量和其比例分配,并以稀释率为6%/h时的微生物蛋白质中氮素流量和其在总氮素流量中所占比例较高。
4 结 论
稀释率影响体外连续培养条件下培养液中氮素的流量和比例分配,并以稀释率为6%/h时的微生物蛋白质中氮素流量和其在总氮素流量中所占比例(流量656.64mg/d、占总氮素流量比例56%)较高。
[1] CLARK J H,KLUSMEYER T H,CAMERON M R.Symposium:nitrogen metabolism and amino acid nutrition in dairy cattle[J].Journal of Dairy Science,1992,75:2304-2323.
[2] STERN M D,VARGA G A,CLARK J H,et al.Evaluation of chemical and physical properties of feeds that affect protein metabolism in the rumen[J].Journal of Dairy Science,1994,77:2762-2786.
[3] PATHAK A K.Various factors affecting microbial protein synthesis in the rumen[J].Veterinary World,2008,1:186-189.
[4] HARRISON D G,BEEVER D E,THOMSON D J,et al.Manipulation of fermentation in the rumen[J].Journal of the Science of Food and Agriculture,1976,27:617-620.
[5] SUHARTI S,ASTUTI D A,WINA E,et al.Rumen microbial population in the in vitro fermentation of different ratios of forage and concentrate in the presence of whole lerak(Sapindus rarak)fruit extract[J].Asian-Australia Journal of Animal Science,2011,24:1086-1091.
[6] BARAKA T A M,ABDL-RAHMAN M A.In vitro evaluation of sheep rumen fermentation pattern after adding different levels of eugenol-fumaric acid combinations[J].Veterinary World,2012,5:110-117.
[7] WAMBUI C C,ANDO S,ABDULRAZAK S A,et al.In vitro assessment of ruminal fermentation characteristics of tropical browse mixtures supplemented with yeast[J].Grassland Science,2012,58:53-57.
[8] 孟庆翔,KERLEY M S.瘤胃稀释率对蛋白质发酵和微生物生长效率的影响[J].中国农业科学,1998,31:72-78.
[9] 孟庆翔,高仲元,KERLEY M S,等.稀释率对于活体外瘤胃发酵和微生物生长效率的影响[J].动物营养学报,1999,11:10-16.
[10] 张丽英.饲料分析及饲料质量检测技术[M].2版.北京:中国农业大学出版社,2003.
[11] LICITRA G,HERNANDEZ T M,VAN SOEST P J.Standardization of procedures for nitrogen fractionation of ruminant feeds[J].Animal Feed Science and Technology,1996,57:347-358.
[12] WANG M Z,WANG H R,LI G X,et al.Effects of rations in different starch to filter paper ratio on rumen fermentation and microbes in vitro[J].Acta Nutrimenta Sinica,2007,6:654-662.
[13] 中华人民共和国卫生部.GB/T 5009.39—2003酱油卫生标准的分析方法[S].北京:中国标准出版社,2003.
[14] 毕葳,邢延一,李燕燕,等.应用双缩脲反应测定鳖甲中总肽含量的方法学研究[J].中国实验方剂学杂志,2011,17(15):63-65.
[15] 冯宗慈,高民.通过比色测定瘤胃液氨氮含量方法的改进[J].畜牧与饲料科学:畜牧特刊,2010,31(6/7):37.
[16] REDDY N M,REDDY G V N,REDDY M R.Effect of fodder based complete diets on the rumen fermentation pattern in crossbred bulls[J].Indian Journal of Animal Science,1993,10:7-12.
[17] BRODERICK G A,REYNAL S M.Effect of source of rumen-degraded protein on production and ruminal metabolism in lactating dairy cows[J].Journal of Dairy Science,2009,92:2822-2834.
[18] BRODERICK G A,HUHTANEN P,AHVENJARVI S,et al.Quantifying ruminal nitrogen metabolism using the omasal sampling technique in cattle—a meta-analysis[J].Journal of Dairy Science,2010,93:3216-3230.
[19] KOENIG K M,NEWBOLD C J,MCINTOSH F M,et al.Effects of protozoa on bacterial nitrogen recycling in the rumen[J].Journal of Animal Science,2000,78:2431-2445.
[20] NHAN N T H,NGU N T,THIET N,et al.Determination of the optimum level of a soybean oil drench with respect to the rumen ecosystem,feed intake and digestibility in cattle[J/OL].Livestock Research for Rural Development,2007,19(8):[2007-08-06].http://www. cipav. org. co/lrrd/lrrd19/8/nhan19117.htm.
[21] JOUNAY J P,USHIDA K.The role of protozoa in feed digestion review[J].Asia-Australia Journal of Animal Science,1999,12:113-128.
[22] ABE M,KUMENO F.In vitro simulation of rumen fermentation:apparatusand effects of dilution rat and continuous dialysis on fermentation and protozoal population[J].Journal of Animal Science,1973,36:941-948.
[23] CRAWFORD R J Jr.,HOOVER W H,JUNKINS L L.Effects of solids and liquid flows on fermentation in continuous cultures.Nitrogen partition and efficiency of microbial synthesis[J].Journal of Animal Science,1980,51:986-895.
[24] ESTELL R E Ⅱ,GALYEAN M L.Relationship of rumen fluid dilution rate to rumen fermentation and dietary characteristics of beef steers[J].Journal of Animal Science,1985,60:1061-1071.
[25] ISAACSON H R,HINDS F C,BRYANT M B,et al.Efficiency of energy utilization by mixed rumen bacteria in continuous culture[J].Journal of Dairy Science,1975,58:1645-1659.
[26] MAENG W J,CHANG M B,YUN H S.Dilution rates on the efficiency of rumen microbial growth in continuous culture[J].Asia-Australia Journal of Animal Science,1989,2:477-480.
[27] COLEMAN G S,SANDFORD D C.The engulfment and digestion of mixed rumen bacteria and individual bacterial species by single and mixed species of rumen ciliate protozoa grownin vivo[J].The Journal of Agricultural Science,1979,92:729-742.
[28] NEWBOLD C J,HILLMAN K.The effect of ciliate protozoa on the turnover of bacterial and fungal protein in the rumen of sheep[J].Letters in Applied Microbiology,1990,11:100-102.
[29] WANG M Z,WANG H R,YU L H.Effects of forage level in diet on bacterial protein recycling in goat’rumen[J].Research Journal of Animal Science,2010,4:10-15.
[30] MARTÍNEZ M E,RANILLA M J,RAMOS S,et al.Effects of dilution rate and retention time of concentrate on efficiency of microbial growth,methane production,and ruminal fermentation in Rusitec fermenters[J].Journal of Dairy Science,2009,92:3930-3938.

